【有机】乙炔-硫醇点击化学助力含硫大环的合成
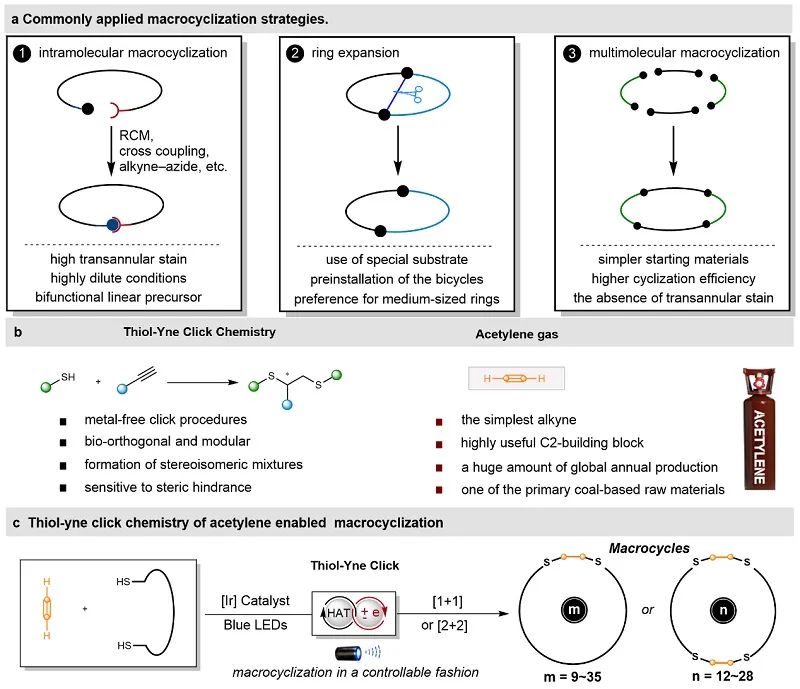
长期以来,大环骨架是合成化学和药物化学领域研究的热点之一,因为大环拓扑结构在提高药理活性、选择性以及完善成药性方面有着独特的优势和潜力,并且在一定程度上兼顾了与靶标结合的微观结构和药代动力学所需求的宏观性质。由于构建此类化合物要面临成环时熵减少、反应活化能较高且环张力比较大等不利因素,因此,如何让线性前体原料定向转化为具有特定三维结构的大环分子仍然面临巨大的挑战。在过去的几十年里,合成化学家们发展了很多合成大环的策略,根据大环化过程可将其主要分为以下三类:1) 首-尾相接的单分子环化;2) 并环骨架的碎裂(重排)扩环;3) 精准活化定向对接的多分子大环化。前两种方法倾向于利用特殊的模板诱导、高度稀释或者缓慢滴加的反应条件以及需要提前多步合成复杂并环单元和双功能线形前体,这严重阻碍了大环功能分子在有机合成中的应用前景。与之相比,开发多分子大环化方法具有重要的科学意义,由于多分子大环策略不但线性前体来源丰富、成环效率高,而且可以消除以往成环策略中所遇到的环张力等限定性因素。
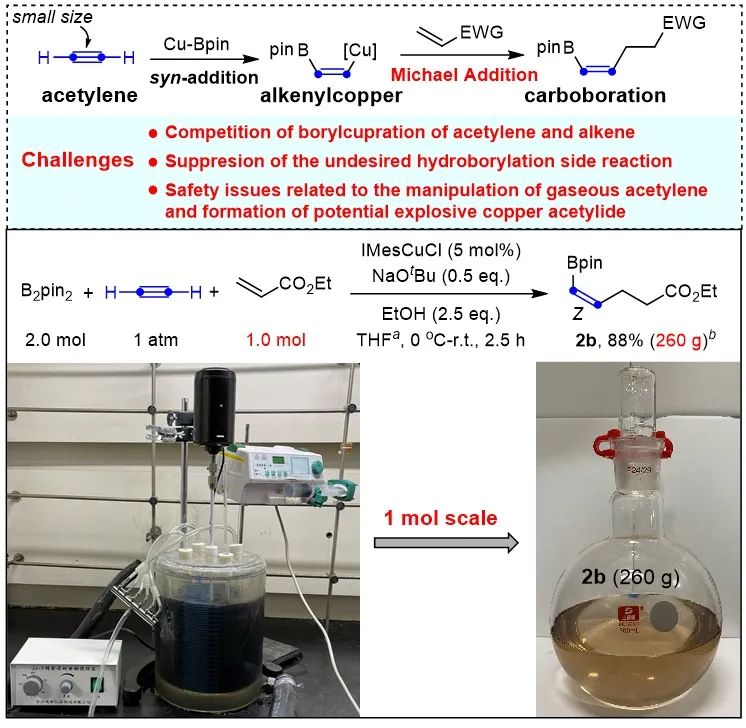
此外,在铜催化下,他们也成功实现了乙炔气的碳硼化反应,该反应为顺式烯基硼骨架的合成提供了一条简便直接的途径,值得一提的是该催化体系展现出了稳健的合成应用前景,可以实现1 mol级别的规模化合成,以88%的收率得到260克顺式-烯基硼化合物,为乙炔的高附加值转化提供重要的参考(Chem. Sci., 2022, 13, 7604,图3),该工作第一作者为博士研究生程泰然。
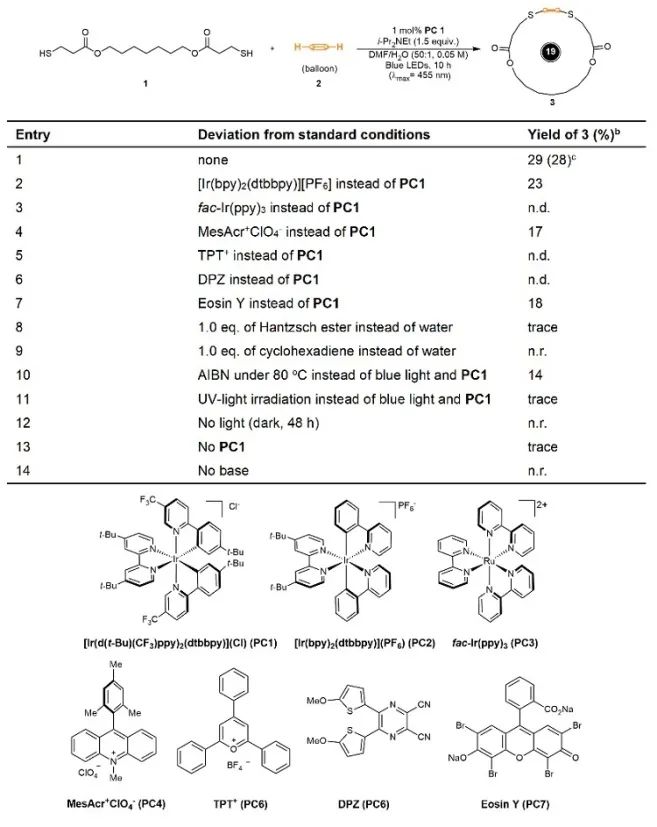
在此基础上作者通过改变链状二硫醇分子的链长来考察该成环反应的底物适用范围(图4)。结果表明,线性链状二硫醇分子的长短对对成环效率没有明显的影响,可成功构建一系列结构多样的含硫大环骨架,值得一提的是该体系可以拓展到轴手性、中心手性以及螺手性大环的构建。单晶衍射结果表明[-S-CH2-CH2-S-]结构单元在调控大环构型方面展现出独特的优势。
![基于 [1+1]模式的乙炔-硫醇点击化学助力含硫大环 基于 [1+1]模式的乙炔-硫醇点击化学助力含硫大环](https://www.3s-tech.net/upload/images/2022/9/b25738c8f3a68186.jpg)
除[1+1]模式的大环化,大环冠硫醚也能通过上述方法经可控的[2+2]和[1+1]模式高效制备。单晶衍射结构显示,[-S-CH2-CH2-S-]片段为支撑结构的冠醚在环张力作用下发生了一定的改变,从原本无规则结构变成了“方形”结构(图5)。该成环反应为原本需要特殊过程制得的冠醚化合物提供了一个高效、可靠的合成方法。
![基于[2+2]和[1+1]模式的乙炔-硫醇点击化学助力含硫大环 基于[2+2]和[1+1]模式的乙炔-硫醇点击化学助力含硫大环](https://www.3s-tech.net/upload/images/2022/9/e8bdbcd23b3ae185.jpg)
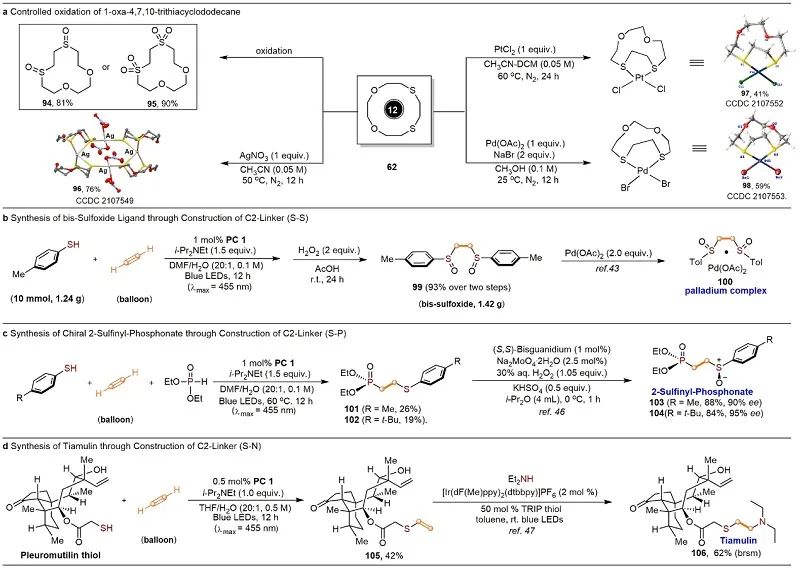
之后,作者对所得产物进行了转化,首先是通过选择性氧化合成了亚砜/砜大环(图6a)。同时可以克级规模的制备线性双亚砜和手性单亚砜配体(图6b-c)。最后,作者利用乙炔参与的点击化学为关键步合成了具有[-N-CH2-CH2-S-]片段的兽药-泰妙菌素。
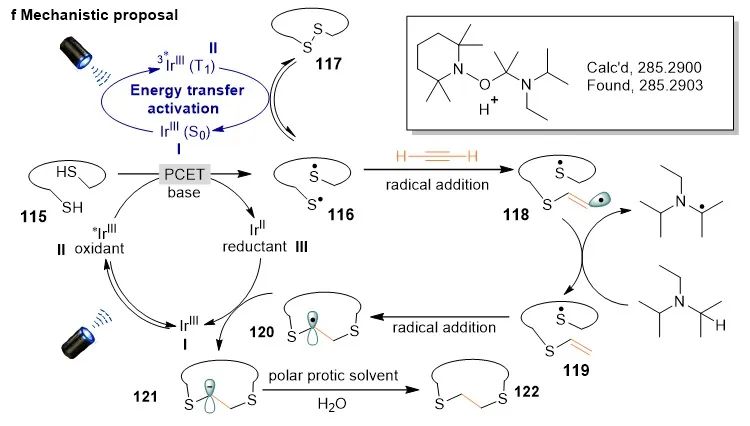
尽管巯基自由基加成到取代炔烃的机理已被人们广泛的探究,但是涉及到乙炔参与的加成反应没有报道。为了深入了解反应机理,作者进行了一系列自由基中间体捕获、反应动态追踪,同位素标记和碳负离子捕获实验佐证该反应经历了极性交叉的硫氢化过程。基于上述实验,作者提出了可能的反应机理(图7)。
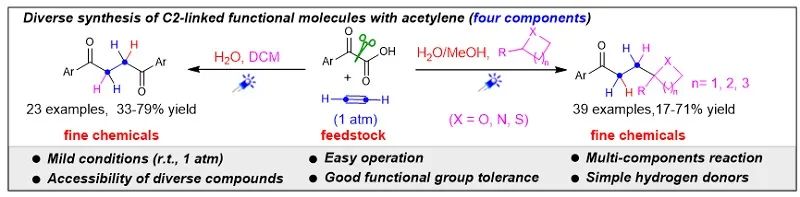
华南理工大学祝诗发课题组通过使用廉价且丰富的工业原料乙炔作为C2合成砌块,在温和的光催化条件下成功地实现了乙炔-硫醇的点击大环化反应。该方法具有非常广泛的底物范围,并成功应用于金属簇配合物、亚砜配体以及兽药泰妙菌素的合成。此外,通过自由基捕获实验、同位素标记和碳负中间体的捕捉实验成功揭示了其机理属于极性交叉范畴。这一研究成果为利用点击化学的手段实现大宗化学品乙炔的高附加值转化提供了一种思路。
Thiol-Yne click chemistry of acetylene-enabled macrocyclization





