摘要:近期,Seth Herzon课题组完成了修正后的(-)-lomaiviticin A结构的单体合成,从而在进一步佐证结构修订的同时,发展了合成(-)-lomaiviticin A所需的糖基化、重氮化及骨架构建等关键反应
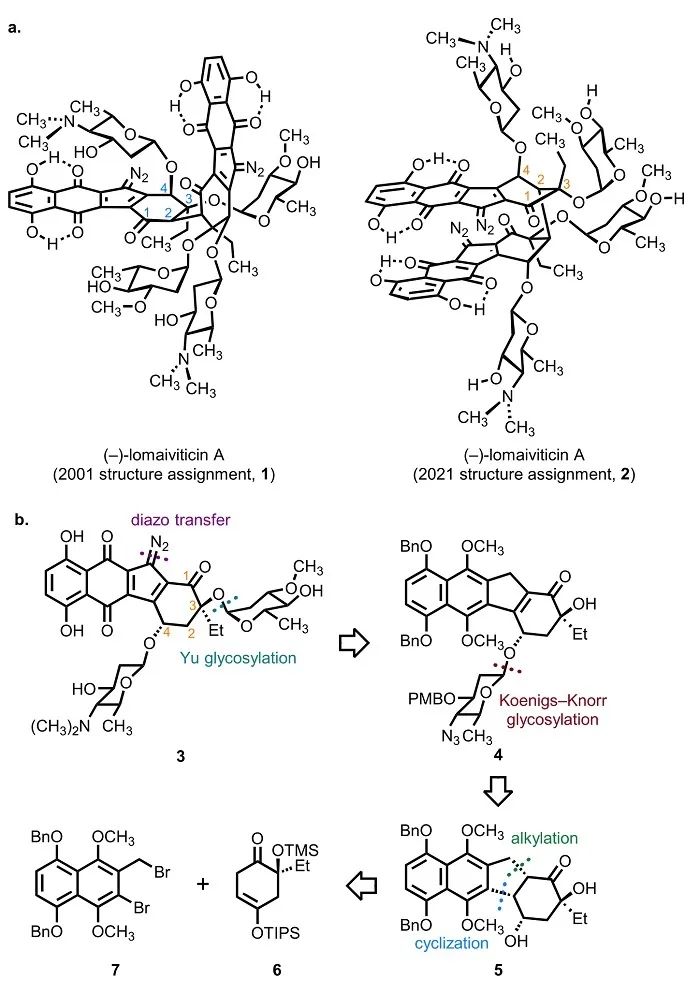
2001年,Wyeth Pharmaceuticals和犹他大学的研究者通过生物活性指导手段分离细菌代谢物(-)-lomaiviticin A。(-)-lomaiviticin A的细胞毒性极高,对多种癌症细胞系的半抑制浓度(IC50)低至mM级别。基于核磁共振和高分辨率质谱,以及通过与已知天然产物kinamycin的结构进行对比,研究者将(-)-lomaiviticin A的结构鉴定为1。该分子结构具有C2对称性,包含两个重氮四氢苯并[b]芴基团(diazofluorene)和四个2,6-双脱氧糖基团。研究表明(-)-lomaiviticin A独特的二聚体结构以及重氮基团可以诱导产生细胞毒性极高的DNA双链断裂(DNA DSBs)。独特的活性作用机理和复杂的分子结构使得包括K.C Nicolaou、Matthew D. Shair 和Seth B. Herzon在内的许多课题组都将(-)-lomaiviticin A长期作为合成研究的目标分子。尽管如此,研究者们在长达二十年的时间里仍未能完成任何lomaiviticin家族天然产物的全合成。而由于同样没有晶体结构的支持,lomaiviticin的结构鉴定事实上始终未能得到验证。2021年,Hosea M. Nelson课题组(加州理工大学)和Seth B. Herzon课题组(耶鲁大学)使用先进的高场核磁共振技术和微晶电子衍射(microED)手段,结合密度泛函理论计算(DFT)对(-)-lomaiviticin A的结构进行了了修正(2,图1)。近期,Seth Herzon课题组完成了修正后的(-)-lomaiviticin A结构的单体合成,从而在进一步佐证结构修订的同时,发展了合成(-)-lomaiviticin A所需的糖基化、重氮化及骨架构建等关键反应。相关成果发表在J. Am. Chem. Soc.上。
逆合成分析和合成路线
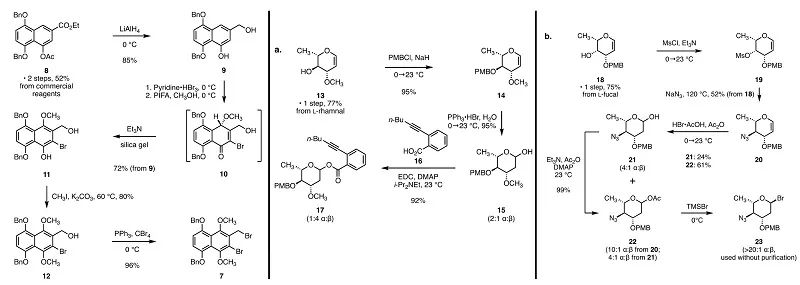
对3的逆合成分析最终指向了合成重氮四氢苯并[b]芴的两个片段:保护的萘酚衍生物7和环己烯酮6,以及糖基化给体17和23(图1)。萘酚片段7的合成首先由已知化合物8经氢化铝锂还原得到一级醇9,再经溴化后经过氧化去芳香化在酚羟基对位引入甲氧基得到酚11。11经甲基保护后又经一步Appel反应得到二溴化物片段7(图2)。对于两个糖基化给体17和23,已知的鼠李烯糖衍生物13经PMB保护和加成水两步反应得到还原糖15,再经酯化反应得到糖基邻炔基苯甲酸酯给体17。已知的岩藻烯糖衍生物18经手性翻转的叠氮取代反应产生烯糖20,再经乙酸加成和溴化反应得到糖基溴化物给体23。已知的二醇24经过IBX氧化和TMS保护得到最后一个片段环己烯酮6(图3)。环己烯酮6在KHMDS攫氢后同二溴化物7发生α-烷基化反应得到化合物25。25在还原性自由基环化反应的条件下关环形成重氮四氢苯并[b]芴中五元环的结构并完成四环环系的构建,再经TBAF脱除硅保护基得到二醇5。作者通过两种不同的条件将二醇5转化为硒化物26,用于后续的糖基化反应。
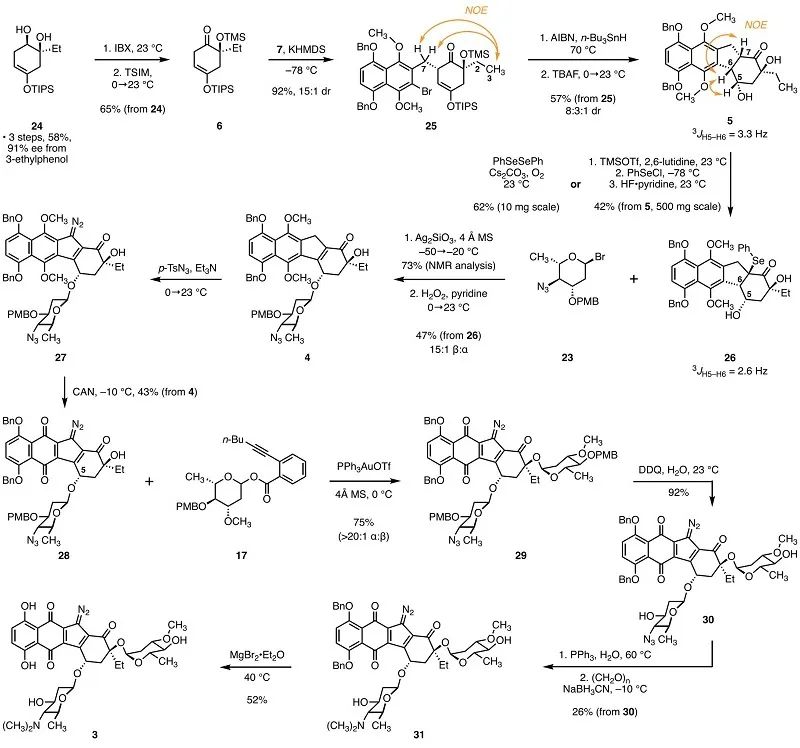
β-糖L-pyrrolosamine的片段由Koenigs-Knorr糖基化反应引入。硒化物26与糖基溴化物23在硅酸银和4 Å分子筛的条件下反应,反应温度由−50°C逐渐升温至−20°C,进而高选择性的实现了β-糖基化(β:α = 15:1)。糖基化产物经苯硒基的氧化消除得到烯酮4。作者使用对甲苯磺酰叠氮对化合物4进行重氮转移反应,得到重氮氢化萘醌27。由于其不稳定,立即对其使用硝酸铈铵进行氧化脱保护得到重氮萘醌28。经过一系列条件筛选,作者最终选择了PPh3AuOTf催化的俞氏糖基化反应,实现了高选择性的α-糖基化(α:β > 20:1)并合成了全部片段链接完成的分子29。29先经DDQ脱除糖片段的PMB保护,再经Staudinger反应和还原胺化在β-糖片段中引入二甲胺基团得到31。最后,作者使用乙醚溴化镁脱除酚羟基的苄基保护,完成了lomaiviticin A单体3的合成。作者将单体3的核磁碳谱同(-)-lomaiviticin A进行了比较。除(-)-lomaiviticin A中桥连两个单体的2号碳外,其余的化学位移均方根误差仅为1.68 ppm。这一结果验证了结构修订的正确性。作者还以(-)-lomaiviticin A作为阳性对照对于合成的单体3进行了细胞毒性测试。对于测试的四种癌症细胞系,(-)-lomaiviticin A都具备nM级别的细胞毒性,而单体3则在<1 μM的浓度下不具备细胞毒性。这一结果进一步说明了(-)-lomaiviticin A的二聚体结构对于其细胞毒性起着决定性的作用。综上,来自耶鲁大学Seth B. Herzon课题组的研究人员们继2021年完成lomaiviticin家族天然产物的结构修订后,又于近期又完成了lomaiviticin A单体的全合成。该路线使用了高效的片段连接方法和高立体选择性的糖基化反应,为最终实现(-)-lomaiviticin A的全合成打下了基础。本文的共同第一作者是课题组四年级博士生徐植和四年级博士生Mikaela DiBello。二年级博士生王泽淳,John A. Rose博士、陈磊博士和李昕博士均对本课题做出了贡献。
Stereocontrolled Synthesis of the Fully Glycosylated Monomeric Unit of Lomaiviticin AZhi Xu, Mikaela DiBello, Zechun Wang, John A. Rose, Lei Chen, Xin Li, Seth B. HerzonJ. Am. Chem. Soc., 2022, DOI: 10.1021/jacs.2c07631
本文的通讯作者Seth B. Herzon是耶鲁大学化学系Milton Harris ’29 Ph.D. 教授,耶鲁大学医学院药理与放射医学教授,耶鲁癌症研究中心成员。Herzon课题组致力于复杂天然产物的全合成研究。课题组在对于lomaiviticin家族天然产物,抗生素pleuromutilin及其衍生物,和肠道菌群基因毒素colibactin进行系统研究的同时,也在近年来完成了euonyminol, myrocin G, batzelladine B等多个复杂天然产物的全合成以及糖基化,烯烃官能化等有机方法学的发展研究。课题组重点关注天然产物分子或药物分子的细胞毒性,通过与生物和医学领域研究者的广泛合作,为阐明细胞毒性天然产物lomaiviticin和colibactin的作用机理做出了重要贡献,并在近期发展了一类针对脑癌的高特异性靶向抗癌分子。








