山东大学卞小莹/张友明团队Angew Chem: 两种β-羟基化氨基酸的不同生物合成机制
近日,山东大学卞小莹教授和山东大学/中科院深圳先进院张友明教授团队,以基因组挖掘发现的新型非核糖体脂肽Glidomides为研究对象,通过生物信息学分析,体内原位敲除和大量的体外酶学相结合的策略,阐明了Asp羟化酶和His羟化酶的催化形成羟基化氨基酸的不同机制。首次确定了非核糖体肽合成酶中Interface结构域(I domain)的功能,通过保守位点E54和D166负责招募羟化酶GlmF,从而行使催化功能。本研究首次阐明了新型 I 结构域在羟基化氨基酸形成中的功能和作用机制,加深了对非核糖体肽合成酶多样性的认识,而且为生物合成单一构型的β-羟基化氨基酸的提供了新思路,有助于设计和改造非核糖体肽合成酶获得更多新型天然产物。该论文被期刊编辑选为Frontispiece(扉页论文,下图)高亮推荐。

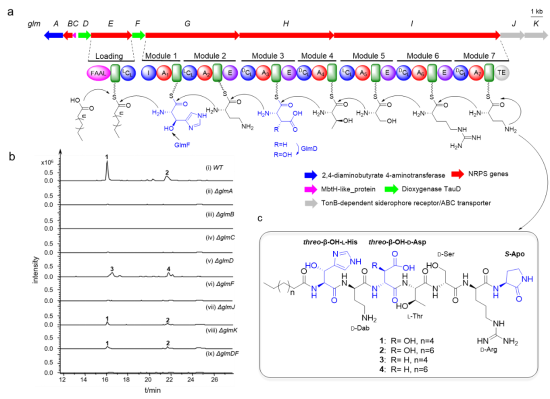
(2)threo-β-OH-D-Asp的生物合成:缩合结构域(C domain)影响模块3中腺苷化结构域(A domain)对不同底物的识别能力;GlmD催化NRPS模块3中的CA3T3E蛋白结合的最佳底物L-Asp发生反应,产生β-OH-L-Asp,与终产物1中β-OH-D-Asp相比构型发生了异构。异构化结构域(E domain)处于该基因簇的中部,因此推测E结构域的真正催化底物是硫醇化结构域(T domain)绑定的肽酰,而不是T绑定的氨酰。T绑定的肽酰在体内发生异构化后,经多步模块反应形成终产物1。因此证明了GlmD催化Asp羟基化,且先于异构化。
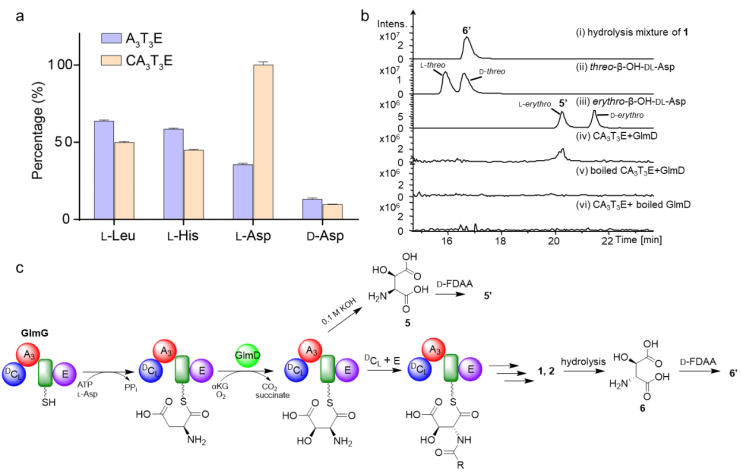
A3结构域对底物的识别及LC-MS分析GlmD的体外酶学催化反应。(a) 通过焦磷酸盐释放方法检测A3结构域对底物的识别;(b) LC-MS分析GlmD的体外酶学催化反应;(c) GlmD催化天冬氨酸羟基化的示意图。
(3)threo-β-OH-L-His的生物合成:I结构域对A1结构域对底物专一性识别影响不大。GlmF催化NRPS模块1中IA1T1蛋白结合的底物L-His发生反应,产生β-OH-L-His,而A1T1蛋白则不产。为进一步验证该结果,负责脂肪酸链加载的GlmE蛋白分别与其进行反应,结果显示实验组均可以产生目标产物8和9,但A1T1蛋白组中的产量较IA1T1蛋白组的产量降低了90%。这一结果表明,I结构域在GlmF催化组氨酸羟基化的形成过程中起着重要作用。
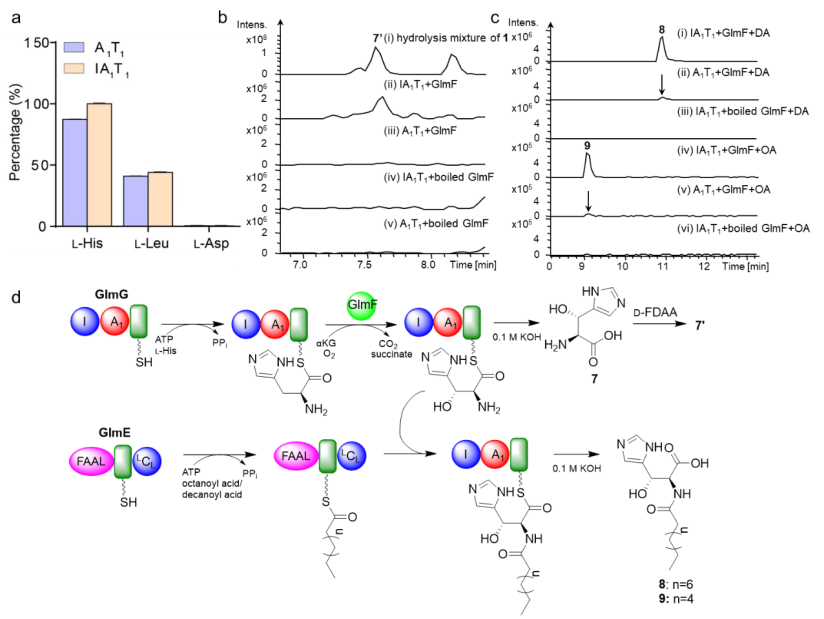
A1结构域对底物的识别及LC-MS分析GlmF的体外酶学催化反应。(a) 通过焦磷酸盐释放方法检测A1结构域对底物的识别;(b) LC-MS分析GlmF的体外酶学催化反应;(c) LC-MS分析GlmF和GlmE的体外酶学催化反应;(d) GlmF催化组氨酸羟基化的示意图。
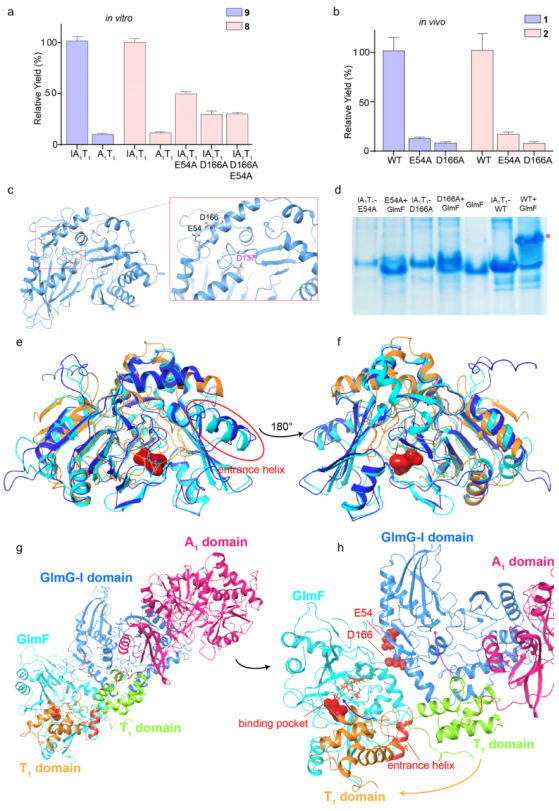
(4)IA1T1蛋白与羟化酶GlmF的互作研究:I结构域是缩合结构域的一个新分支,仅包含保守位点Asp,而缺少了保守的催化位点His。I结构域呈V字型,由N端亚结构域和C端亚结构域构成。作者发现R18,R19和R310三个位点阻断了底物结合口袋,保守位点R344的缺失使得T结构域无传递底物的结合位点。因此I结构域不能结合底物且不具有催化活性。突变结果显示,I结构域的突变体E54和D166与GlmF的互作条带消失,且E54和D166致使终产物1和2及体外目标产物8的产量降低。E54和D166在空间位置很近且氨基酸侧链均朝外,因此I结构域是通过保守位点E54和D166介导与GlmF的相互作用。与催化游离氨基酸底物的羟化酶相比,GlmF在结构上呈现一个特殊的entrance helix,推测其在羟基化氨基酸形成过程中与T结构域负责的底物呈递存在相关性。基于以上结果,首次提出组氨酸羟基化产生机制:A1结构域识别L-His,递送形成T1-L-His;I结构域通过E54和D166招募羟化酶GlmF;T1结构域将底物递送至GlmF的底物结合口袋,发生羟基化后,T1结构域进一步将羟基化底物递送至GlmE的C结构域催化口袋,与脂肪酸链发生缩合。