南开大学沈铸瑞ACB:微界面Au-O-Ce位高选择性光催化还原CO2制乙烷

全文速览:
迄今为止,高效的光催化将CO2转化为高价值的C2产品仍然是一个巨大的挑战。在此,我们开发了微界面上带有Au-O-Ce位点的Au-CeO2纳米复合材料,以实现CO2向C2H6的高度选择性转化。通过原位傅里叶变换红外光谱(FTIR)证实了COCO*关键中间体的形成,表明Au-CeO2微界面可以促进CO*在解吸前的多电子还原,并使C2物种的生成成为可能。理论计算表明,微界面Au-O-Ce位点可以降低COOH*和COCO*生成的能垒,促进C2H6的生成。因此,Au-CeO2纳米复合材料的C2H6产率为11.07µmol g−1 h−1,电子选择性为93.1%(产物选择性为65.3%),可与目前最先进的光催化剂相媲美。
背景介绍:
这篇文章的研究背景是关于CO2的高选择性光催化还原为乙烷的挑战。由于CO2中C-O键的解离能非常高,将CO2转化为有价值的化学品是一项具有挑战性的任务。目前,CO2的光催化还原主要生成C1产品,如甲烷、一氧化碳和甲醇,这是由于中间体COOH*的形成能垒较高。然而,一些研究表明,通过缓慢的多电子还原和C-C偶联反应,CO2可以转化为具有更高能量密度和经济价值的C2产品,如乙烯、乙烷和醋酸。然而,目前的光催化剂对于C2产品的选择性较低,且产率和选择性仍不足以实现工业化应用。因此,开发具有高效率和选择性的新型光催化剂仍然是一个重要的挑战。
图文解析:
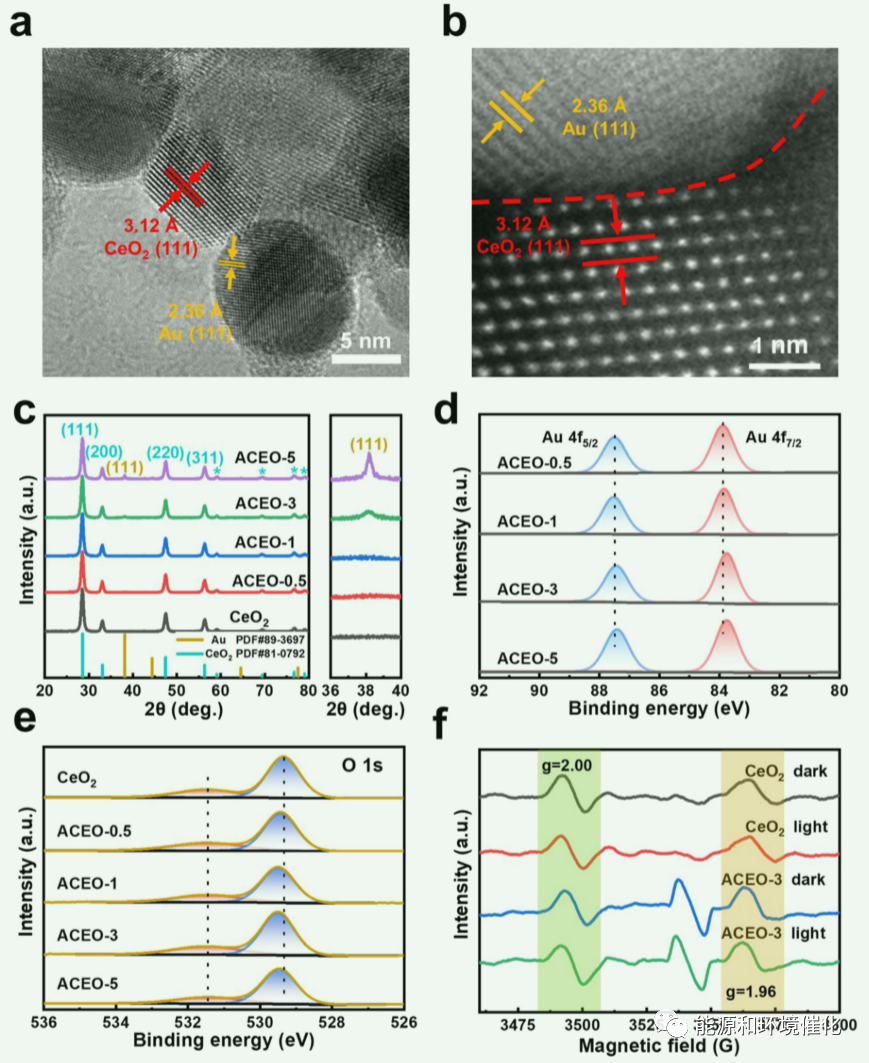
图1:。(a) ACEO-3 HRTEM和(b) HAADF-STEM图像。(c) (d) Au 4f和(e) O 1s的XRD谱图、XPS谱图以及(f) ACEO-x样品的EPR谱图。
HRTEM图像(图1(a))进一步显示Au和CeO2纳米晶体约为5-10 nm。CeO2纳米晶体与Au纳米晶体紧密结合在图像中心,面间距离为2.36和3.12 Å,分别属于Au和CeO2的(111)晶面。此外,采用HAADF-STEM分析方法研究了Au - CeO2纳米晶微界面的原子结构。如图1(b)所示,可以在1 nm尺度下观察到微界面。Ce原子(较低位置的亮点)与Au晶体晶格接触密切,可能导致了一定程度的界面化学键合,例如Au- o -Ce,这一点将在力学研究[25]中通过理论计算详细说明。除ACEO-3外,还制备了其他不同数量Au纳米晶的ACEO-x样品进行比较(图1(c) - (f))。如图1 (c)所示,所有的ACEO-x样品都表现出相似的XRD谱图,均归属于立方相CeO2 (PDF# 43-1002)。此外,随着Au含量的增加,一个新的峰值出现在38.1◦,对应于Au(111)晶体面,进一步证明了Au纳米晶体的成功组合。此外,随着Au含量的增加,样品颜色变深,Au纳米晶尺寸略有增大。如图1(d)所示,随着Au含量的增加,Au 4 f7/2的结合能(BEs)负移0.1 eV,而Au 4 f5/2的结合能(BEs)保持[15]不变。这些结果表明,Au纳米晶处于金属态。然而,在微界面上的Au原子可能会收集更多的电子。随着Au含量的增加,O 1 s的峰值正移0.18 eV(图1(e)),表明在微观界面上O原子的电子密度下降。这些结果表明,在Au- ceo2的微界面上存在Au-O- Ce原子结构,O原子向Au原子提供电子,并产生可能的CO2光还原活性位点。EPR谱图(图1(f))显示,原始CeO2和ACEO-3均表现出两种Ce3+信号,g因子分别为1.96和2.00。Ce3+离子的不饱和配位有利于其周围OV位的形成。
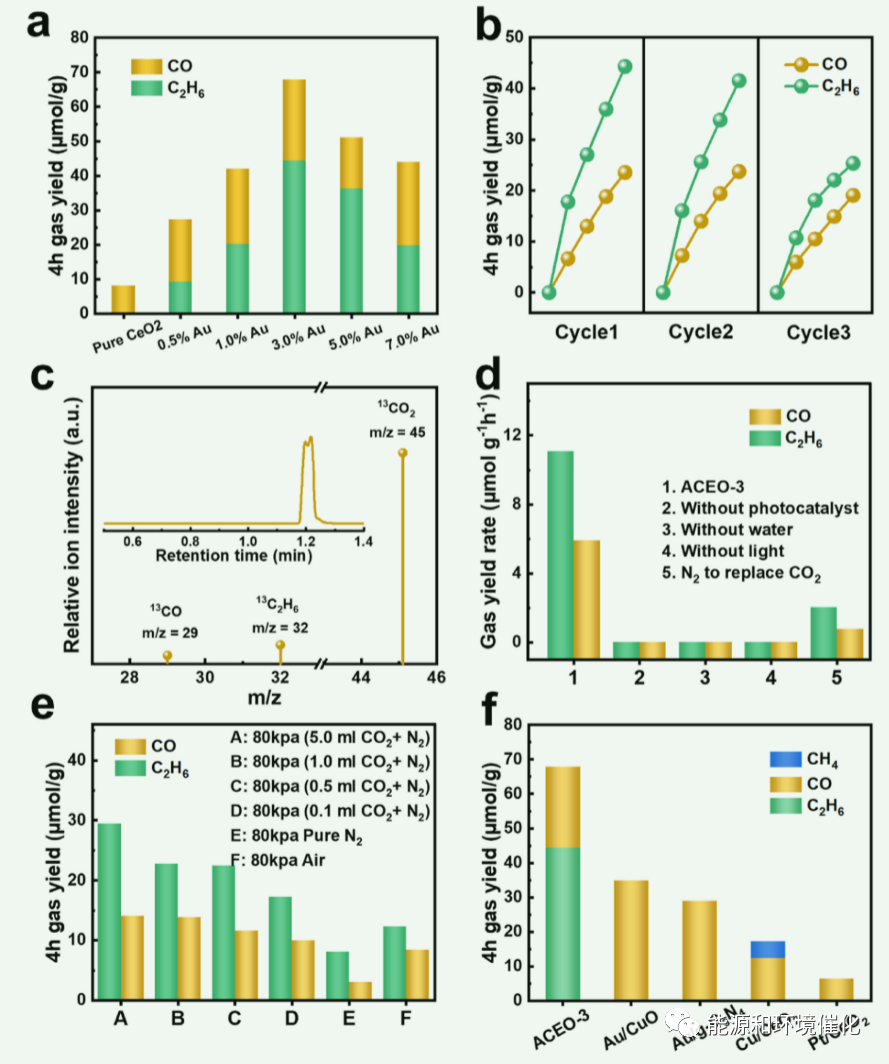
图2:样品的CO2光还原特性。(a) CO和C2H6生成率随ACEO-x中Au含量的变化。(b) ACEO-3光催化CO2还原过程的循环活性测试。(c)在潮湿的CO2气氛下氙光照射4 h后ACEO-3上产物的13C同位素分析光谱。(d)对照组实验,消除系统误差或无关变量的影响。(e) ACEO-3在不同浓度CO2下的光催化活性。(f)以ACEO-3、Au/CuO、Au/g-C3N4、Cu/CeO2和Pt/CeO2为催化剂进行光催化CO2还原的气体产率。
在气固反应体系中,用模拟太阳光照射催化剂,评价其光催化CO2还原性能(图2(a))。该系统检测到的主要产物是一氧化碳和乙烷。在光照4 h时,原始CeO2的CO2光还原活性表现为CO2的生成速率为2.02µmol g−1 h−1,而C2H6未检测到。相反,随着Au含量的增加,主要产品发生了转移从CO到C2H6。CO2还原反应速率(CO2RR)呈先升高后降低的趋势。这是因为当Au含量进一步增加时,更多的Au纳米粒子会覆盖更大的CeO2表面。这使得CeO2的吸光面积变小,降低了催化剂对CO2的吸附能力。当Au含量为3 wt%时,CO和C2H6的产率达到最大值,分别为5.88和11.07 μmol g−1 h−1,CO和C2H6的产率是原始CeO2的8.39倍。C2产物的形成是由Au- ceo2微界面决定的,Au含量的增加使Au- ceo2微界面暴露更多(机理研究证实了这一点)。当Au含量进一步增加到7%时,更多的Au纳米粒子覆盖在CeO2表面,使得更多的CO2分子被Au纳米粒子吸附,并通过Au的热电子转化为CO。因此,当Au含量为7%时,C2H6的选择性降低。如图2(b)所示,连续模拟阳光照射12 h后,ACEO-3的光催化稳定性略有下降。在连续3个光催化循环中,C2H6的进化速率分别为11.07、10.38和6.33µmol g−1 h−1,CO的进化速率分别为5.88、5.92和4.76µmol g−1 h−1。接下来,在相似的测试条件下,通过GC-MS的13CO2同位素标记实验,确定碳产物中C的来源(图2(C))。在ACEO-3质谱中观察到m/z = 29和32的特征峰,其强度比为1:2,与CO和C2H6的产率比(1:19 .9)一致。由于产氧实验中没有生成O2(图S16),在m/z = 29和32处的特征峰分别属于13CO和13C2H6。这个结果证实了CO2是这个反应中唯一的C源。对照实验进一步研究了光催化剂、水、光和CO2的作用(图2(d))。在没有光催化剂、水、光或CO2的情况下,CO或C2H6不会生成,进一步说明这四个因素对CO2光还原至关重要。当催化剂在N2中反应时,由于N2中含有少量的CO2,产生了少量的CO和C2H6。因此,设计了在低浓度CO2下使用ACEO-3进行梯度实验(图2(e))。系统先抽真空,然后加入固定体积的大气CO2,最后填充氮气至80kpa。与纯CO2相比,在N2中加入5 mL大气CO2时,碳产率为64.1%。此外,随着CO2浓度的降低,碳产物的生成也减少,说明ACEO-3对N2中的CO2浓度非常敏感。在空气中,ACEO-3产生一定量的碳产物(CO: 2.09µmol g−1 h−1;C2H6: 3.05µmol g−1 h−1),表明该催化剂具有较高的工业价值。为了进一步证明Au和CeO2在C2H6生成过程中的作用,采用相同的合成方法分别制备了Au/CuO、Au/g-C3N4、Cu/CeO2和Pt/CeO2进行比较。如图2(f)所示,用CuO或g-C3N4替代CeO2后,只得到CO作为产物,证实Au只能与CeO2结合生成C2产物。同样,用Cu和Pt代替Au后,只产生了CH4和CO,说明Au在C2产物的形成中起了重要作用。这些结果表明,Au和CeO2都是生成C2产物的必要条件。
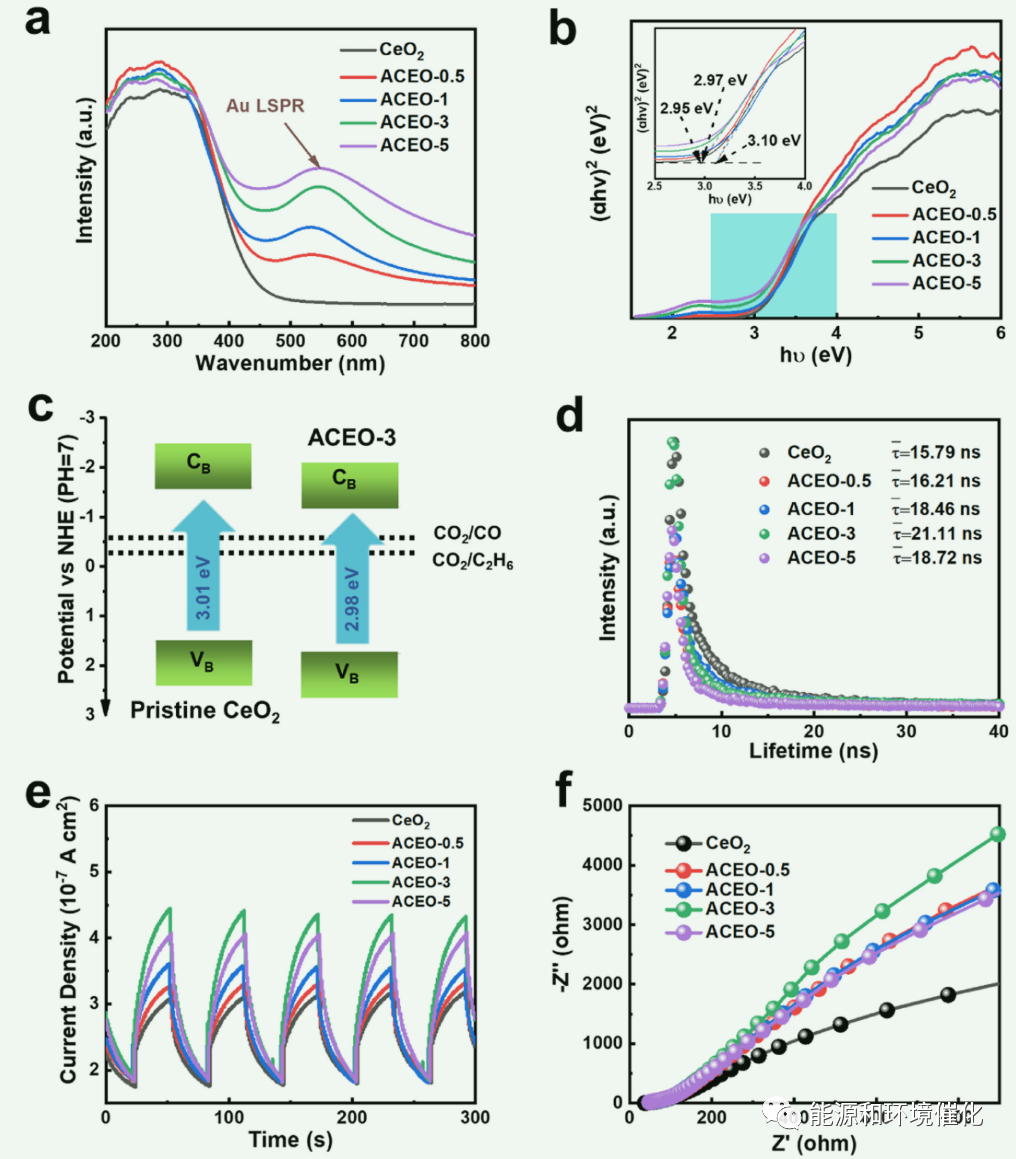
图3:(a)原始CeO2和ACEO-x的紫外-可见DRS光谱。(b)原始CeO2和ACEO-x的带隙。(c)电子能带结构示意图;蓝色箭头表示电子跃迁过程。CB,导通带;VB,价带。(d)时间分辨荧光光谱。(e)光照下的光电流响应和(f)在黑暗条件下获得的样品的电化学阻抗谱(EIS) Nyquist图。
通过光电化学行为(图3)、原位中间体研究(图4)和理论模拟(图5和图6),揭示了Au-CeO2纳米复合材料高效生成C2产物的机理。UV-vis DRS光谱(图3(a))显示,ACEO-x比原始CeO2表现出更强的光吸收强度,这主要是由Au的LSPR效应引起的。利用Tauc图(图3(b))计算CeO2和ACEO-x的直接带隙能(Eg)分别为3.10、3.10、3.10、2.95和2.97 eV。得到的带结构示意图如图3(c)所示。E0 (CO2/CO =−0.52 V vs. NHE;CO2/C2H6 =−0.27 V vs. NHE)介于CB和VB之间,说明CeO2和ACEO-3具有合适的带隙来生成CO和C2H6。同样,在时间分辨荧光光谱中(图3(d)), ACEO-3的载流子寿命最长,说明Au含量为3%时最有利于电子和空穴的分离。此外,在光电化学和EIS分析中,ACEO-3表现出较高的光电流和较小的圆弧半径(图3(e) - (f)),进一步验证了上述结果。与原始CeO2相比,Au-CeO2的微界面可以使更多的光电子参与到光还原反应中,从而提高了其光还原活性。
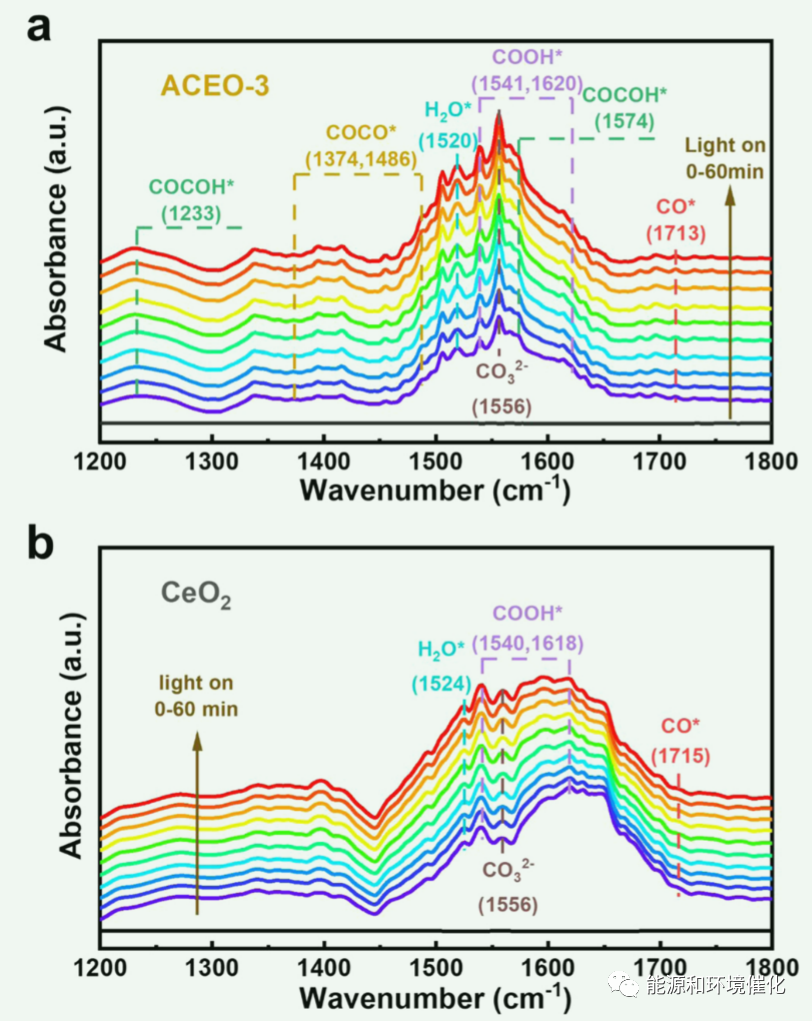
图4:CO2和H2O的混合物在(a) ACEO-3和(b) CeO2上的共吸附的原位红外光谱分析。
原位FTIR测试用于识别C2产品的关键中间体(图4)。对于ACEO-3,其特性在1556和1520 cm−1处的峰分别归属于CO3 2−*和H2O*(图4(a))。这些峰的强度随着光照时间的增加而增加,说明CO2和H2O都在持续参与光还原反应。此外,还观察到生成CO的重要中间体,包括COOH*(在1540和1620 cm−1)和CO*(在1713 cm−1)。其中,COOH*的生成是反应的限速步骤,CO*代表CO的生成。此外,还观察到了几个重要的C2中间体,如COCO*(1374和1486 cm−1)和COCOH*(1233和1574 cm−1),为C2H6的生成提供了有力的证据。
如图4(b)所示,原始CeO2在1556和1524 cm−1处有与ACEO-3相同的特征峰,表明CO2分子在吸附和初始活化阶段的反应路径相似。而对于原始CeO2,只观察到CO的中间体(COOH*和CO*),而未检测到C2的中间体(COCO*, COCOH*),说明Au-CeO2的微界面对C2的生成起着决定性的作用。
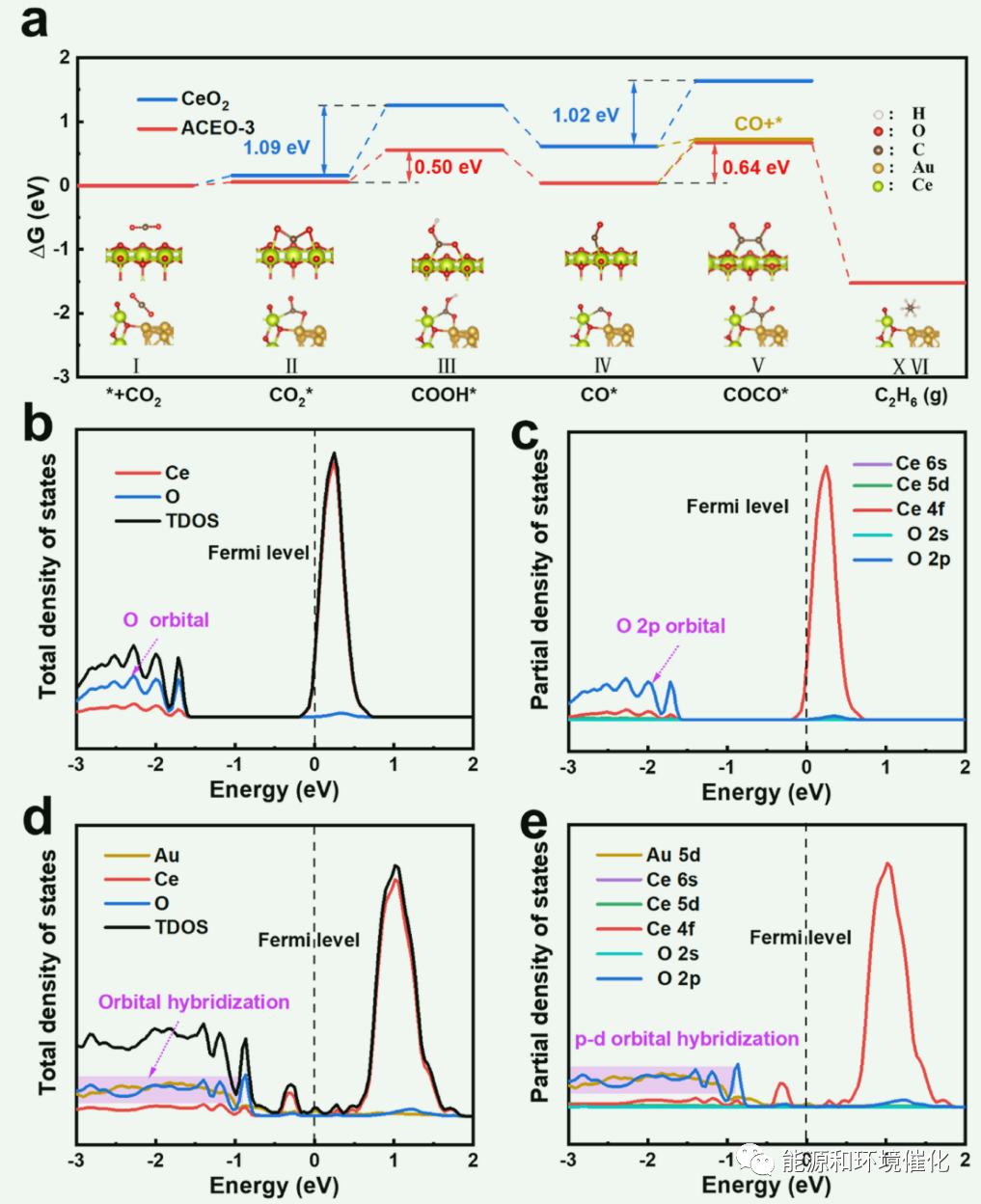
图5:(a)光催化CO2还原的吉布斯自由能计算的反应路径。(b) CeO2上各元素的总态密度和总轨道分布,以及相应的(c)O2 s、O2p、Ce6 s、Ce5d和Ce4f轨道分布的预计态密度。(d) ACEO-x上各元素的总态密度和总轨道分布,以及相应的(e) O2 s、O 2p、Ce 6 s、Ce 5d、Ce 4f和Au 5d轨道分布的态密度投影。
利用密度泛函理论(DFT)进一步探讨了Au-CeO2体系的形成机理。利用TEM图像中CeO2的(111)面进行建模,引入Au32纳米团簇,其中Au粒子与CeO2通过O原子连接。然后,为了支持原位傅里叶变换红外光谱的推测,在分子水平上进行了吉布斯自由能计算来进一步验证这一途径。首先,通过比较OV对CO2的吸附量(理论模型中采用OV和Au-O-Ce),确定了CeO2和ACEO-x的活性中心。Gibbs自由能计算结果如图5(a),其中COOH*的生成和CO*的解吸是主要的限速步骤。COOH*中间体的形成是吸热的,具有较高的活化能垒。Au-CeO2微界面的形成改变了反应的活性位点,使COOH*势垒由1.09 eV降低到0.50 eV。此外,原始CeO2的CO*解吸能低于ACEO-x,但ACEO-x表现出较高的CO产率,因为Au-O-Ce可以促进COOH*的生成。此外,根据密度泛函理论计算,原始CeO2的总态密度(TDOS)的顶部Vb主要归因于图5(B)中O的轨道,而底部的Cb主要对应于Ce的轨道。考虑到偏态密度(PDOS),O2p和Ce 4f轨道分别在Vb和Cb中起主要作用(图5(C))。ACeO-x中TDOS的顶部Vb主要由图5(D)中Au和O元素的轨道组成,表明Au和O原子之间存在联系。ACeO-x的底部CB与原始CeO2相同。为了进一步研究Au和O原子的轨道杂化,计算了PDOS,如图5(E)所示。O2p轨道与Au 5d轨道几乎重合,表明是p-d混合轨道。
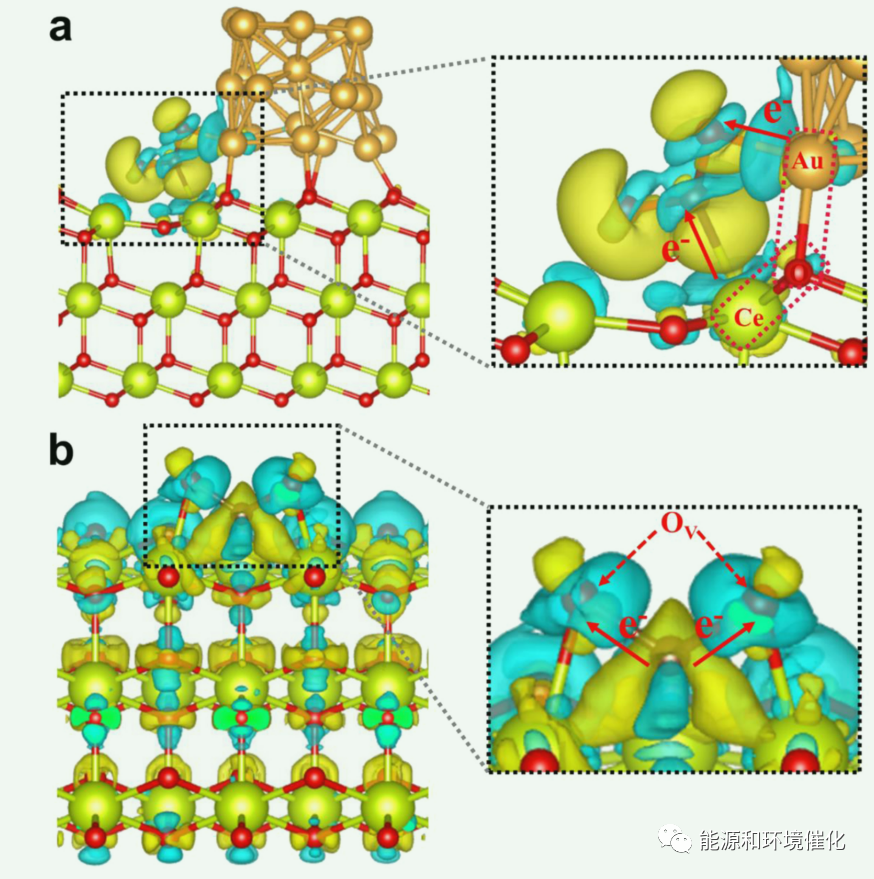
图6:(a) CeO2和(b) ACEO-x的差分电荷密度计算。蓝色区域表示电荷积聚;黄色区域表示电荷损失;C、Ce、O和Au原子分别表示为棕色、黄色、红色和金球。
CO2吸附后(图6 (a)),电子从Au原子流向相邻的CO2,使得所有的CO2分子都处于高电荷浓度区域,与ACEO-x相比,原始CeO2的电子更集中在CO2的氧原子上(图6(b))。综上所述,由于Au-O-Ce能在C原子周围诱导大量电子,因此只有在Au-CeO2微界面存在的情况下才能生成C2产物。从原始CeO2和ACEO-x的TDOS比较来看,加入Au减小了带隙,这与图3(c)的结果一致。
结论:
综上所述,贵金属Au和CeO2纳米复合材料的Au- o- ce活性位点在微界面表现出较高的活性,有利于CO2选择性光还原为C2H6。首先,通过HADDF-STEM和XPS确定微界面的形成。利用原位FTIR分析和DFT理论计算解释了光还原的机理。Au-CeO2微界面通过在C原子周围聚集大量电子,降低能垒生成COOH*和COCO*,促进了C-C耦合。因此,Au-CeO2纳米复合材料选择性地促进CO2光还原为C2H6。一个高电子C2H6的选择性为93.1%(产物选择性为65.3%),产率由0µmol g−1 h−1提高到11.8µmol g−1 h−1。本研究证实了贵金属和稀土氧化物产生的微界面可以通过改变活性位点促进C2产物的形成。为今后设计CO2光还原制C2的催化剂提供了新的思路。




