Nat. Catal.: 光电催化不对称脱氢[2+2]环加成构建多立体中心环丁烷
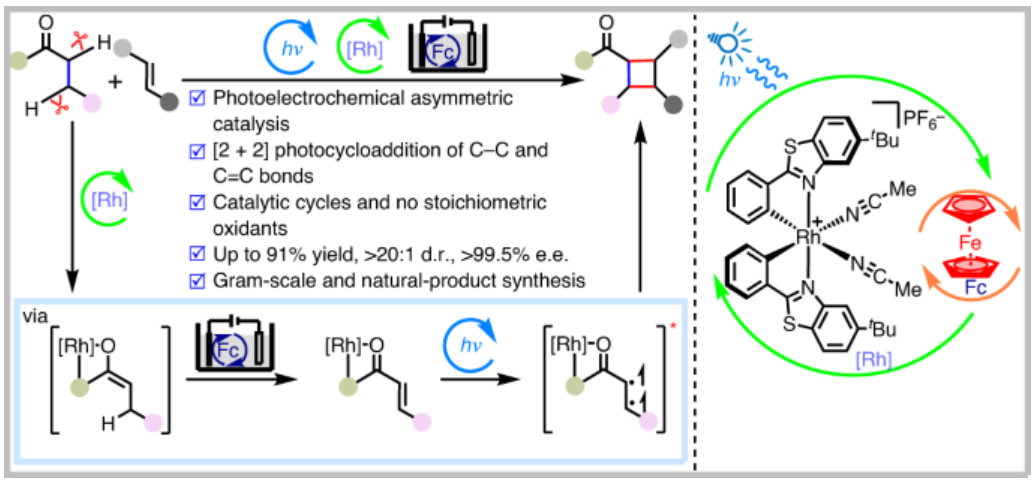
[2+2]环加成反应是有机合成中重要的化学转化,通过该策略能够形成两个新的C-C σ键和构建多达四个立体中心,具有良好的原子经济性。手性环丁烷作为普遍存在于天然产物及药物分子中的结构单元,它的合成能够通过[2+2]环加成反应实现。现阶段,光催化双分子烯烃的不对称[2π + 2π]环加成构建手性环丁烷备受瞩目,该反应的本质为将一个底物激发为其三重态(图1a)。最近,光催化C-C单键与C=C双键的[2π + 2σ]环加成构建环戊烷得到发展,反应体系中的2σ-电子反应物局限于双环[1.1.0]丁烷(BCB)(图1b)。因此,开发新型[2π + 2σ]环加成反应构建手性环丁烷具有重大研究意义。基于此,德国马尔堡大学Eric Meggers团队报道了,光电催化烷基酮与烯烃的不对称脱氢[2π + 2σ]环加成反应,构建手性环丁烷DOI:10.1038/s41929-023-01050-y (图1c)。
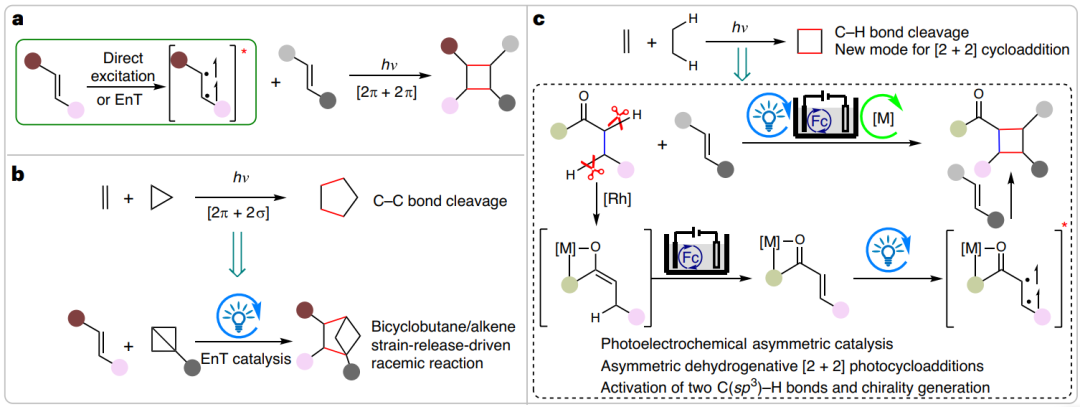
图1来源Nat. Catal.
实验结果
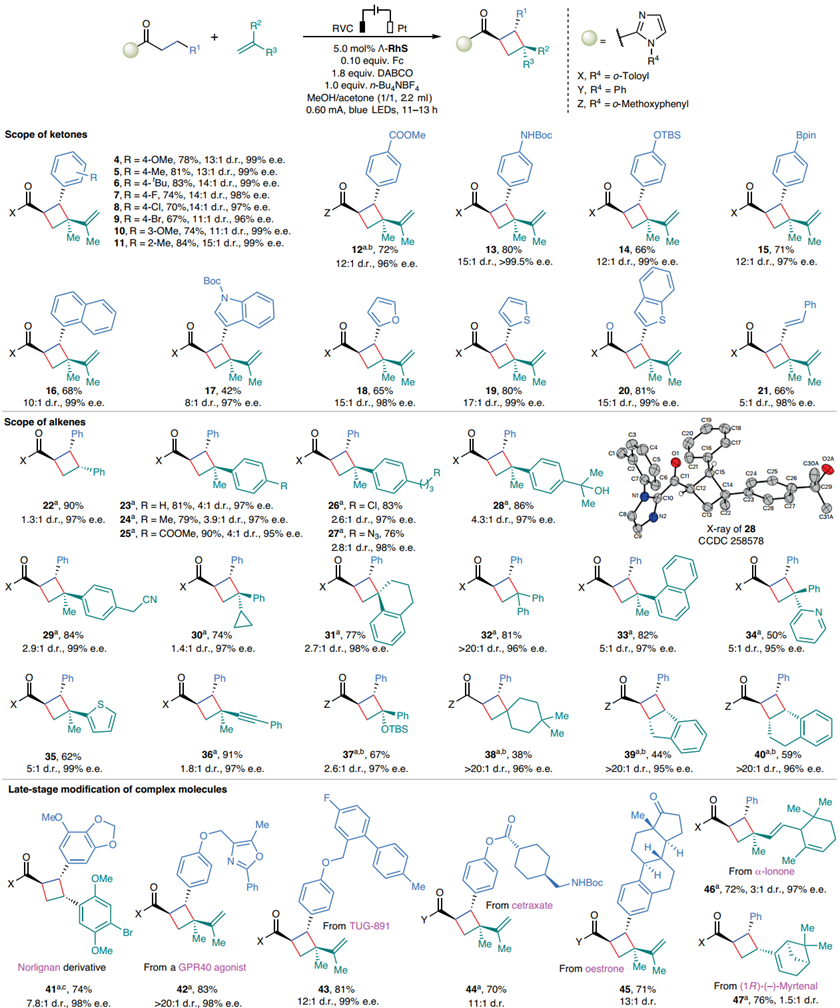
首先,作者选用2-酰基咪唑1和2,3-二甲基-1,3-丁二烯2作为模板底物,进行反应条件的优化。发现二茂铁作为氧化还原媒介,Ʌ-RhS为光催化剂和手性路易斯酸是至关重要的。在光激发下(24 W, λmax = 455 nm, 蓝色LED)构建合适电催化体系,能够以优异的对映选择性及高的非对映选择性发生[2π + 2σ]环加成反应,得到手性环丁烷3。
在得到最佳反应条件后,作者对底物普适性进行考察。各种基团取代的烷基酮(如:酯、Bpin、Boc酰胺、呋喃、噻吩等)均能兼容该催化体系,得到相应的目标化合物。另外,作者发现各种烯烃(如:苯乙烯、杂环烯烃、环状烯烃等)也能够得到相应的目标化合物。并且通过该策略,能够成功在一些天然药物分子中引入环丁烷结构单元(图2)。
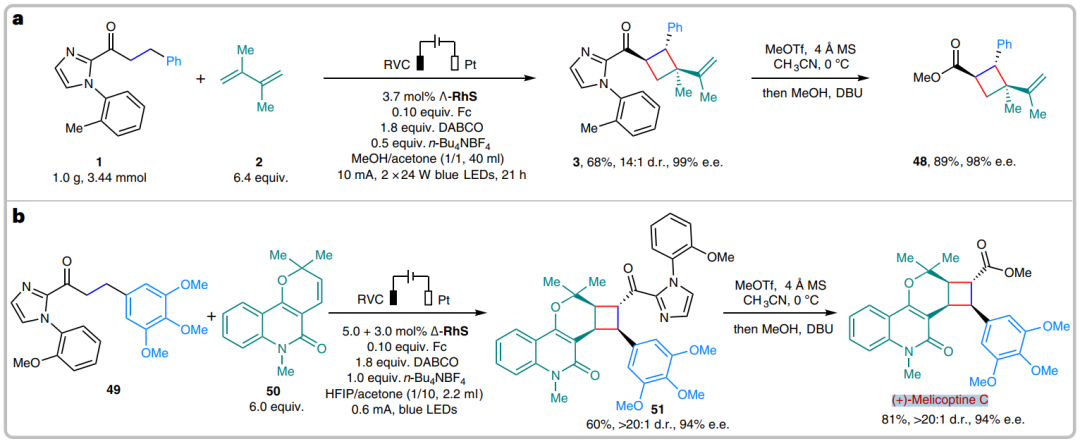
为了验证该反应的实用性,作者进行了克级实验(图3a)。并且,通过该策略还能够以81%的收率合成(+)-Melicoptine C(图3b)。
最后,作者对该反应提出了一个可能的机理。首先,Ʌ-RhS与烷基酮螯合得到中间体I,并进一步发生烯醇式互变异构得到中间体II。中间体II通过二茂铁的氧化还原特性,经历SET历程得到自由基阳离子中间体III,并进一步转化为阳离子中间体V,其发生互变异构得到烯酮中间体VI。随后,在光激发下中间体VI生成激发态三重态双自由基中间体VII,进而与烯烃发生[2+2]环加成反应得到目标化合物(图4)。
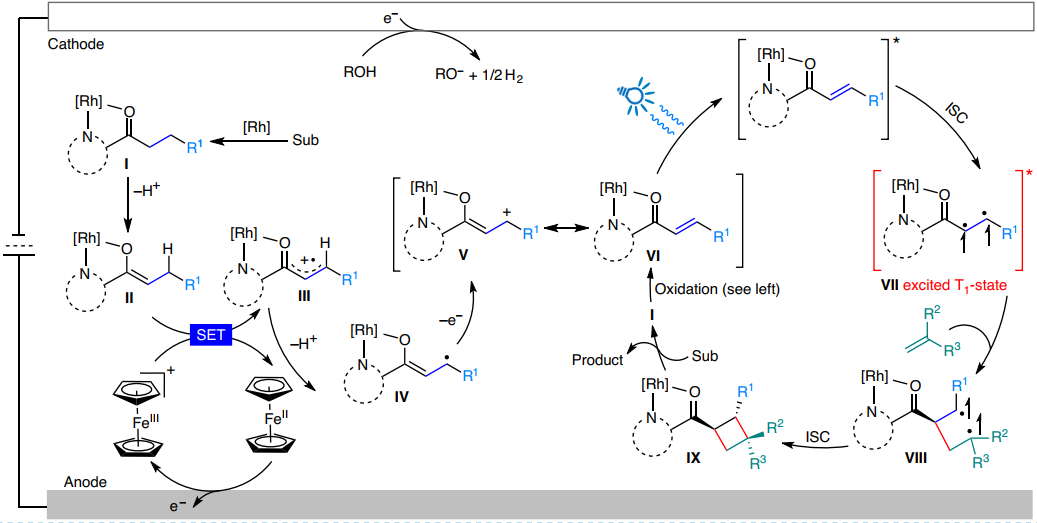
图4来源Nat. Catal.
编者结语
德国马尔堡大学Eric Meggers团队,利用烷基酮作为2σ-电子反应物,在光电共催化作用下与烯烃发生不对称脱氢[2π + 2σ]环加成反应,成功构建多立体中心的手性环丁烷。值得注意的是,二茂铁在催化体系中充当氧化还原媒介,促使烷基酮C-C单键转化为C=C双键,在光作用下得到三重态。另外,Ʌ-RhS不仅作为光催化剂,还充当路易斯酸调控反应的对映选择性及非对映选择性。
文献信息:Photoelectrochemical asymmetric dehydrogenative [2 + 2] cycloaddition between C–C single and double bonds via the activation of two C(sp3)–H bonds Peng Xiong , Sergei I. Ivlev & Eric Meggers*
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




