JACS:光/NHC共催化,合成β²,²-氨基酯
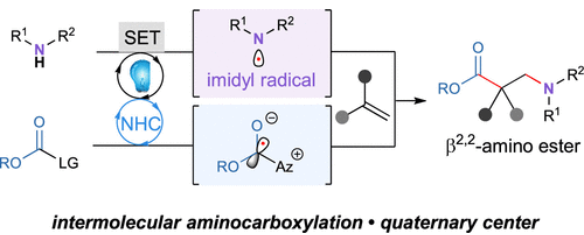
近日,美国西北大学(Northwestern University)Karl A. Scheidt课题组发展了一种新的光/NHC催化,用于烯烃的氨基-羧基化反应,以良好的区域选择性实现了一系列β2,2-氨基酯的合成。反应中使用简单的酰亚胺通过连续的去质子化和单电子氧化生成氮中心自由基,随后与偕二取代烯烃进行区域选择性加成。接下来,三级自由基中间体与原位生成的稳定唑自由基中间体通过交叉偶联来有效的构建季碳中心。包括Stern-Volmer荧光淬灭实验在内的机理研究实验支持了作者所提出的催化循环。相关成果发表在J. Am. Chem. Soc.上,文章链接DOI:10.1021/jacs.3c09875。
(图片来源:J. Am. Chem. Soc.)
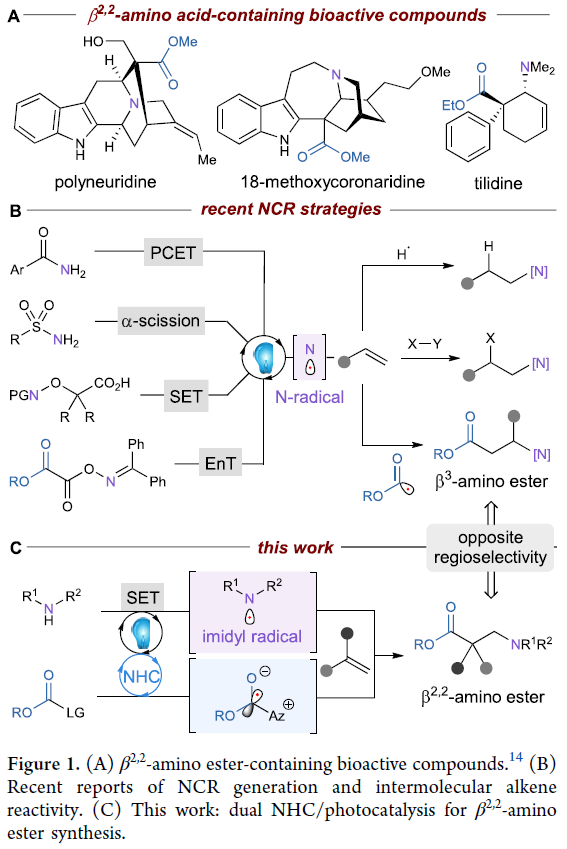
β-氨基酸是肽模拟物和药物等生物活性分子的重要组成部分。鉴于β-氨基酸在化学中的重要应用性,化学家们发展了一系列β-氨基酸的合成方法,包括Mannich反应、氮基亲核试剂的共轭加成、β-氨基α,β-不饱和体系的氢化以及活化α-氨基酸的Arndt-Eistert同系化反应。在这些方法中,Mannich-类型反应发展的最为成熟,包括最近化学家们发展的利用手性磷酸或氮杂环卡宾(NHC)催化的对映选择性反应。然而,这些方法大多只能实现β3-、β2-和β2,3-型氨基酸,而发展β2,2-型氨基酸的一般合成方法仍然具有一定的挑战性。因此,实现β2,2-型氨基酸的合成对合成化学家和化学生物学家具有重要应用价值(Figure 1A)。
光催化由于具有温和的光激发过程和单电子氧化还原途径,已成为有机合成化学中的重要转化策略。与碳中心自由基相比,氮中心自由基的获取方法仍然有限,尽管其在有机合成中有着悠久的历史。近些年,Knowles、Doyle、Studer、Leonori以及Glorius等课题组发展了一系列策略实现了利用非预氧化的氮源产生氮自由基物种(Figure 1B)。然而,目前还没有使用普通无机碱,利用简单的酰亚胺生成氮自由基并应用于制备含氮化合物的报道。最近,美国西北大学Karl A. Scheidt课题组发展了一种新的光/NHC催化烯烃的氨基-羧基化反应,以良好的区域选择性实现了一系列β2,2-氨基酯的合成。反应中由酰亚胺通过连续的去质子化和单电子氧化生成氮中心自由基,随后与偕二取代烯烃进行区域选择性加成。接下来,三级自由基中间体与原位生成的稳定唑自由基中间体通过交叉偶联来有效的构建季碳中心(Figure 1C)。
(图片来源:J. Am. Chem. Soc.)
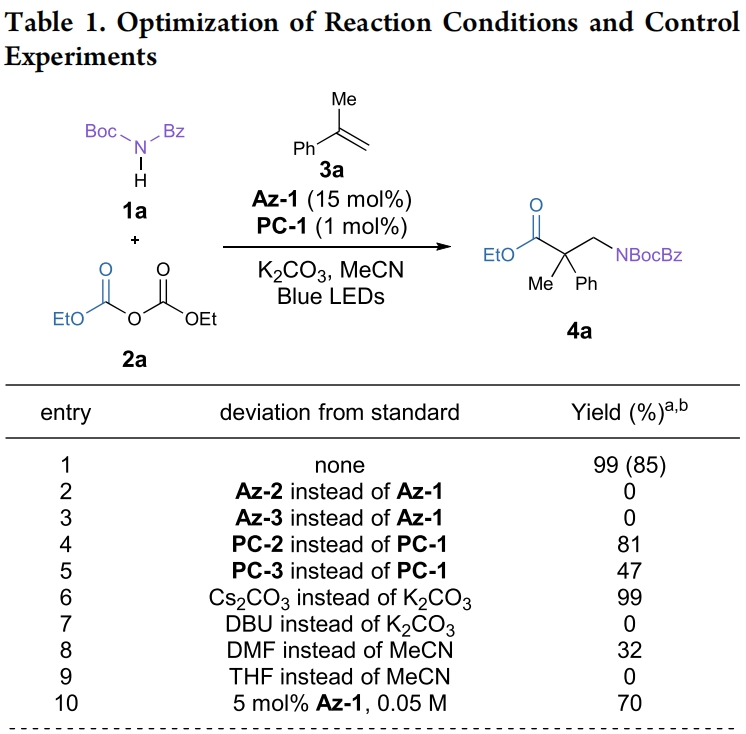
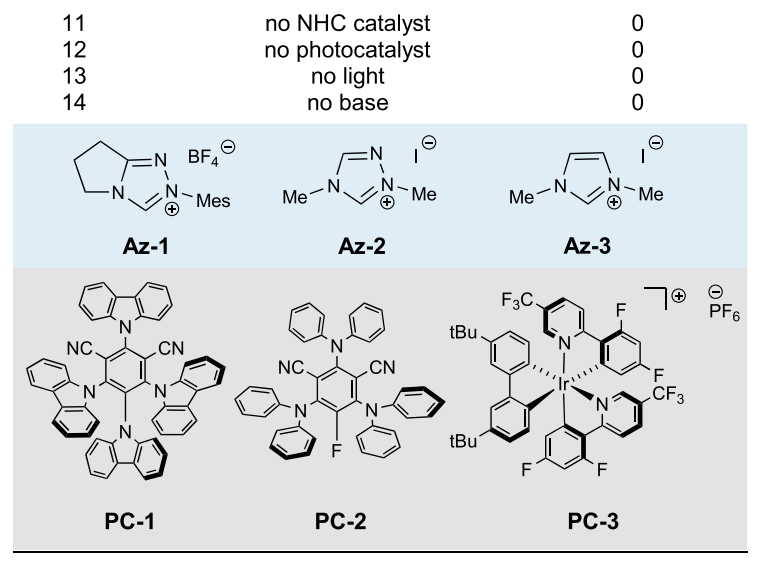
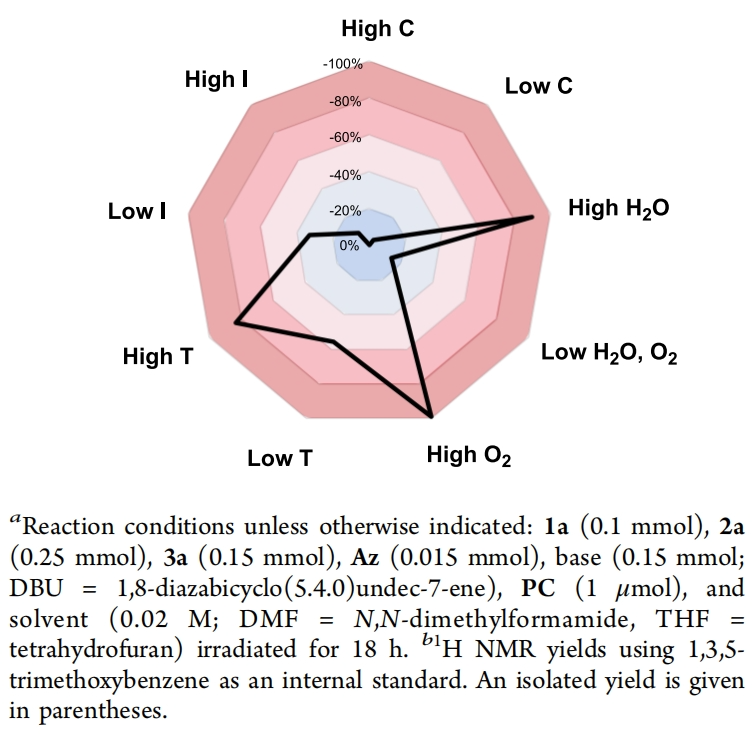
首先,作者选用N-Boc苯甲酰胺1a,焦碳酸二乙酯2a和α-甲基苯乙烯3a作为模板底物对此转化进行了探索(Table 1)。通过一系列条件筛选,作者发现当使用1a (0.1 mmol), 2a (0.25 mmol), 3a (0.15 mmol), Az-1 (0.015 mmol), K2CO3 (0.15 mmol), PC-1 (1 μmol),在MeCN(0.02 M)中,427 nm LEDs蓝光照射下反应18 h,可以以99%的核磁产率,85%的分离产率得到相应的β2,2-氨基酯产物4a(entry 1)。控制实验表明,NHC催化剂、光催化剂、光引发以及碱对转化至关重要,缺一不可(entries 11-14)。
(图片来源:J. Am. Chem. Soc.)
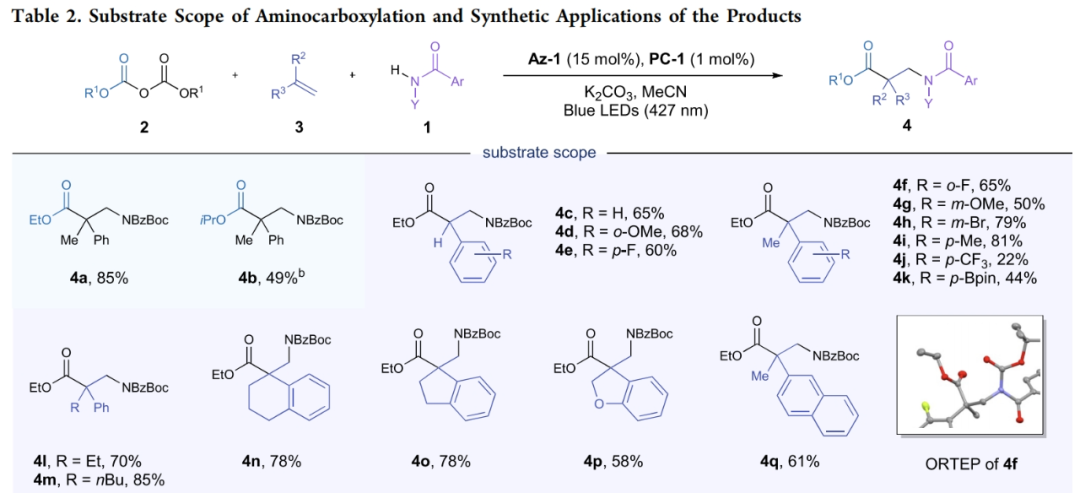
在得到了最优反应条件后,作者对此转化的底物范围进行了考察(Table 2)。实验结果表明此转化对于一系列取代的苯甲酰胺1,焦碳酸酯2和取代的苯乙烯3均具有良好的兼容性,以20-92%的产率得到相应的β2,2-氨基酯产物4b-4z。值得注意的是,此体系对一系列药物衍生物ataluren和probenecid同样具有良好的兼容性,分别以76%和47%的产率得到响应的产物4aa和4ab。
为了证明此转化的实用性,作者对产物4a进行了一系列合成转化。首先,4a在肼的作用下,可以以82%的产率得到脱苯甲酰基的β-氨基酯产物5。此外,4a还可以通过四氢锂铝还原以74%的产率得到相应的γ-氨基醇产物6。
(图片来源:J. Am. Chem. Soc.)
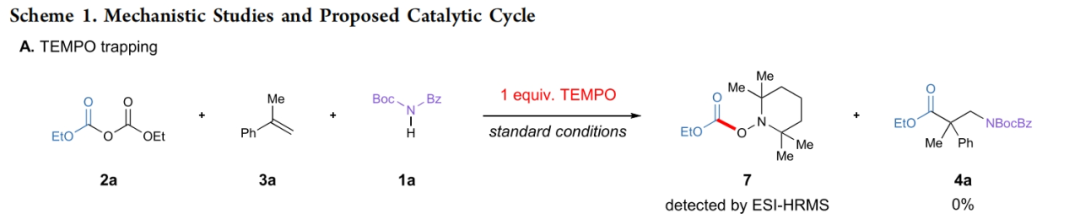
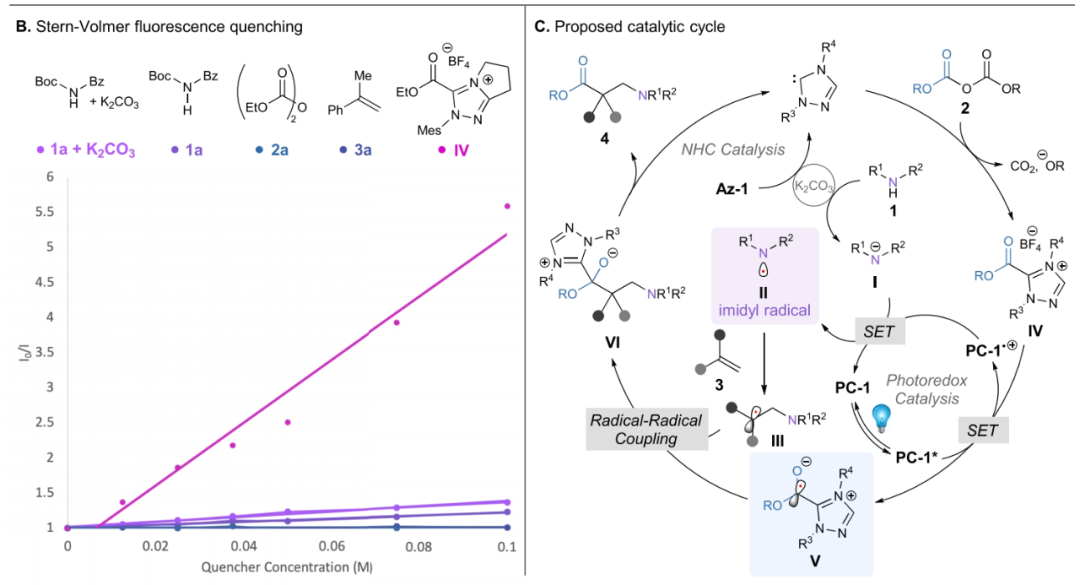
为了深入理解反应机理,作者进行了一系列控制实验(Scheme 1)。当在体系中加入自由基捕获剂TEMPO (1 equiv)时,反应被完全抑制,并通过高分辨质谱监测到了TEMPO与烷氧羰基自由基的加合物7,由此表明反应中涉及自由基中间体(Scheme 1A)。此外,循环伏安(cyclic voltammetry)实验表明反应经历了碱促进的酰亚胺1a的氧化,但并没有得出光催化途径的确凿证据。最后,各反应组分的Stern-Volmer荧光淬灭实验表明,在0.1 M浓度时,焦碳酸二乙酯2a和α-甲基苯乙烯3a均不能淬灭光催化剂。N-Boc苯甲酰胺1a和1a与碳酸钾的等摩尔混合物均表现出轻微的光催化剂淬灭速率。然而,酯化的Az-1中间体(IV)的淬灭速率明显高于其它任何反应组分,表明氧化淬灭机理的存在。然而,由于在1a中观察到的淬灭量很小,无论是否有碱,作者均不能排除还原淬灭反应途径(Scheme 1B)。基于上述实验结果,作者提出了此转化可能的反应机理(Scheme 1C):首先,前催化剂Az-1通过脱质子形成活化的卡宾催化剂。随后,NHC与焦碳酸酯2通过亲核加成原位生成酯唑中间体IV,其可以被激发的PC-1*还原。在此还原之后,光催化剂PC-1•+可以通过氧化氮负离子I或酰亚胺1a的直接PCET生成关键的氮自由基中间体II。在这两种情况下,氮自由基II均可以迅速与苯乙烯3加成,生成苄基自由基中间体III。最后,III和V之间通过自由基交叉偶联生成氧负离子中间体VI,其可以迅速发生消除生成β2,2-氨基酯4和再生卡宾催化剂。此外,作者还研究了光催化将自由基III还原为苄基碳负离子,并与2经历亲核加成得到产物4的可能性。但作者通过苄基自由基的还原电位得出,当以4CzIPN为催化剂时,这一过程是不利的。
(图片来源:J. Am. Chem. Soc.)
Karl A. Scheidt课题组发展了光/NHC共催化策略实现了β-氨基酯的合成。这种温和的模块化合成方法利用苯乙烯、酰亚胺和焦碳酸酯作为起始原料,以中等到良好的产率实现了立体拥挤的β2,2-氨基酯的构建。机理研究表明反应中生成了瞬态的氮自由基和和稳定的烷氧羰基自由基,且氮自由基可以被苯乙烯快速捕获。值得注意的是,与一系列已报到的光/NHC催化的合成方法相比,这是首次使用该策略通过分子间氮中心自由基的接力过程实现羧酸酯的引入。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




