贵州大学Nat. Commun.:动态构象异构驱动催化合成手性亚砜
构象异构体普遍存在于分子中,由于单键的快速旋转,构象异构体之间的相互转换能垒比较低,这导致在有机合成中单一构象的存在和区分一直比较困难。池永贵教授团队致力于在有机合成和绿色农药研发生产领域开展原创性工作。近日,该团队在Nature Communications 上报道了一种具有分子内硫键(ChB)作用的前手性亚砜二醛分子,在手性氮杂环卡宾(NHC)的催化下,以分子内硫键作用导向的动态构象异构化为驱动力,高立体选择性实现了单一构象的动态动力学拆分,获得了一系列具有潜在生物活性及其它应用的光学纯的手性亚砜分子。
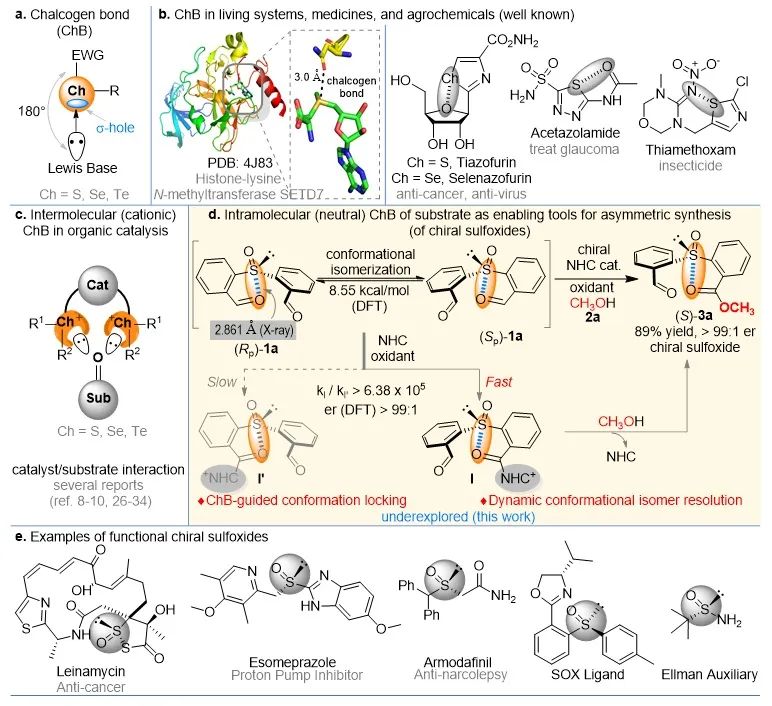
硫键的概念及应用
硫键作为一种新型的非共价作用,与已被广泛应用的氢键和卤键作用相比,其在有机合成中的应用近几年才逐渐引起关注。硫键通常存在于硫族元素和Lewis碱之间,且与硫族原子相连的基团一般为吸电子基(EWG),这样在成键的反轴方向存在一个电子空穴(σ-hole),Lewis 碱的孤对电子向σ-hole填充,这样导致硫键有很强的方向性(180°,图1a)。同时,硫键作用也广泛存在于生命体和药物分子中,它导致的构象锁定作用已被证明在维持酶和药物活性中扮演重要角色(图1b),且在固态化学、超分子组装和离子识别等领域也有广泛应用。然而,硫键作用在有机催化中的应用近几年才被Matile、Huber和王瑶等人发掘,其关键在于合成强度更高的阳离子型硫键催化剂(图1c),且在不对称合成反应中的应用尚处于发展阶段。
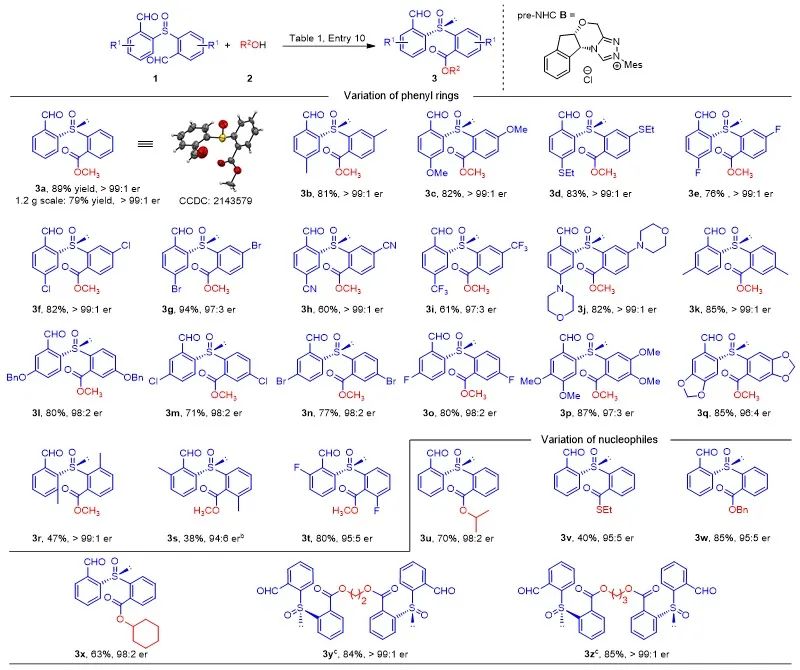
底物普适性研究
随后,作者将反应放大到了1.2 g规模,依然保持了良好的产率和卓越的对映选择性(79% yield, >99:1 er),同时对3a进行了一系列衍生化研究(图3)。在非手性NHC的催化下,醛基能被高效地氘代、氰基化和硫酯化,且er值得到了很好的保持(图3,4a-4c)。分别通过Seyferth–Gilbert 和 Wittig反应高效合成了手性端炔4d和端烯4e,且并没有降低亚砜手性中心的er值(>99:1)。将端炔4d和叠氮基经Click反应以中等产率改造了抗HIV药物齐多夫定(图3b)。醛基与L-缬氨醇反应生成的噁唑啉化合物4g与报道的SOX配体高度相似,并且作者以4g为手性配体,以98:2的er值实现了Pd催化的不对称烯丙基化反应(图3b)。经过简单的还原胺化和酯基还原,作者合成了一个已被报道过的手性亚砜配体(或催化剂)4h。将酯基水解,醛基还原胺化合成了一个含手性亚砜基团的氨基酸4i。将醛基与Ellman手性助剂缩合,获得了手性的二亚砜分子4j。
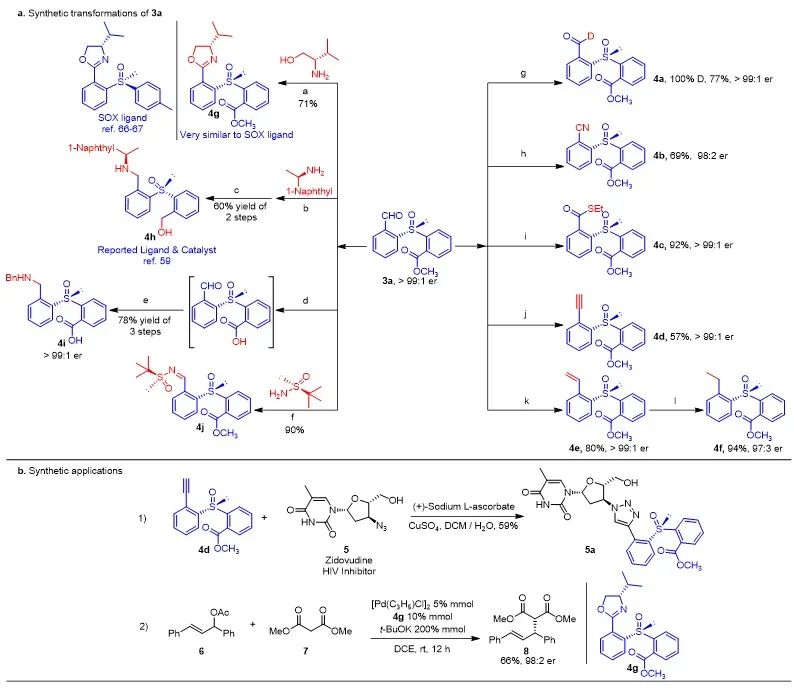
衍生化研究
为了进一步探索硫键在整个反应中的作用,作者合成了间位和对位亚砜二醛分子1aa和1ab。同时1aa的单晶数据表明,其并不存在分子内硫键作用。作者以这两个底物在标准条件下开展催化反应,其单酯化产物3aa和3ac的er值近乎消旋,同时观测到了大量的二酯产物(图4a)。为了考察分子内硫键的强度,基于底物1a的单晶数据,经DFT计算得出硫键键能为3.44 kcal/mol(图4b)。当在醛基对位引入供电子基(OMe, 1c)和吸电子基(CF3, 1i),对硫键的强度也有影响,分别为3.56和4.27 kcal/mol。另外,为了探究NHC对醛基的区域选择性(两个构象,四种醛基),作者以DFT计算考察了NHC对醛基的加成能垒,发现在两种构象中没有成硫键的醛基具有较高的加成能垒(9.24, 6.49 kcal/mol),而硫键键合的醛基有着较低的加成能垒(5.50, 3.53 kcal/mol),这说明硫键对此类醛基有活化作用(图4c)。随后作者继续考察了这两种构象后续的氧化步骤,发现构象Sp-1a相较于Rp-1a形成的Breslow中间体具有更低的氧化能垒,分别为14.16和22.22 kcal/mol, 其能垒差距为8.06 kcal/mol(图4d),换算成er值为>99:1,说明氧化步骤是整个反应的立体决定步,这与实验结果高度契合,证明硫键作用在整个反应过程具有重要作用。同时,相关的产物的农药活性测试正在进行中。
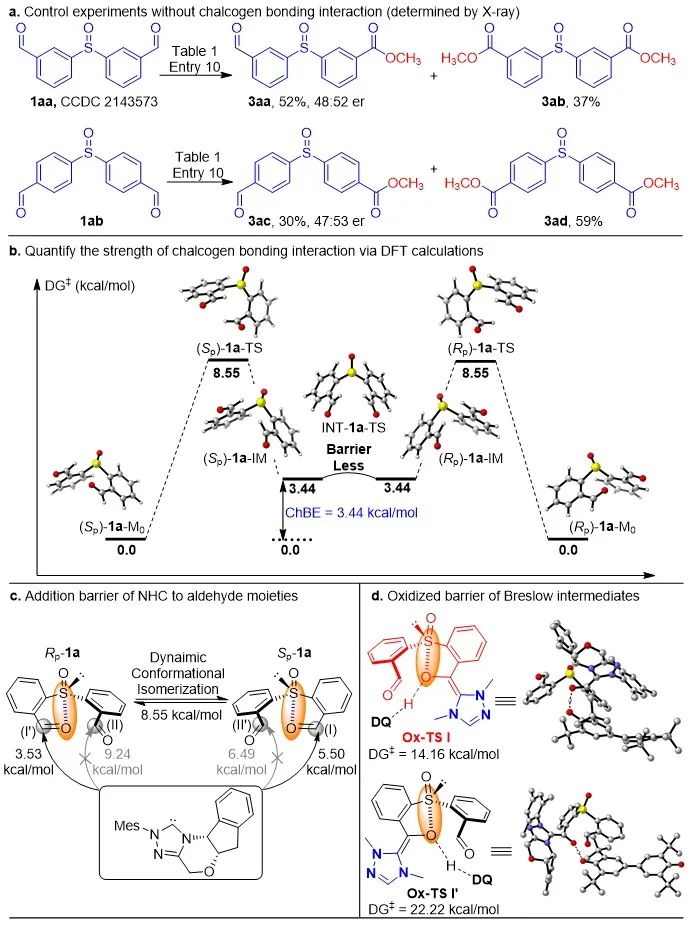
机理研究





