摘要:中国科学院南海海洋研究所张长生研究员团队和美国德克萨斯大学奥斯汀分校刘鸿文教授团队合作研究发现黄素(Flavin)介导非典型角环素Fluostatins(FSTs)的环氧基团开环,开环方式和机理与之前的报道显著不同。
非典型角环素类天然产物骨架类型丰富多样,生物活性优良,是开发抑菌、抗肿瘤药物和酶抑制剂的热点分子,环氧基团(三元环醚)是非典型角环素的重要结构单元,对结构修饰及多样化具有举足轻重的影响。因此,阐明环氧开环的反应机理可以为结构多样性的拓展和先导化合物的筛选提供分子支撑,为构效关系的优化提供辅助工具。环氧开环反应和机理在化学和酶学上都已经研究得比较深入。通常,在酸性或碱性条件下,亲核试剂可空间和立体选择性地进攻环氧基团发生亲核取代,形成反式邻二醇,或在环氧水解酶(EH)或氧化还原酶(OR)催化作用下,立体选择性水解或还原环氧基团形成反式邻二醇或单醇(图 1)。近日,中国科学院南海海洋研究所张长生研究员团队和美国德克萨斯大学奥斯汀分校刘鸿文教授团队合作研究发现黄素(Flavin)介导非典型角环素Fluostatins(FSTs)的环氧基团开环,开环方式和机理与之前的报道显著不同。
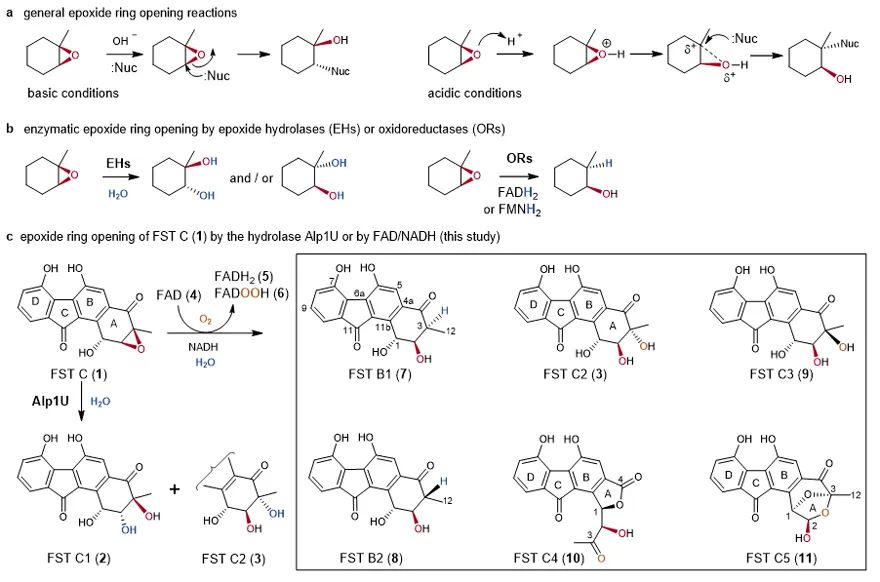
典型的环氧开环反应。(a) 酸碱条件下非酶的环氧开环反应;(b) 酶催化的水解或还原环氧开环反应;(c) Alp1U或FAD/NADH介导的FST C (1)的环氧开环反应。
研究团队前期发现来源于kinamycins生物合成基因簇的环氧水解酶Alp1U能够水解FST C(1)的环氧基团生成反式构型的邻二醇产物(Zhang L et al,J. Biol. Chem.,2000, 295, 16987-16997)。据此推测来源于Fluostatins生物合成基因簇的水解酶FlsH(Alp1U同源蛋白)可能负责FST C(1)的环氧水解,但实验结果显示FlsH并不能催化环氧开环反应,而是催化FSTs脱酰基反应(Huang C et al, Nat. Commun. 2018, 9, 2088)。进一步研究发现黄素(Fre)才是真正介导FST C(1)中环氧非酶催化开环的神秘物质(图1)。为揭示黄素介导环氧开环的反应机理,研究人员进行了产物分离鉴定、稳定同位素标记(2H和18O)、pH梯度、时间梯度、浓度梯度及不同的黄素辅酶因子等实验。结果表明,黄素能够介导FST C(1)的还原开环,将溶液中的H原子掺入到产物的C-3位,同时能够介导氧化开环,将空气中的氧原子掺入到产物C-3位的OH。研究人员进一步发现该黄素介导的环氧开环反应能够拓展到多个FSTs类似物及其他天然产物,并总结了其底物结构特征:必需具有环氧相邻的酮基和芳香环。最后,研究人员推测黄素介导环氧开环的反应机理(图2)。在还原开环反应中,通过形成N5‒C4′共价键传递电子,还原底物形成烯醇中间体13,进一步互变异构为7和8,或氧化为3和9;在氧化开环反应中,通过FADOO-直接进攻环氧基团发生亲核取代,引发环氧开环形成C4a‒O‒O‒C3′共价键中间体,释放出过氧产物14,后者再通过NADH还原、重排缩环和扩环形成终产物3、9、10和11,但14为何需要NADH才能发生重排形成10和11的机理尚不清楚。研究人员推测还原的黄素以直接(N5‒C4′)或间接(C4a‒O‒O‒C3′)方式与环氧底物形成共价键传递电子,从而介导环氧以还原或氧化方式开环(图2),这显著不同于已报道的非酶催化(酸碱条件下的亲核取代反应)、水解酶催化(H2O介导开环)和氧化还原酶催化(通过H-提供还原力介导的环氧开环)。
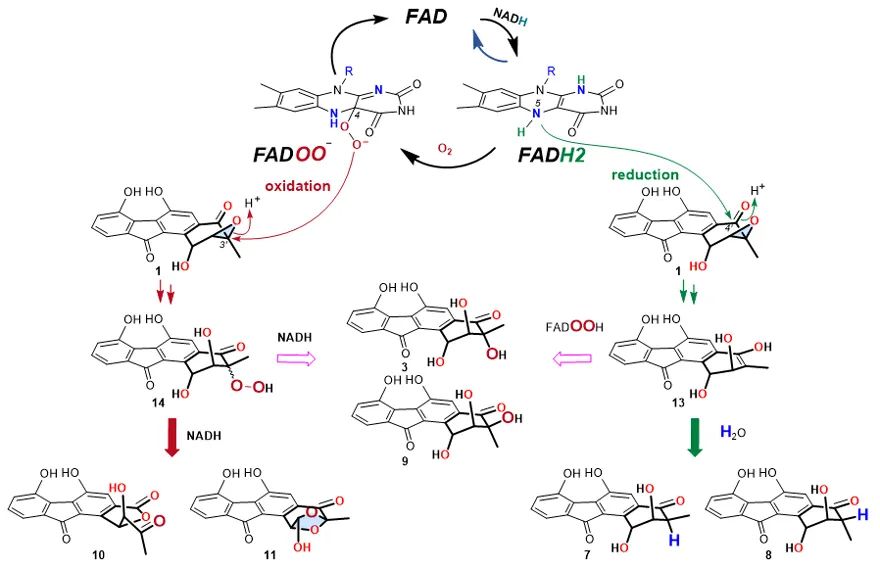
推测的环氧开环反应机理
该成果从两个方面丰富了黄素(Flavin)化学:1)黄素或可通过N-5与反应底物形成共价键传递电子;2)除羟化、形成环氧以及引发Baeyer-Villiger重排反应外,黄素过氧化物FADOO-还可与环氧发生亲核取代反应。这一发现或可为有机合成提供有用的新工具。这一成果近期发表在Nature Communications 上,文章第一作者是中国科学院南海海洋研究所的Bidhan Chandra De和张文军。









