MacMillan组JACS:光促铜催化脱羧卤磺酰化助力芳基磺酰胺的一锅合成
导读
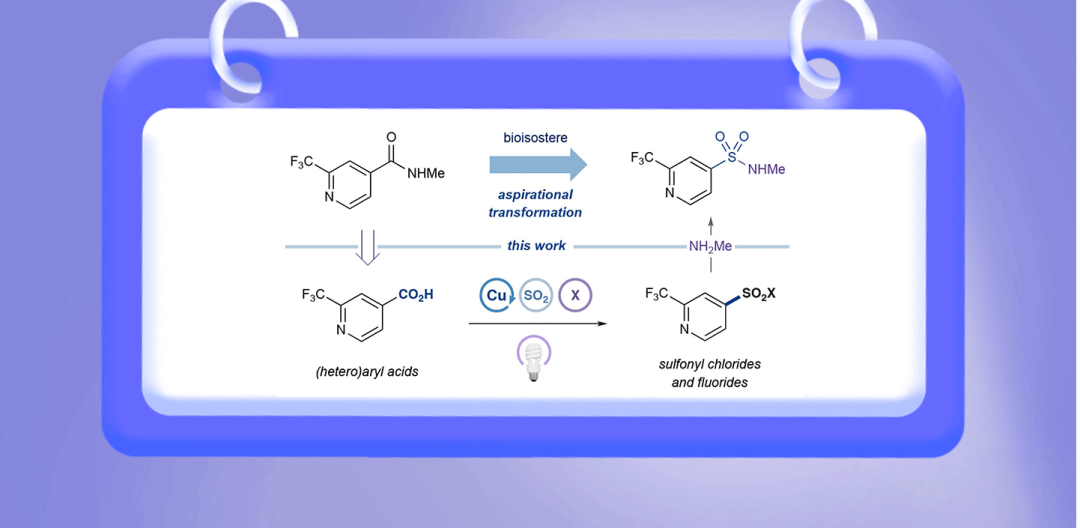
最近,2021届诺贝尔化学家得主、普林斯顿大学David W. C. MacMillan教授课题组报道了一种新颖的光促铜催化脱羧卤磺酰化反应,可以将芳基羧酸和胺经一锅反应直接转化成磺酰胺化合物。该反应能实现多种芳基、杂芳基、和s-富集羧酸的磺酰胺化,以及多种芳基和杂芳基羧酸的磺酰氟化,并成功应用于药物分子的后期官能团化。相关研究成果发表在近期的《美国化学会志》上(J. Am. Chem. Soc. DOI: 10.1021/jacs.3c08218)。
背景介绍和研究思路(Figure 1、2):
羧酸和胺具有高度的结构多样性和合成用途,以及广泛的天然和商业来源,是酰胺偶联的传统底物。然而,酰胺在代谢上不稳定容易水解,且可能不具备与特定靶标的理想结合特性。为了解决这些缺点,药物化学家发展出几种酰胺生物电子等排体,其具有与酰胺相似的几何特征,但能表现出更好的代谢稳定性或结合亲和力。磺酰胺是其中备受瞩目的一个,具有与酰胺类似的几何形状,和额外氢键受体(HBA),能改善水解稳定性并增大极性表面积(PSA),从而显著改善物理化学性质或结合亲和力。尽管磺酰胺具有较高应用价值,其合成并不容易,需要从头合成磺酰氯再转化,或通过高能重氮中间体经多步反应得到。因此,如果能应用类似酰胺偶联的方法制备磺酰胺,将能简化磺酰胺的合成,加快药物发现。
MacMillan课题组设想以芳基羧酸和胺为底物,先发生脱羧卤磺酰化,然后加入胺,实现磺酰胺的一锅合成(Figure 1)。Oleg V. Larionov课题组曾在2022年报道了脂肪族羧酸的光促脱羧磺酰化反应(Chem. Sci. 2022, 13, 4170−4179),但该方法不适用于芳基羧酸,芳基羧酸的脱羧难度更大。MacMillan课题组和Ritter课题组都曾证明,铜-配体至金属电子转移(Cu-LMCT)策略是一种使芳基羧酸发生脱羧官能团化的温和通用方法。为此,MacMillan课题组认为可以利用Cu-LMCT策略实现芳基羧酸的催化脱酸卤磺酰化,实现磺酰胺、磺酰氟等化合物的高效合成(Figure 1)。
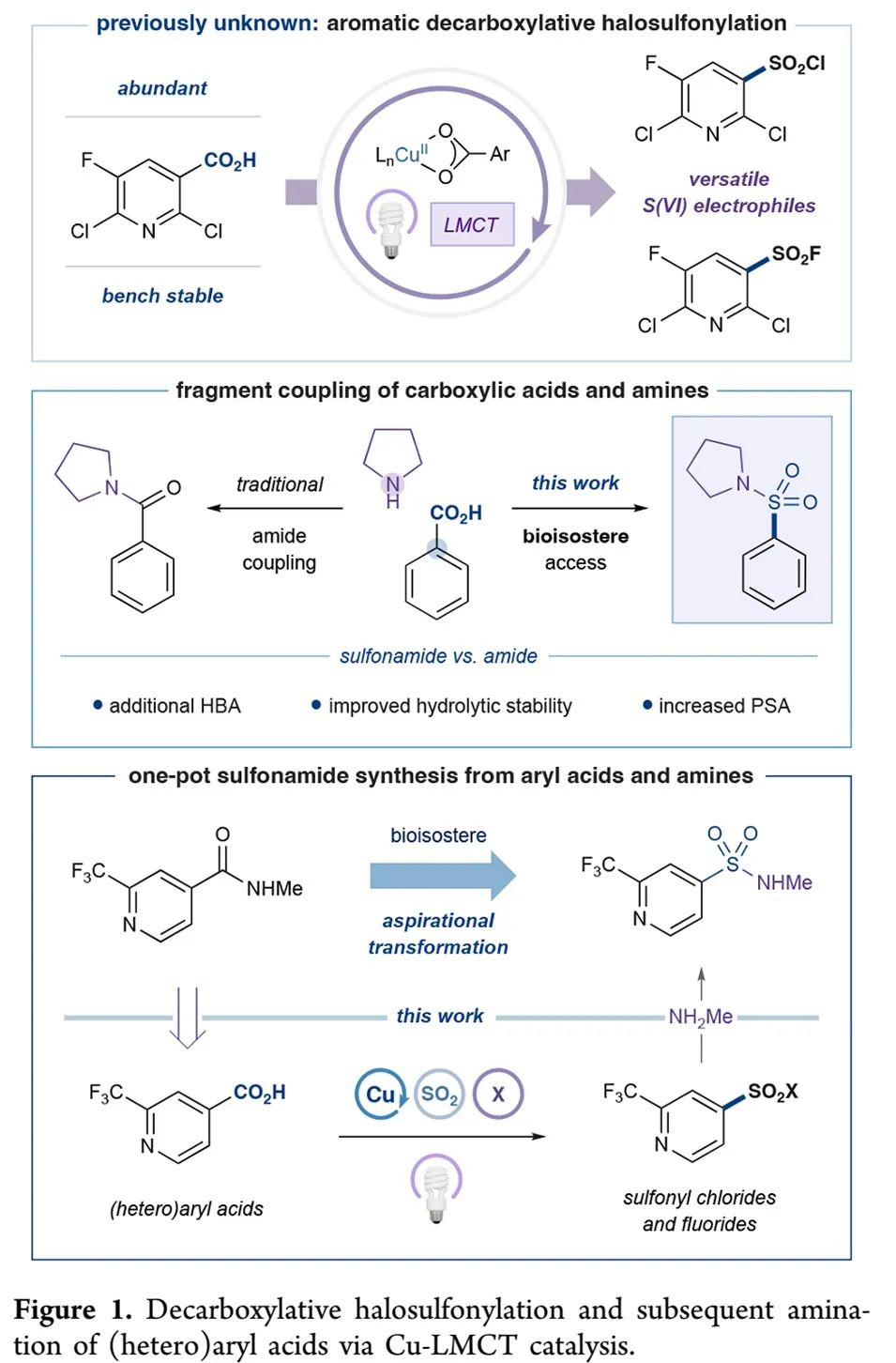
(Figure 1, 来源:J. Am. Chem. Soc.)
作者设想的反应历程如Figure 2所示:Cu(II)催化剂和芳基羧酸结合生成光活性Cu(II)羧酸盐,然后在光照下经LMCT转化,包括一个C-O键均裂,生成芳酰基自由基(aroyloxy radical)和被还原的Cu(I)中间体;芳酰基自由基经脱羧反应生成芳基自由基,然后被二氧化硫捕获,生成芳磺酰基自由基;芳磺酰基自由基可以与多种亲电试剂反应,转化成理想的磺酰卤、磺酰胺等化合物;最后,Cu(I)催化剂被合适的氧化剂氧化成Cu(II)催化剂,完成整个循环。
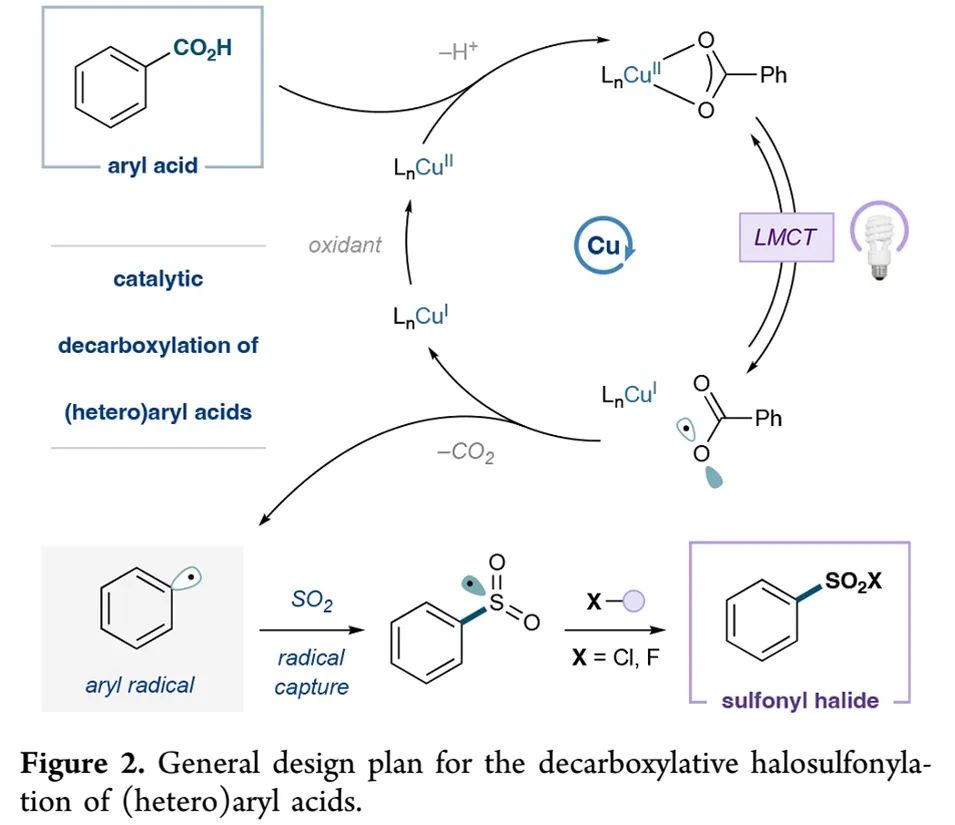
(Figure 2, 来源:J. Am. Chem. Soc.)
条件筛选研究(Table 1, Table S1-S21 in SI):
基于Figure 1、2的设想,作者开展反应可行性研究。通过对二氧化硫源、浓度、铜催化剂和其当量、添加剂、亲电氯试剂、光源、水等因素的细致优化(Table S1-S9),得出如Table 1中entry 1所示最优脱羧氯磺酰化反应条件:Cu(MeCN)4BF4作铜催化剂、1-氟-2,4,6-三甲基吡啶四氟化硼(NFTPT)作单电子氧化剂、1,3-二氯-5,5-二甲基海因(DCDMH)作亲电氯试剂、365 nm LEDs作光源、二氧化硫乙腈溶液作二氧化硫源、四氟硼酸锂作添加剂,反应能以69%产率得到对应芳基磺酰氯产物(entry 1)。如果在光催化反应完后除去未反应二氧化硫,再加入DIPEA和吗啡啉,能以68%的一锅产率得到芳基磺酰胺(entry 11)。控制实验显示铜催化剂、氧化剂、光源对反应的发生是必须的,这证明反应是通过LMCT路径发生。Table S12、S13的研究显示反应存在磺酰氟、氯代芳烃、脱羧芳烃和酯副产物。加入四氟硼酸锂有助于降低磺酰氟副产物的生成。通过选用合适的氟源(Selectfluor作氟源和氧化剂),也能实现磺酰氟的高效合成(Table S18)。相关条件筛选详见SI中Table S1-S21。
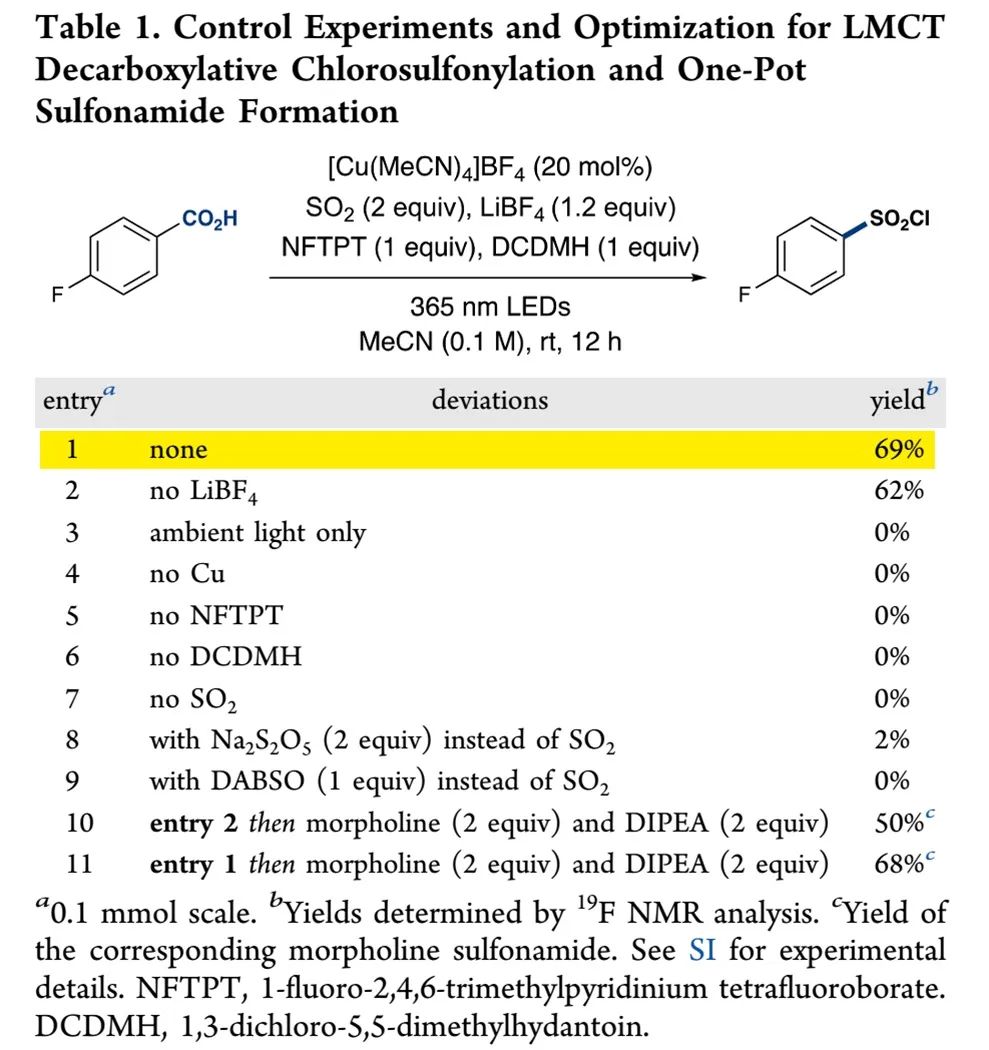
(Table 1, 来源:J. Am. Chem. Soc.)
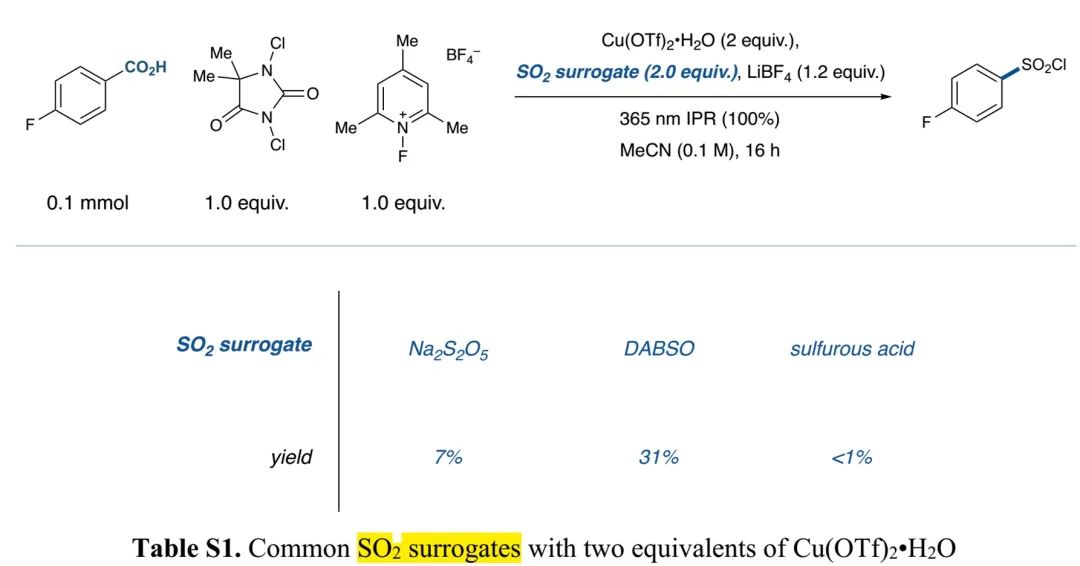
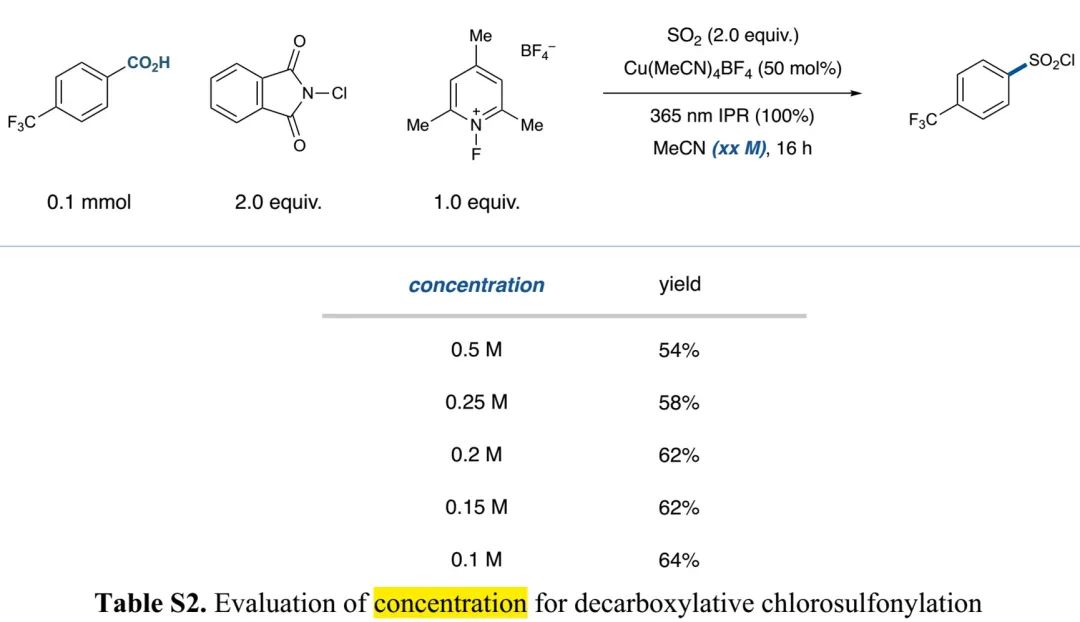
(Table S2 in SI, 来源:J. Am. Chem. Soc.)
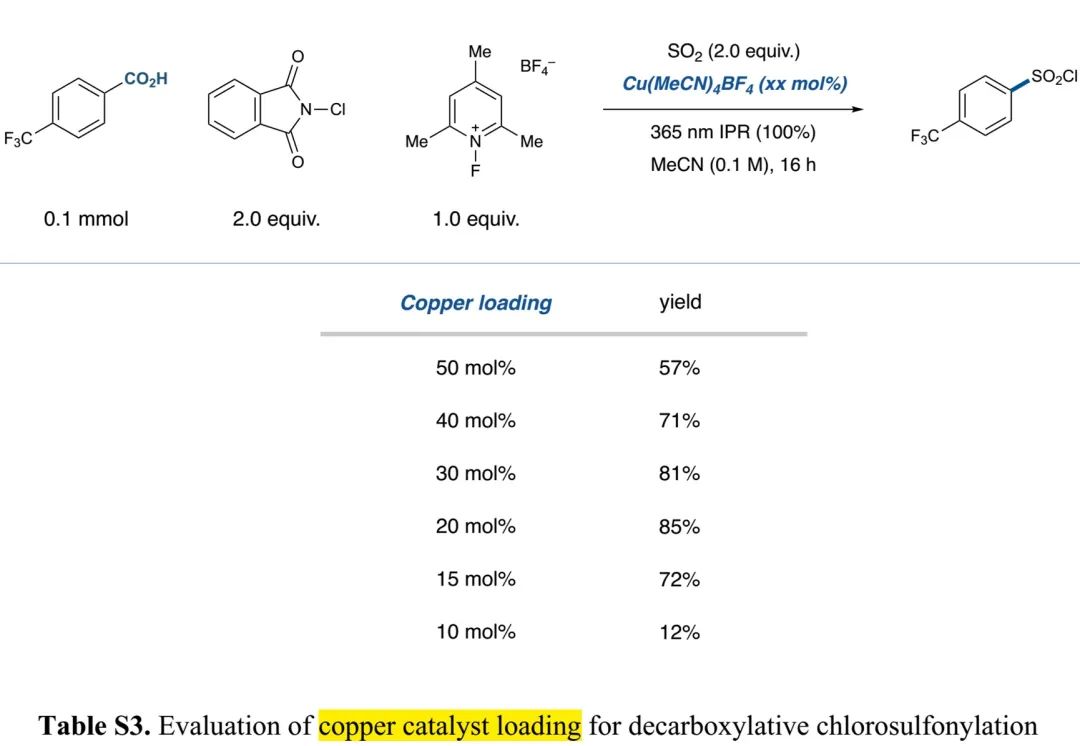
(Table S3 in SI, 来源:J. Am. Chem. Soc.)
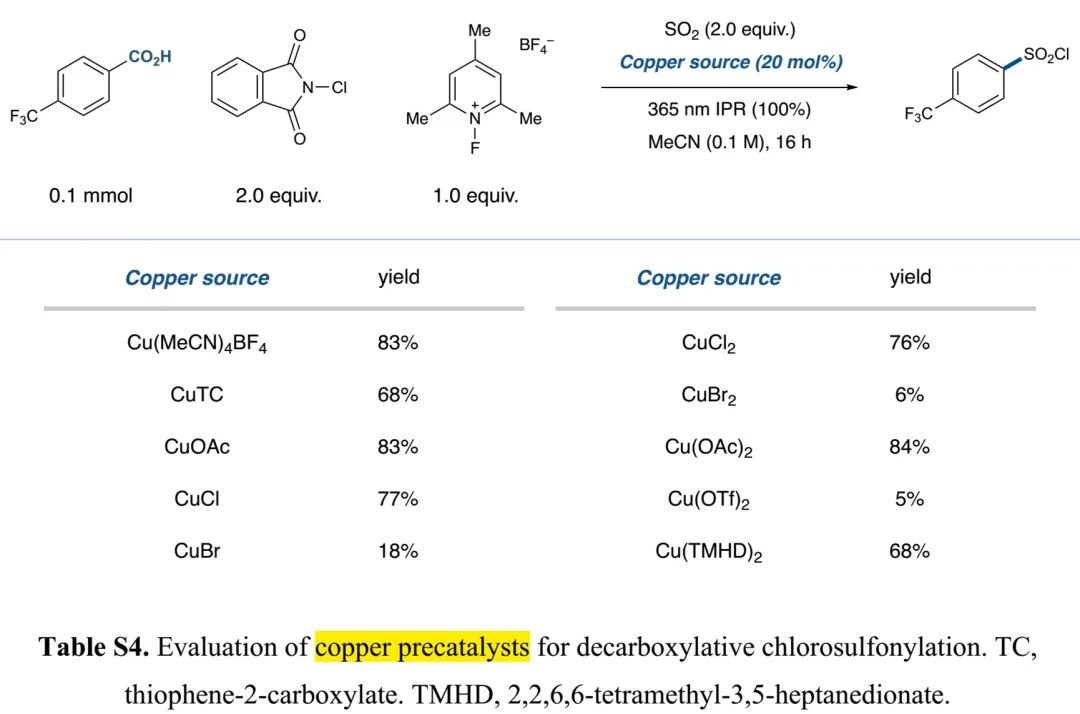
(Table S4 in SI, 来源:J. Am. Chem. Soc.)
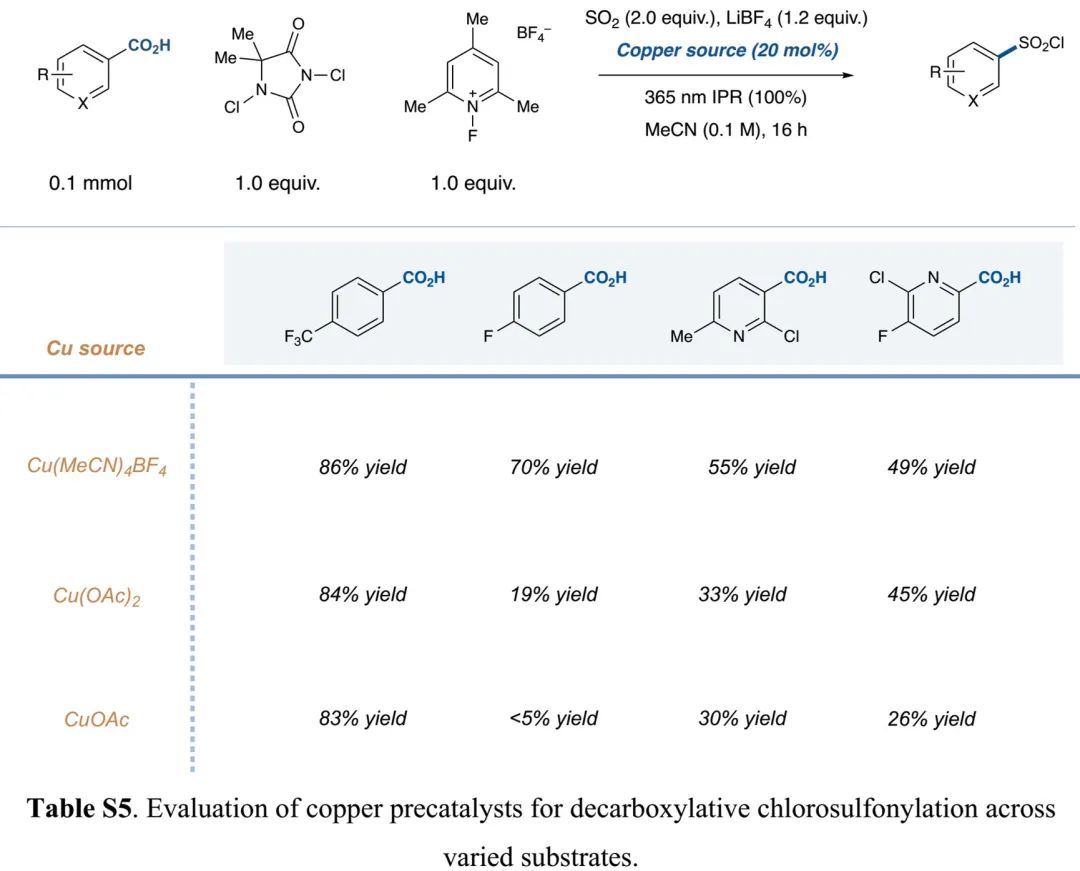
(Table S5 in SI, 来源:J. Am. Chem. Soc.)
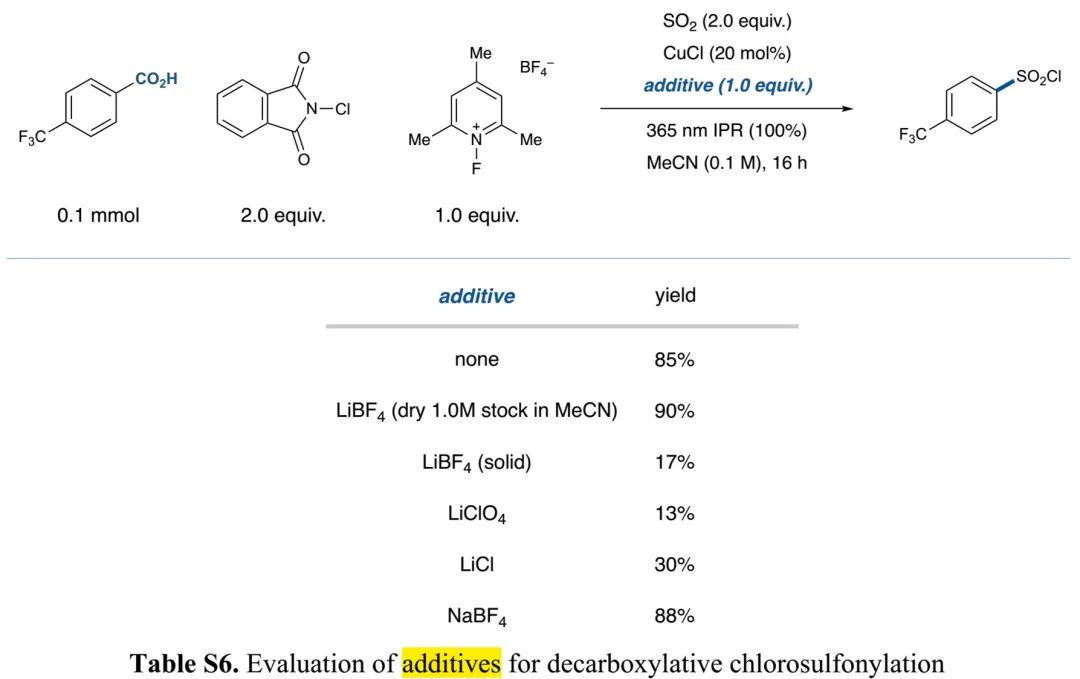
(Table S6 in SI, 来源:J. Am. Chem. Soc.)
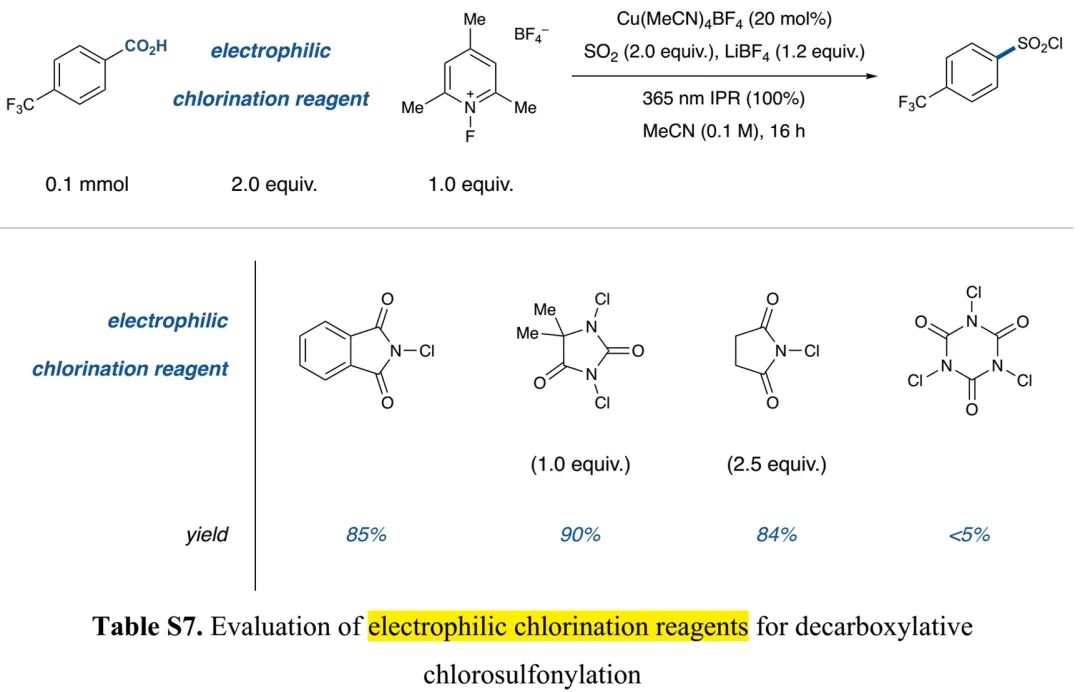
(Table S7 in SI, 来源:J. Am. Chem. Soc.)
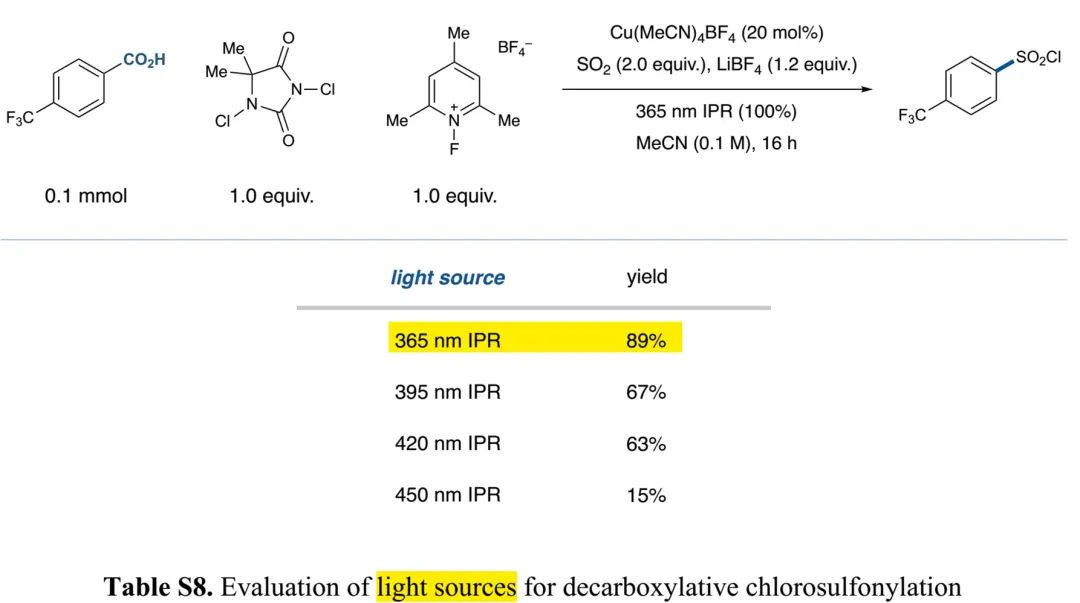
(Table S8 in SI, 来源:J. Am. Chem. Soc.)
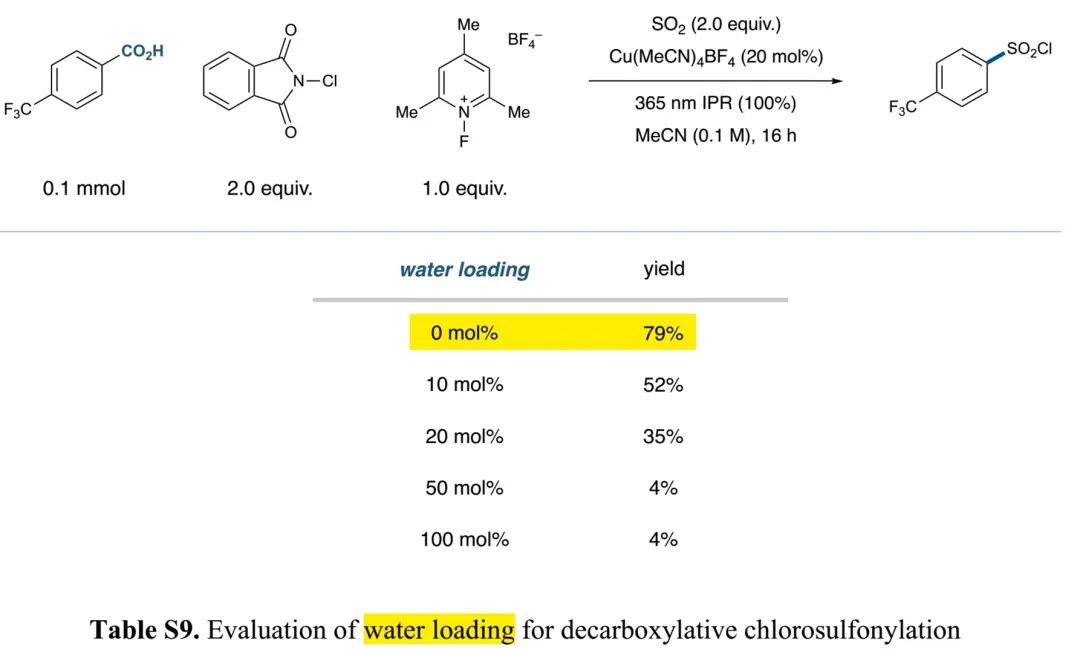
(Table S9 in SI, 来源:J. Am. Chem. Soc.)
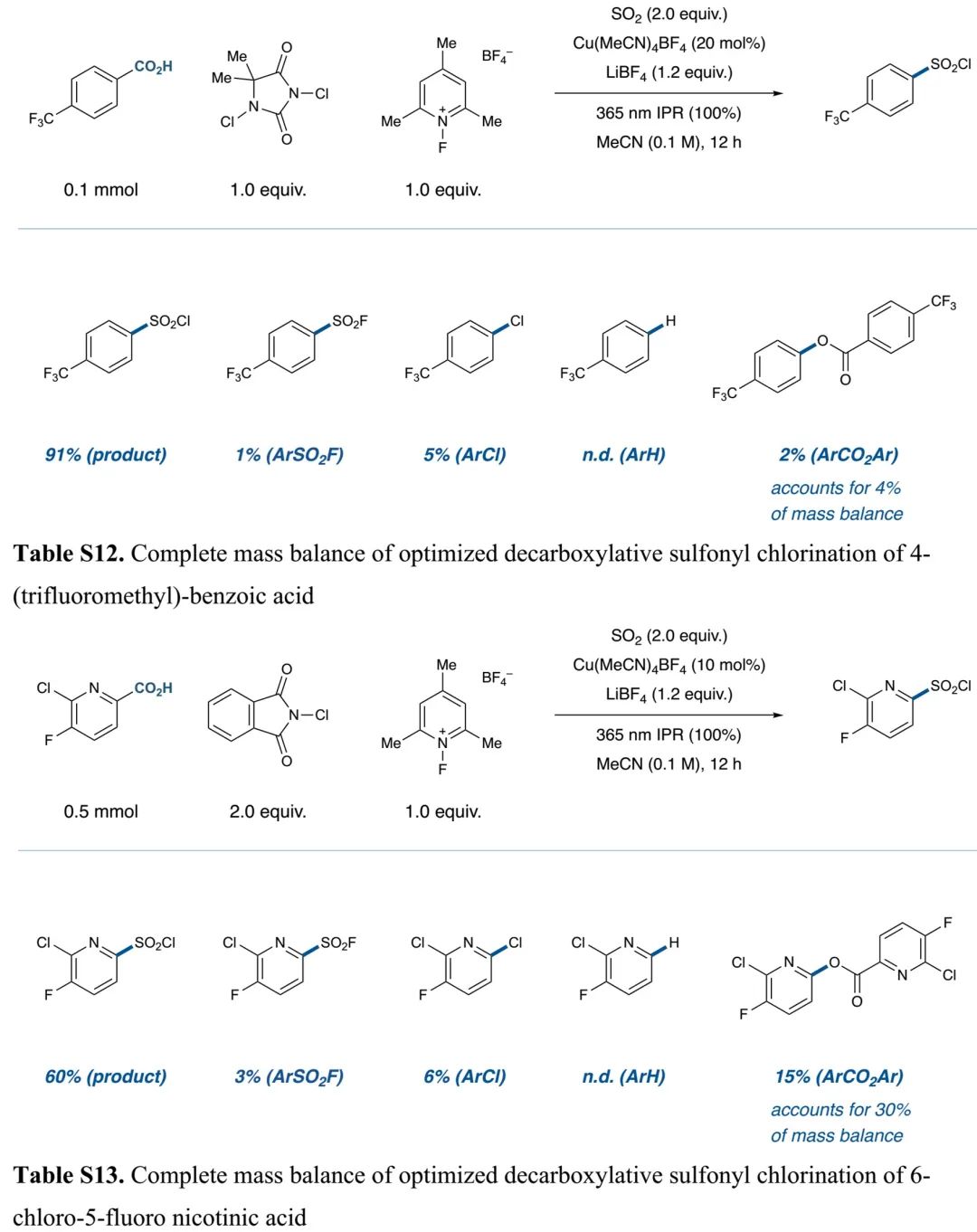
(Table S12、S13 in SI, 来源:J. Am. Chem. Soc.)
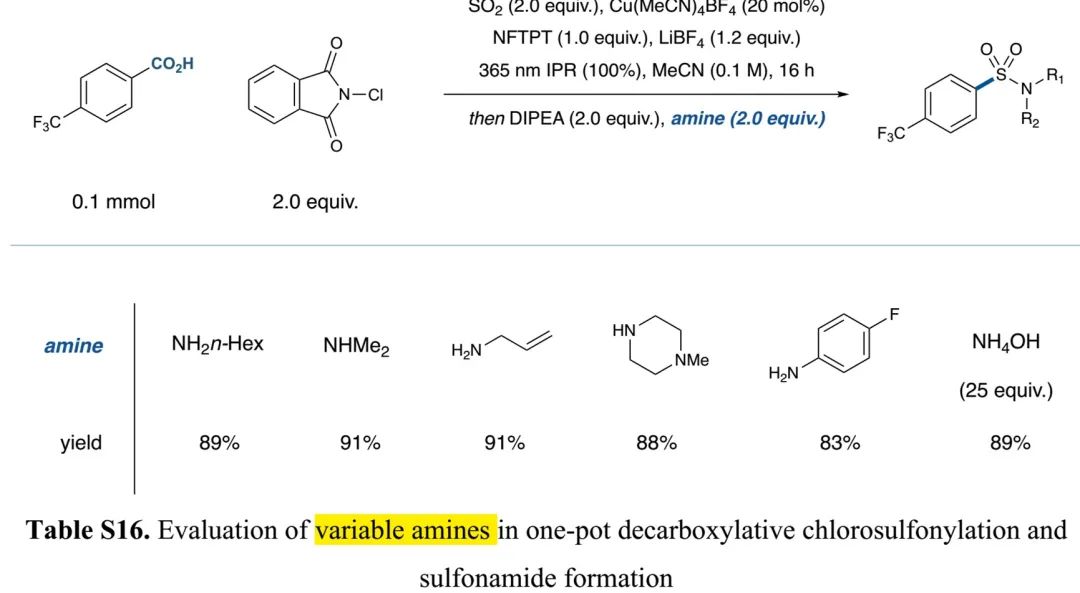
(Table S16 in SI, 来源:J. Am. Chem. Soc.)

(Table S18 in SI, 来源:J. Am. Chem. Soc.)
底物拓展和应用(Figures 3-5):
通过优化出的反应条件,作者开始底物拓展研究。作者首先开展一锅法合成磺酰胺的底物拓展研究。如Figure 3所示,苯环上含吸电子基团、供电子基团、大位阻基团的苯甲酸化合物,吡啶环上含吸电子基团的吡啶甲酸化合物,以及s-富集脂肪族羧酸(BCPs、环丙烷羧酸),都能通过一锅反应,以可观产率转化一级、二级或三级磺酰胺产物1-25。拓展底物所用的原料都不昂贵且商业可得,经过此方法,可以转化成昂贵或商业不可得的磺酰胺化合物,这证明该反应的应用价值。
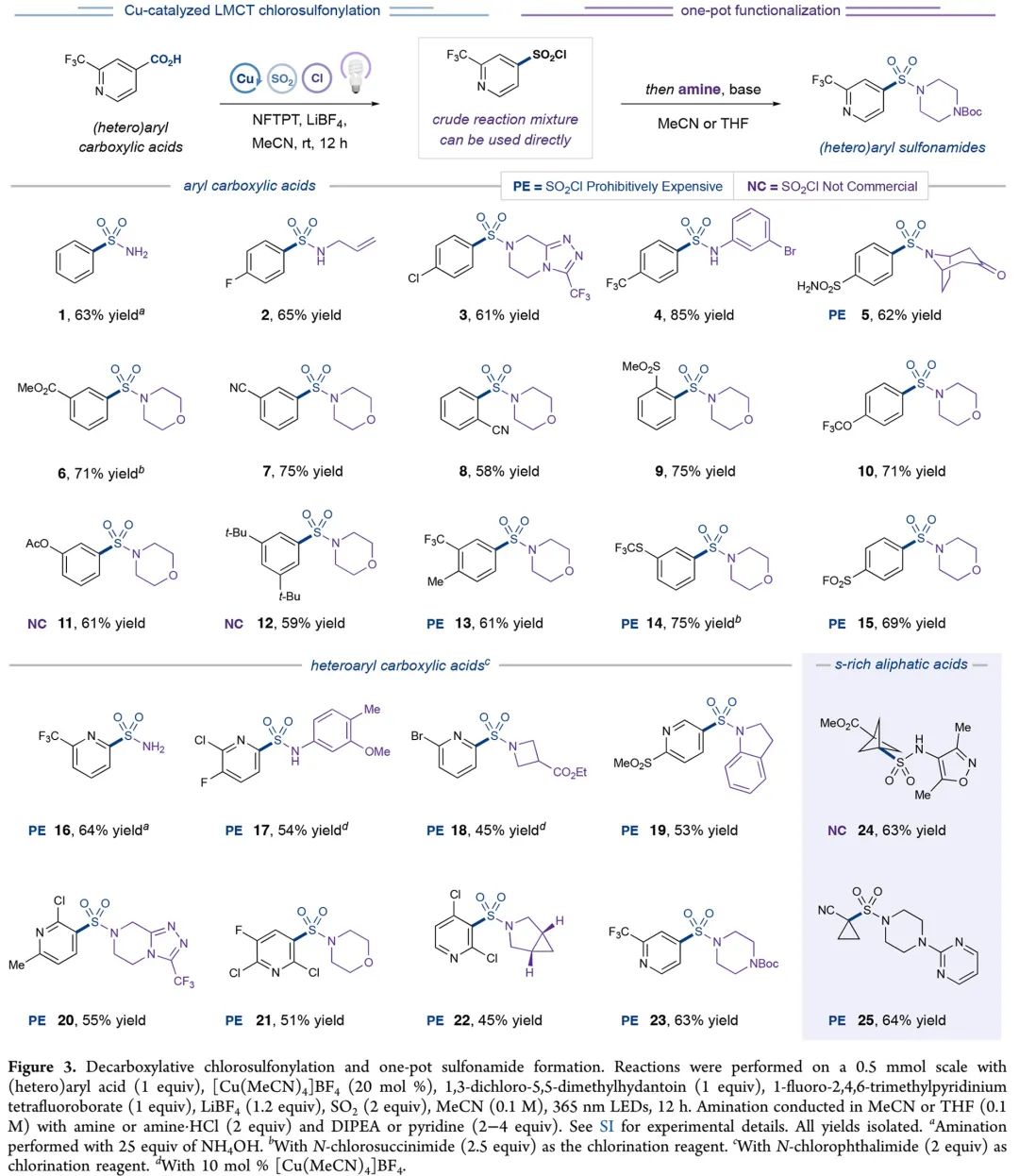
(Figure 3, 来源:J. Am. Chem. Soc.)
作者也对磺酰氟反应开展了底物拓展研究。如Figure 4所示,苯环上含吸电子基团、供电子基团、大位阻基团的苯甲酸化合物,吡啶环上含吸电子基团的吡啶甲酸化合物,缺电子哒嗪甲酸化合物,都能通过一步反应,以可观产率转化对应磺酰氟产物26-37。磺酰氟36是通过一锅的两步反应,先得到磺酰氯中间体再氟化得到。同时,为了识别磺酰氯和磺酰氟的活性差异,作者将两种反应模式应用于烟酸化合物。其中,先磺酰氯化再和N-Boc哌啶反应的一锅反应,会得到磺酰胺产物38;先磺酰氟化再和N-Boc哌啶反应的一锅两步反应,会得到发生SNAr反应的磺酰氟产物39。这种选择性是源于磺酰氟亲电性弱于磺酰氯。
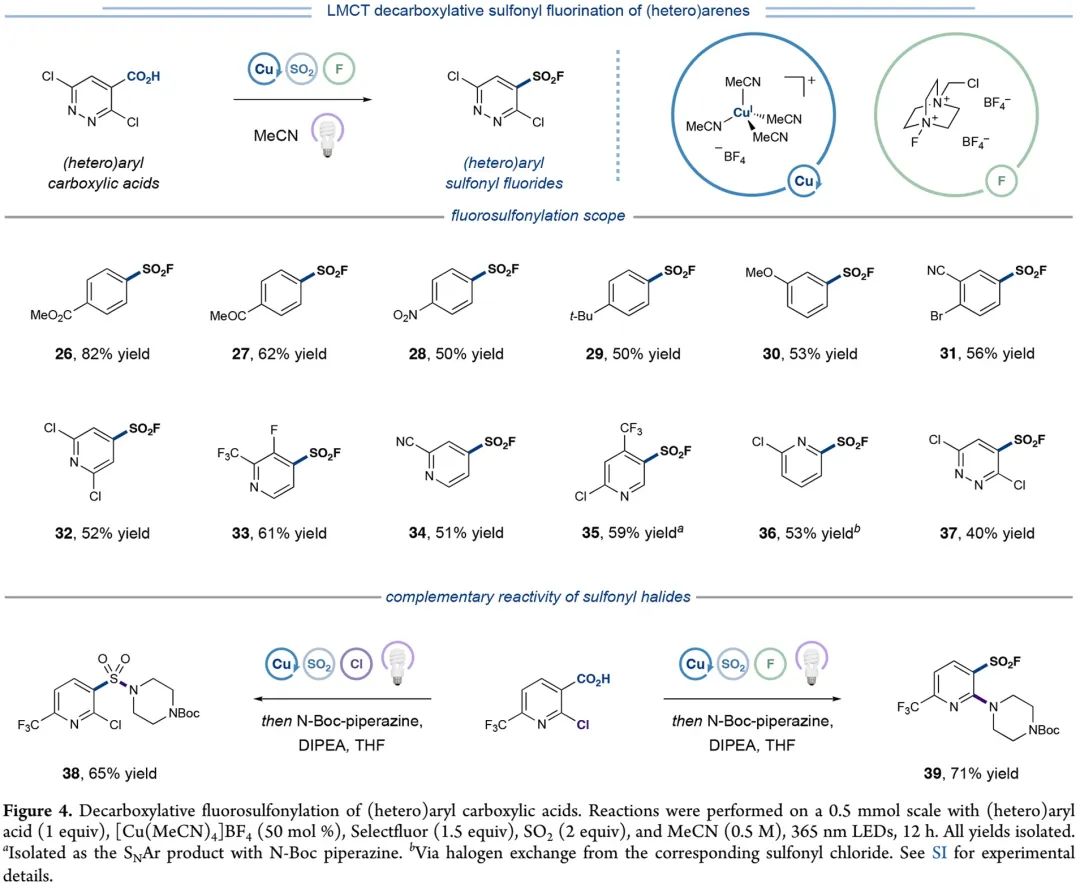
(Figure 4, 来源:J. Am. Chem. Soc.)
最后,作者开展了应用研究。如Figure 5所示,应用一锅磺酰胺方法,能以中等产率得到Bitopertin和Vismodegib(维莫德吉)的磺酰胺类似物40、41;应用磺酰氟反应,药物分子Atalurenand、Lumacaftor、Celebrex都能以中等产率转化成对应磺酰胺衍生物42-44。
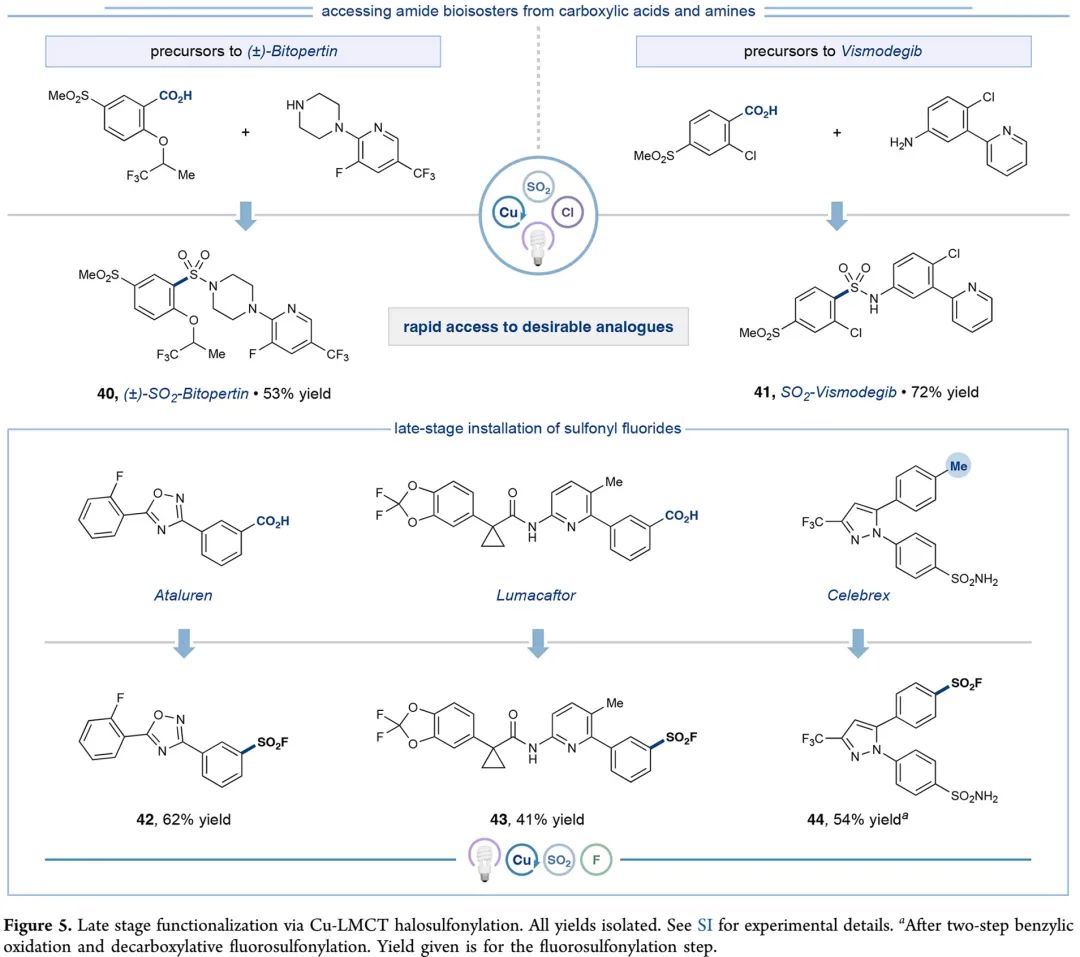
(Figure 5, 来源:J. Am. Chem. Soc.)
总结
总之,MacMillan教授课题组发展出一种新颖的光促铜催化脱羧卤磺酰化反应,可以实现磺酰胺和磺酰氟化合物的高效合成。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





