普林斯顿大学RobertR. Knowles课题组:光催化下烯烃和一级杂芳基胺的反马氏氢胺化反应
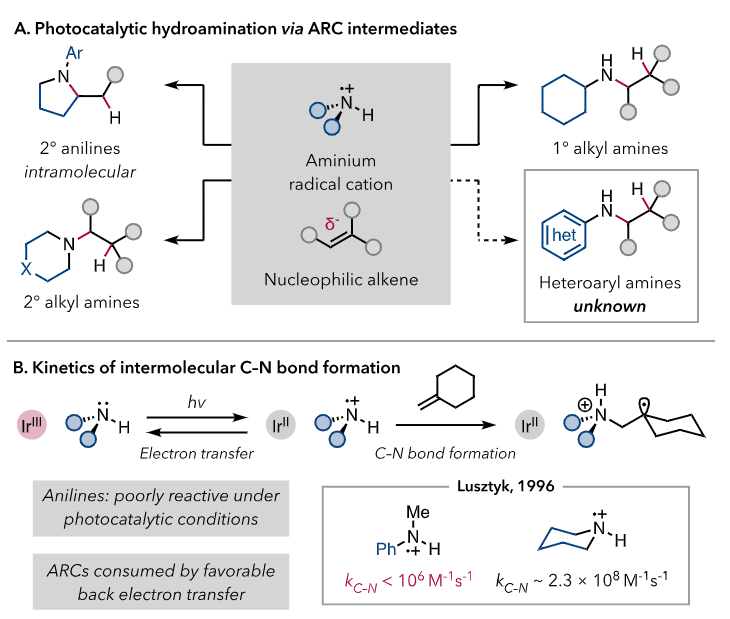
一级和二级烷基胺的ARCs能更加快速地构建C-N键,作者猜想是因为相较于芳基胺衍生的ARCs,烷基胺类的ARCs具有更强的亲电能力。生成烷基胺类的ARCs需要更高的氧化电势也反映了这一趋势。基于对ARCs反应性的理解,作者猜想给予杂芳基胺更高的氧化电势可以使ARCs与烯烃的反马氏加成的速度大于BET。
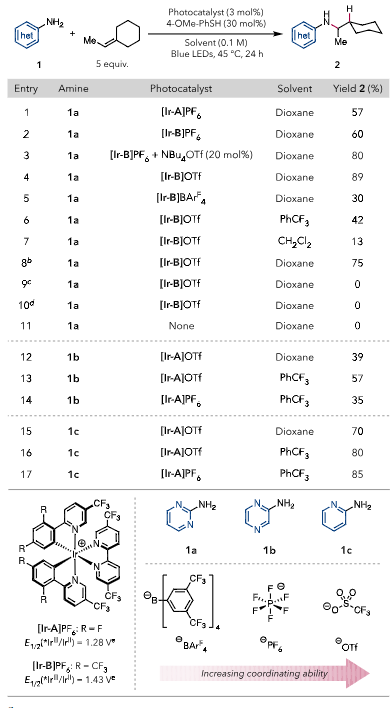
首先,作者对反应的条件进行了优化。当使用位阻更小,结合性更强的-OTf作为阴离子对时,产物的产率更高,最佳的溶剂为Dioxane,最终以89%的产率得到了目标产物。当使用氧化电位更低的1b和1c(Ep/2= 0.98 and 0.83 V vs Fc+/Fc in MeCN for 1band 1c, respective)作为底物时,反应效率都有不同程度的降低。根据结果得知,[Ir-A]OTf对于MeCN中Ep/2<1.20 V vs Fc+/Fc的胺是最优的,[Ir-B]OTf对MeCN中Ep/2>1.20 V vs Fc+/Fc的胺是最佳的。
在最佳条件下,作者对底物进行了拓展。当杂芳基胺的芳基上带有不同的给电子、吸电子以及各类官能团时,反应都能良好兼容。然而4-氨基吡啶有较强的碱性,其生成的ARC容易发生脱质子,当吡啶环上带有取代基时,也可以以较高的收率得到目标产物(19,20)。此外2-氨基嘧啶和其他氨基杂芳环也具有良好的兼容性。
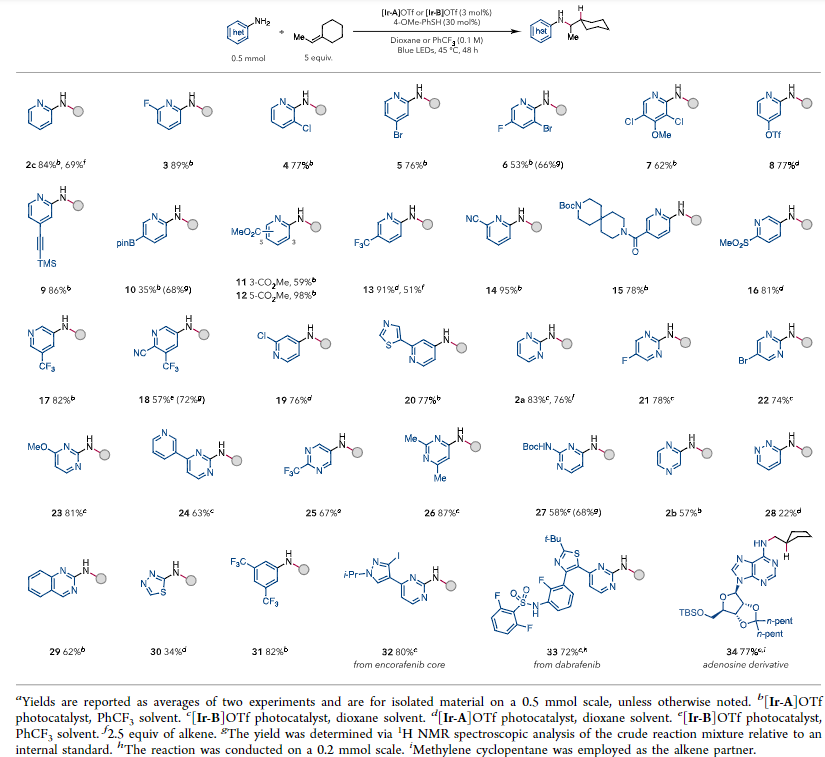
接着对烯烃也进行了底物拓展,同样具有广泛的底物普适性。对于单取代、1,1-二取代,1,2-二取代1,2,2-三取代以及四取代烯烃都能在该体系中进行反应得到目标产物。

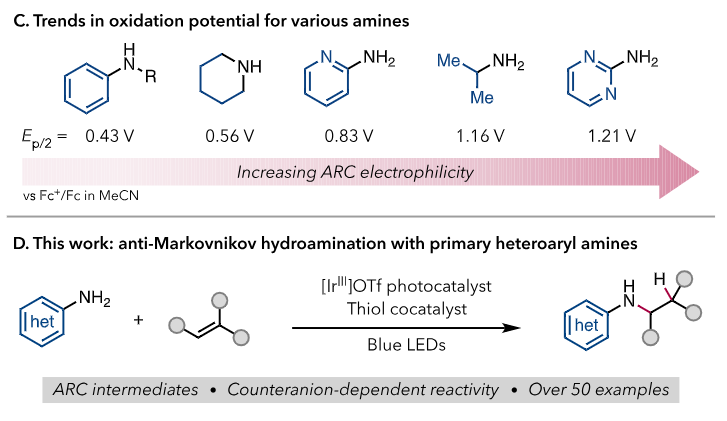
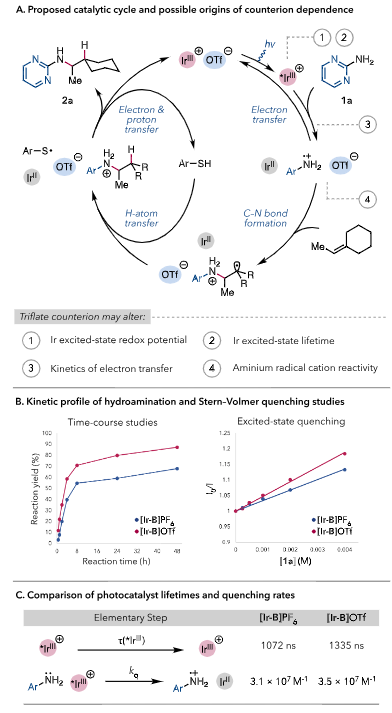
最后对机理进行了研究,作者首先给出了可能的催化循环。时间进程研究和荧光淬灭实验表明反应机理更倾向于电子转移,[*Ir-B]OTf的反应活性比[*Ir-B]PF6更高,原因可能是1a•+与-OTf的结合能力比-PF6更高,可以使ARC更加稳定,并且抑制脱质子反应的发生。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




