Angew. Chem. :以无机盐为官能团来源的可见光催化的脱羧溴化、氯化和硫氰化反应研究
近日,上海交通大学变革性分子前沿科学中心吴晶晶课题组与英国布里斯托大学Aggarwal教授课题组合作,在可见光催化的脱羧官能团化中,取得重要研究进展。
羧酸是有机物的一种常见官能团,普遍存在于天然产物及药物分子中。因此发展脱羧官能团化的合成方法学,将这些容易获得的羧酸,转化为高附加值的衍生物将非常具有实用价值。自由基介导的烷基羧酸的脱羧反应被证实在复杂分子的后期修饰合成有价值的合成砌块中,具有重要应用价值。一系列自由基脱羧转化,构建C (sp3)-C键、C (sp3)-B键、C (sp3)-N键、C (sp3)-O键以及C (sp3)-卤键的方法被发展起来。
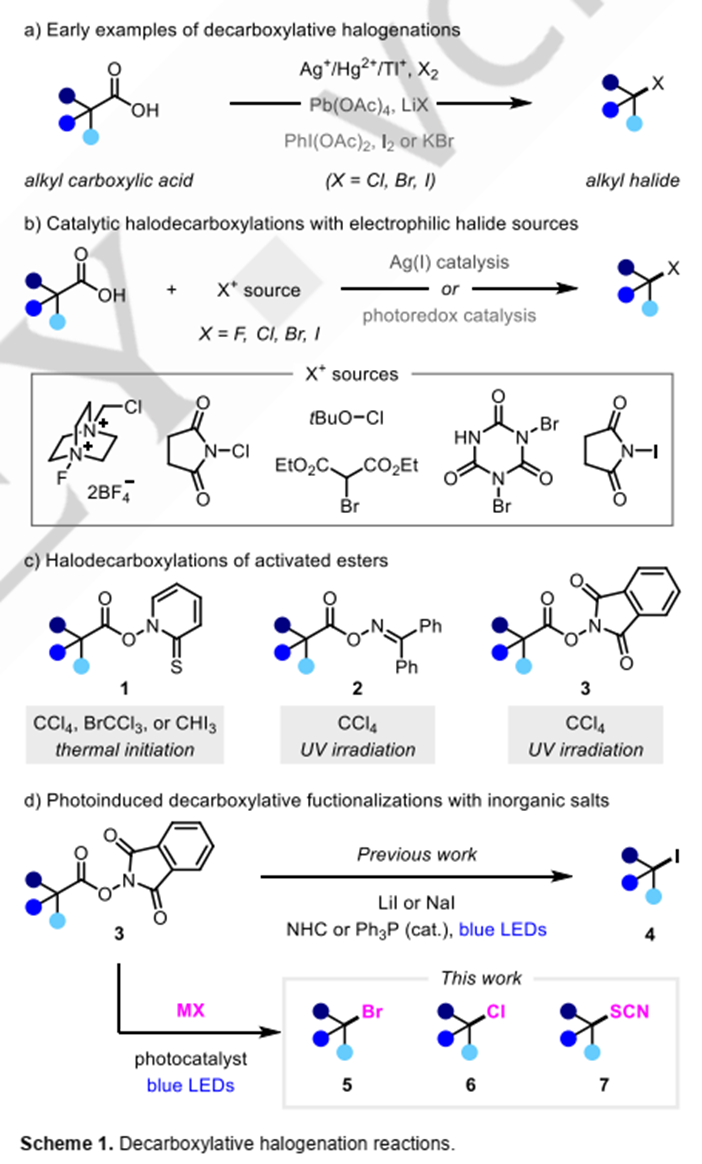
脱羧卤化反应,通常被称作Hunsdiecker反应,是合成化学中最著名的脱羧转化之一。最早通常需要制备严格无水的羧酸银盐,与溴单质反应,实现脱羧溴化。鉴于制备严格干燥羧酸银盐的难度,其它改良方法,如使用金属Hg(II), Pb(IV)以及Tl(I)被陆续报道。但这些方法,仍然需要使用剧毒的重金属,直到1986年Suárez等报道了PhI(OAc)2可以代替重金属,在碘存在的条件下,经光照实现脱羧碘代反应。以此为基础,后续的脱羧溴代、氯代方法陆续被开发出来。最近银催化以及可见光催化的方法亦被发展起来。然而,这些方法绝大多数依赖于使用强氧化性、强亲电性的卤代试剂,因而许多富电子的芳环、烯烃等官能团无法兼容。而使用简单的金属卤化物作为卤代试剂的方法亦被有报道,但这些反应仍然需要使用化学计量的强氧化剂,如Pb(OAc)4, PhI(OAc)2等,这大大限制了官能团的容忍性。因此,发展温和条件下,无需使用强氧化剂的脱羧卤代反应,是现有方法的一个很好补充。
1983年Barton报道了改良的脱羧卤代反应,羧酸首先被转化为硫代羟肟酸酯1,其在光解的条件下可与 CCl4, CBrCl3 以及CHI3经自由基链式过程发生脱羧卤代反应。类似的过程被Hasebe和Okada小组改良,他们分别以二苯甲酮肟酯2 以及氧化还原活性酯3,在CCl4 中经过紫外光照,实现脱羧氯代。这些方法成功避免使用强氧化性的卤代试剂,但是仍然需要使用溶剂量的毒性较高的卤代烃类作为卤代试剂。这一局限性在2020年被克服,陈翔宇和尚睿课题组分别报道了氧化还原活性酯3与碘盐,在NHC或者Ph3P催化下实现脱羧碘代反应。该反应条件温和,无需使用过渡金属,无需使用光催化剂,因为活性酯3能够与碘代物以及路易斯碱形成电子给受体复合物。这些反应具有优秀的官能团容忍性,但是反应仅仅局限于碘代,其它溴代、氯代反应不能发生。
针对上述问题,吴晶晶团队设想仅仅使用简单的无机盐,这种氧化还原活性酯脱羧卤代反应,能否拓展到溴代、氯代反应呢?因此,作者首先发展了一种以LiBr作为溴源,可见光氧化还原催化的活性酯的脱羧溴化反应。进而以LiCl为氯源,发展了一种光氧化还原-铜协同催化的脱羧氯代反应,最后将这种双催化的策略应用于脱羧硫氰化反应。
首先,作者研究了在蓝光照射下以氧化还原活性酯3a与LiBr在MeCN中的脱羧溴化反应(表1)。通过对光敏剂的筛选,作者发现廉价的有机光催化剂4CzIPN与Ir[dF(CF3)ppy]2(dtbbpy)PF6光催化剂给出了相同的产率(93%)。
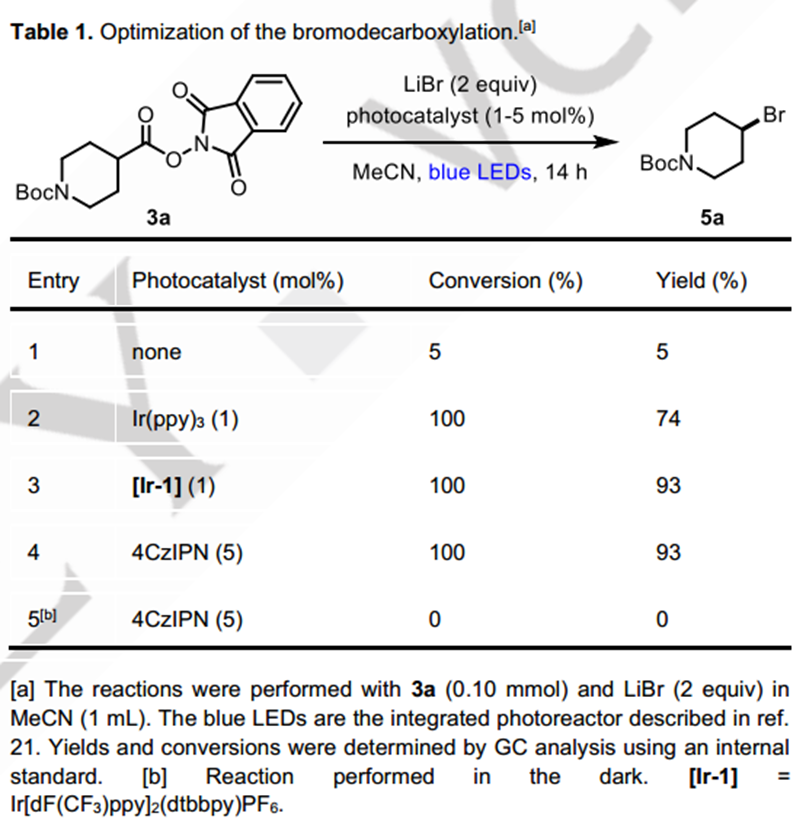
在最优条件下,作者又进行了脱羧溴化的底物拓展。多种一、二、三级烷基底物均可以以较高产率获得对应的溴代产物,金刚烷(5f)和立方烷(5e)底物的适用证明了该条件对大位阻底物的兼容。温和反应条件带来了优异的官能团耐受性,也使许多复杂的天然产物衍生物能够制备对应的烷基溴化物,包括樟脑酸 (5l)、石胆酸(5m)、谷氨酸(5n)和赤霉酸(5o, 5p)。
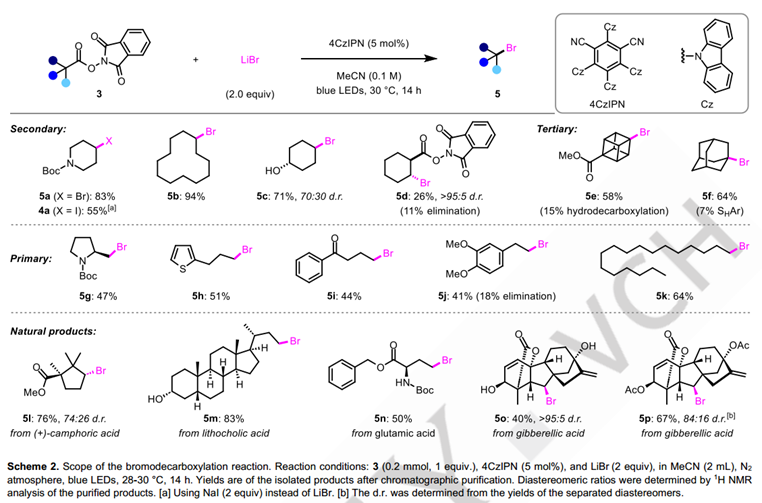
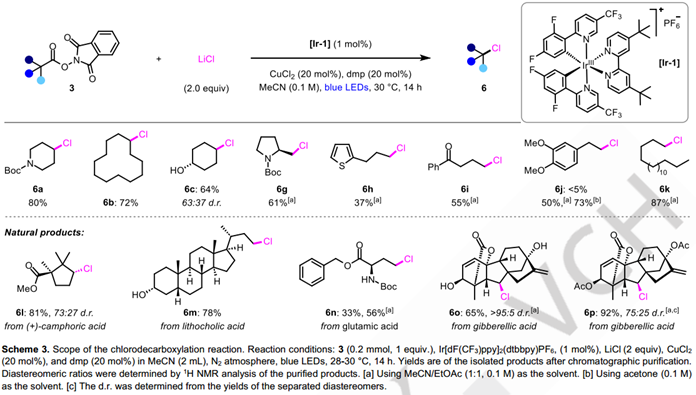
接下来,作者将注意力转向脱羧氯化反应(表2)。最初尝试在溴化条件下简单地用LiCl取代LiBr,能以15%的收率获得所需氯代产物,表明反应设计确实是可行的。然而,由于脱羧氢化的竞争反应,使得6a的产率总是不如人意。参考最近邹建平教授课题组发表的铜催化的烷基自由基氯化反应的报道,作者随后尝试添加不同的铜催化剂和配体,最终可以以96%的产率获得脱羧氯化的产物。
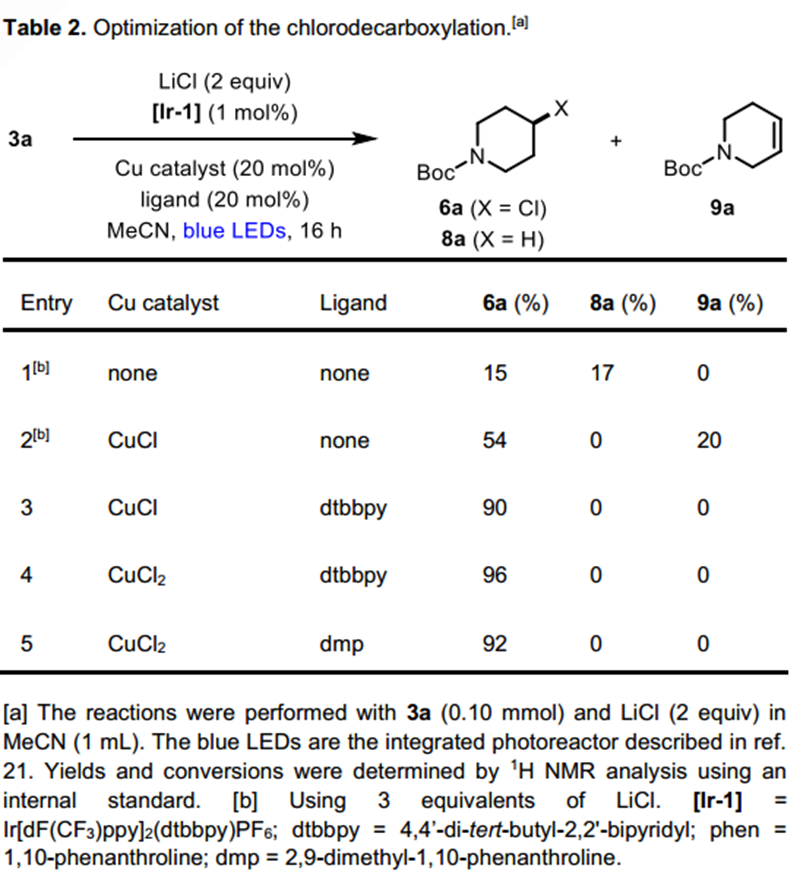
接下来作者进行了脱羧氯化反应的底物拓展,二级烷基的底物依然以较好的产量转化为对应的氯代产物,但一级烷基自由基底物却给出了较差的反应活性。他们通过对反应溶剂的调换,将一级烷基底物的转化产量进行了提高。与溴代反应一样,该反应也展示了良好的底物官能团普适性,部分复杂天然产物的底物及特殊官能团均得以兼容。
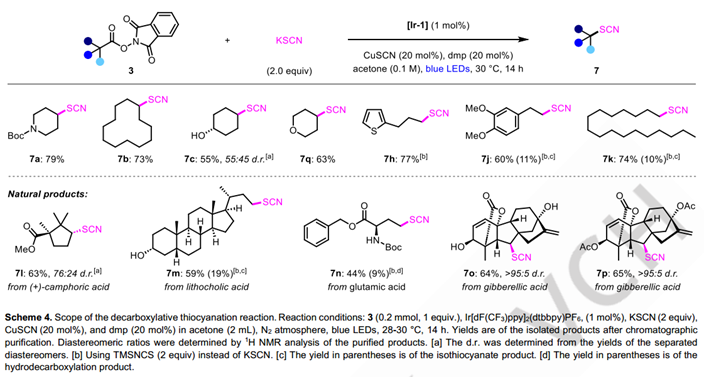
考虑到铜催化的策略成功实现了烷基自由基的多种官能化,该课题组继续研究这些光-铜协同催化的脱羧反应是否可以扩展到卤化反应之外。有机硫氰根官能团广泛应用于有机合成中,它也存在于多种活性天然产物中。虽然目前有许多方法可以合成烷基硫氰酸酯,包括通过自由基途径,但脱羧硫氰基化是罕见的。1992年,Barton等报道的烷基羧酸脱羧硫氰基化,是目前为止唯一的例子。然而,他们的方法依赖于使用不稳定的Barton酯前体和亲电性的TsSCN或MsSCN。研究人员设想,对这类反应,使用简单易得的无机硫氰酸盐无疑是非常具有吸引力的。基于先前关于使用铜催化与亲核硫氰酸盐试剂进行硫氰基化反应的报道,作者推断,使用他们前面发展的光-铜协同催化条件,可以很容易地实现氧化还原活性酯的脱羧硫氰基化反应。令人欣慰的是,只对脱羧氯化条件进行了微小的修改,包括将LiCl转换为KSCN,将CuCl2转换为CuSCN,底物3a的脱羧硫氰基化反应得到了74%的NMR产率(详见SI)。在底物扩展中,二级烷基底物往往展示出良好的反应活性,一级底物的活性依然较差,他们KSCN换成TMSNCS后一级烷基的底物的活性有了较大提高。除了简单的底物,部分天然产物的底物也可以以较高产量转化为对应的产物,展示了优秀的官能团兼容性。
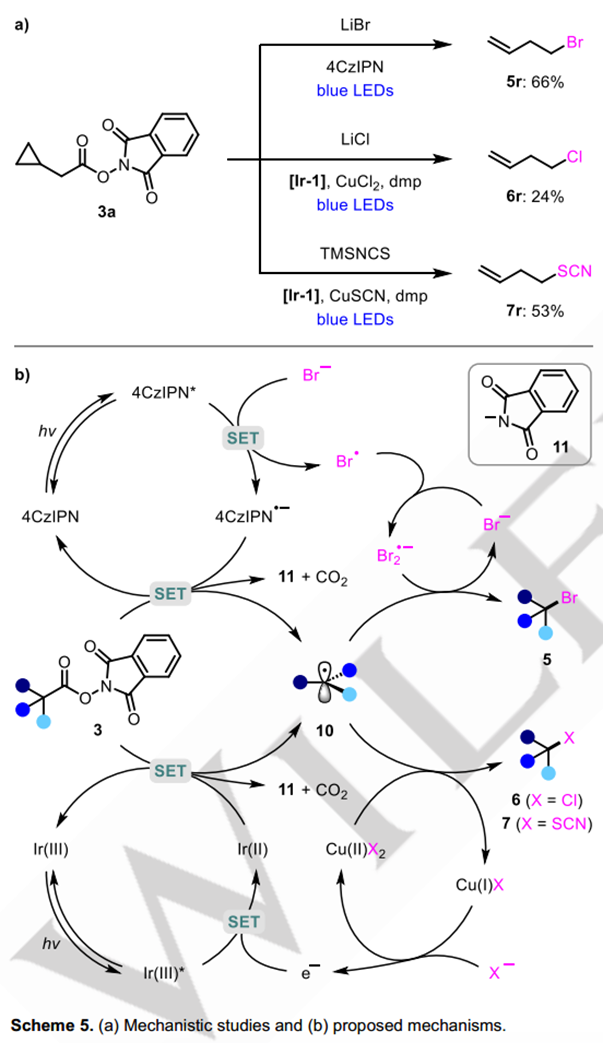
为验证反应的机理,作者还用环丙基甲基氧化还原活性酯3r进行了自由基钟实验(图5a)。环丙烷开环产物5r、6r和7r分别作为溴化、氯化和硫氰酸反应的唯一观察到的产物获得,从而证实了反应经历自由基中间体的过程。基于此,作者给出了如下的反应的机理:对于自由基脱羧溴代反应,烷基自由基与双溴自由基负离子通过溴原子攫取的方式发生溴代反应;而对于光铜协同催化的氯化、硫氰化反应,烷基自由基可以与铜物种通过球内机制形成三价铜中间体,或者通过球外的原子攫取方式进行。
综上所述,吴晶晶课题组与Aggarwal教授课题组合作,发展了一种可将光催化的脱羧溴化、氯化和硫氰化反应。以廉价易得的无机盐 (LiBr, LiCl, and KSCN) 作为官能团来源,这些氧化还原中性的转化能够顺利进行,从而避免使用当量的氧化剂及强亲电试剂。简单无过渡金属参与、无需额外添加剂的脱羧溴化反应被发展起来,而脱羧氯化、硫氰化反应则是通过光铜协同催化的方式进行的。温和的条件,使得反应具有优秀的官能团容忍性,一系列复杂的天然产物羧酸分子被转化为相应的溴、氯、硫氰酸酯衍生物。
论文信息
Photoredox-Catalyzed Decarboxylative Bromination, Chlorination and Thiocyanation Using Inorganic Salts,Dr. Jingjing Wu, Dr. Chao Shu, Zhihang Li, Dr. Adam Noble, Prof. Dr. Varinder K. Aggarwal
上海交通大学变革性分子前沿科学中心吴晶晶副教授为文章的第一作者,英国布里斯托大学Adam Noble助理教授及Varinder K. Aggarwal教授为文章的通讯作者。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





