加利福尼亚大学Abigail G. Doyle课题组:对初级和次级苄基 C-H 键的亲核胺基化通用光催化反应
期刊名:JACS
DOI:10.1021/jacs.3c04912
作者报告了一种可见光氧化催化方法,该方法可实现伯、仲苄基 C(sp3)-H 键的亲核胺化。一种新型酰胺自由基前体和有机光催化剂协同作用,通过连续的氢原子转移 (HAT) 和氧化自由基-极性交叉(ORPC),将伯、仲苄基 C(sp3)-H 键转化为碳正离子。碳正离子可被各种N 中心的亲核试剂捕获,包括腈类、酰胺类、氨基甲酸酯类、磺酰胺类和唑类,从而构建出药物分子中的 C(sp3)-N 键。机理研究表明,HAT 由酰胺基自由基介导,光催化剂通过还原淬灭途径起作用。作者实现了一种温和、无金属、模块化的方法,可快速将 C(sp3)-H 键转化为胺化产物。
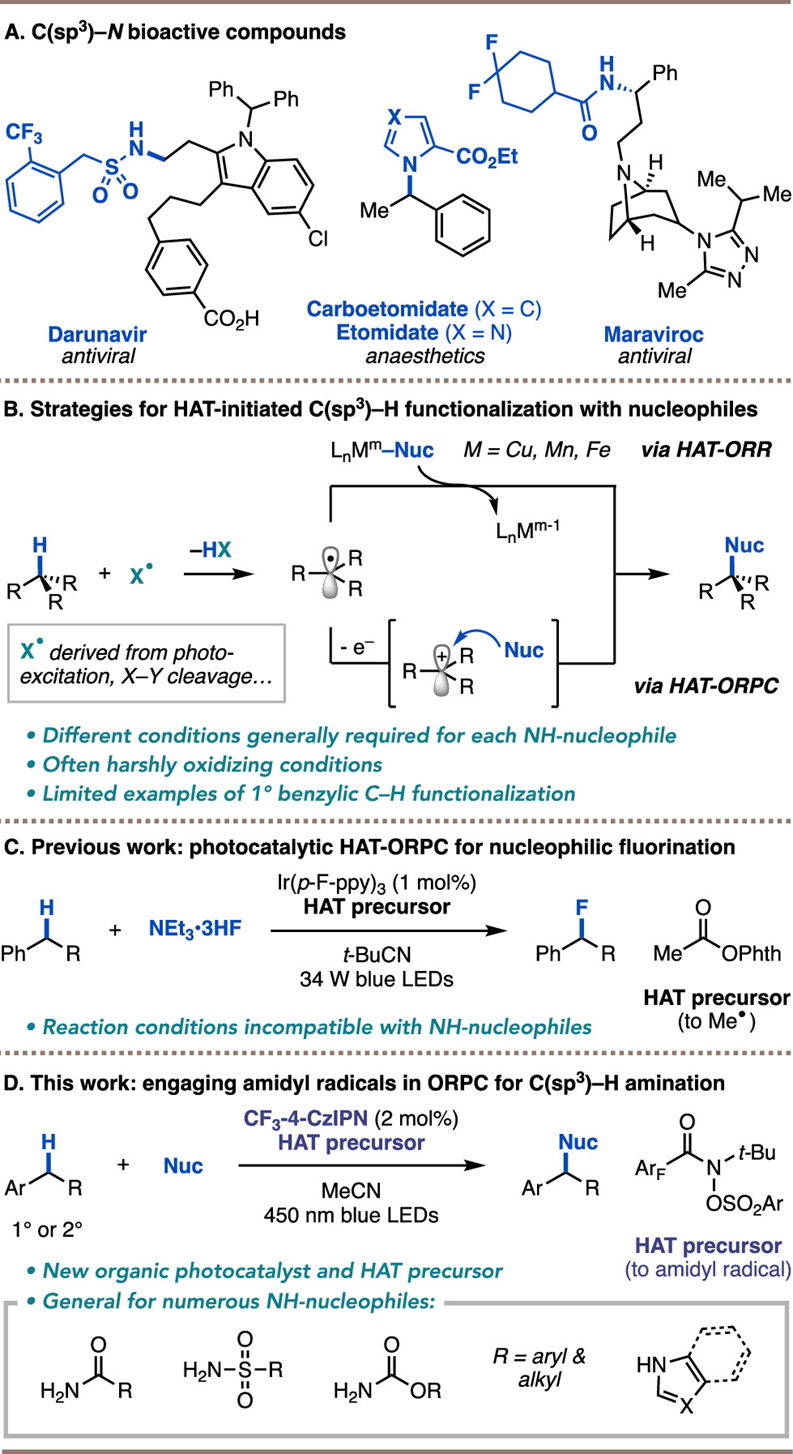
作者设想,将 HAT 与 ORPC 结合起来以开发一种通用而温和的 C(sp3)-H 胺化。作者之前的研究包括作为光催化剂的 Ir(p-F-ppy)3 和作为 HAT 前体的 N-乙酰氧基邻苯二甲酰亚胺,能够实现二级和三级苄基和烯丙基 C(sp3)-H 键的氟化。其他亲核物如氯化物、醇类、硫醇和水等也可以耐受,而氮基亲核物则没有反应。作者发现,NH-亲核物(如磺酰胺类和酰胺类)会因与 NEt3-3HF 添加剂发生竞争性氢键作用而失活。与 NH-亲核物的氢键结合也抑制了 N-乙酰氧基邻苯二甲酰亚胺、NEt3-3HF 和 Ir(p-F-ppy)3 生成甲基自由基。作者希望能找到新型 HAT 前体,在还原性较低的条件下提供极性匹配的 HAT 药剂,以及/或者找到一种光氧化催化剂,扩大 HAT 试剂还原生成和自由基氧化的氧化还原窗口,就能解决这一局限性。
作者先对新型 HAT 前体的制备和评估进行优化。脒基在分子间快速、选择性地抽取氢原子方面非常有效,作者将苯甲酰胺分子上含有 3,5-双(三氟甲基)取代基和氮上含有叔丁基取代基的脒基作为 HAT 药剂的目标。作者推断,在氮中心安装磺酸酯离去基团可以满足该反应的要求。HAT 试剂 A-C 的制备只需两步,无需柱层析,即可得到稳定的固体。
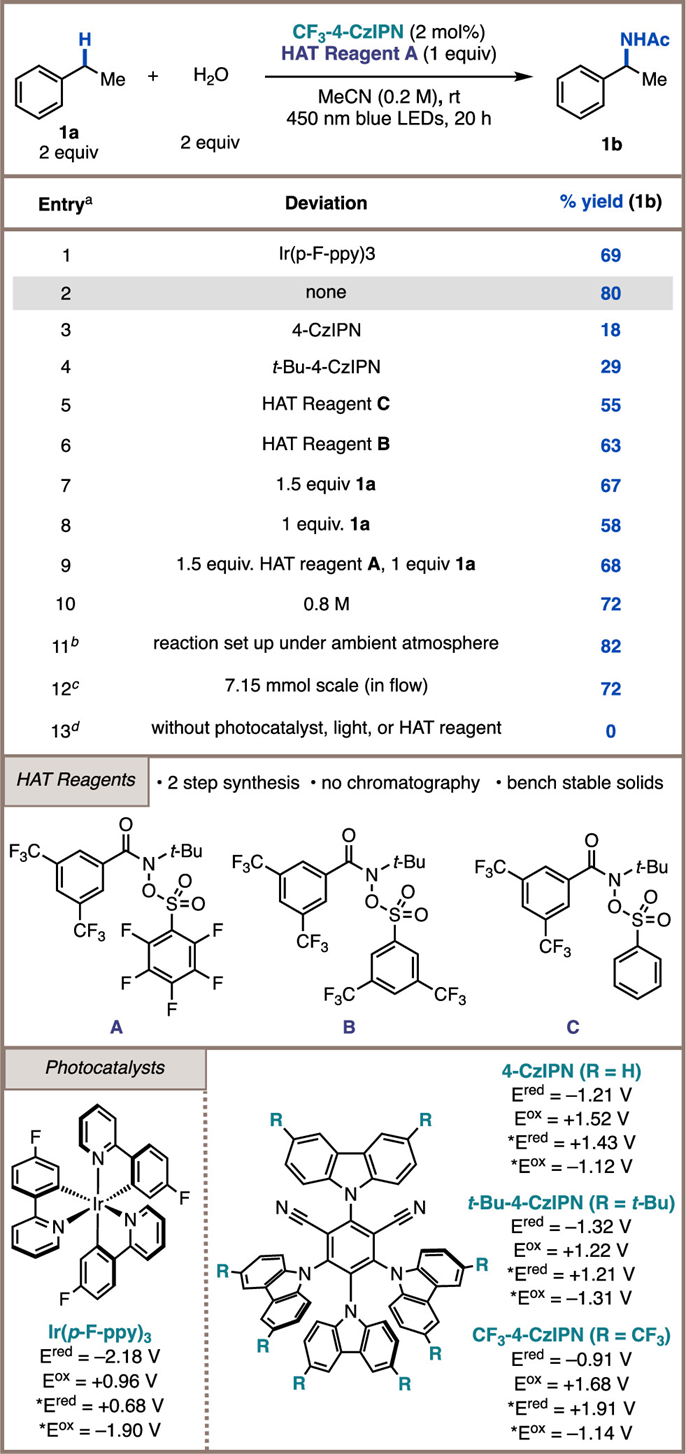
以乙腈为溶剂,H2O(2 当量)为亲核剂,在乙苯(1a)的C(sp3)-H 酰胺化反应中研究了这些HAT 试剂,从而得到乙酰胺 1b。以Ir(p-F-ppy)3 为光催化剂,使用 HAT 试剂 A(1 当量),得到产物 1b,收率为69%(条目 1)。对粗反应混合物的 19F NMR 光谱分析显示,铱光催化剂分解,HAT 试剂未完全转化。作者接下来对有机光催化剂进行研究,在各种转化过程中,有机光催化剂比过渡金属光催化剂具有更高的稳定性。进行的初步光催化剂筛选表明,许多有机光催化剂支架都能胜任该反应。虽然使用 4-CzIPN 和 t-Bu-4-CzIPN(条目 3 和 4)时的产率比 Ir 低,但在反应结束时没有观察到有机光催化剂的分解。
当使用氧化性更强的CF3-4-CzIPN 作为催化剂时,反应活性明显提高,生成物 1b 的产率达到 80%(条目 2)。使用CF3-4-CzIPN 作为光催化剂,与 A 相比,HAT 试剂 C 和 B 进行酰胺化反应的效率较低(条目 5 和 6)。A 上的高电子吸收性全氟可苯能会导致光催化剂的单电子还原和酰胺基的裂解加速。虽然 2 个当量的乙苯对能产生最佳产率,但使用 1.5 或 1 个当量的乙苯仍能产生 1b,产率分别为 67% 和 58%(条目 7 和 8)。此外,使用 1 个当量的 1a 和少量过量的 HAT 试剂 A 可生成乙酰胺 1b,收率为 68%(条目 9)。在较高浓度(0.8 M)下重复该反应可得到所需的产物,但产率略低,这可能是由于光催化剂在乙腈中的溶解度较低(条目 10)。在空气下进行反应,产物 1b 的收率为 82%(条目 11),这表明 CF3-4-CzIPN 具有独特的氧化还原稳定性,可以不被空气导致光催化剂失活。为了突出这些条件的实用性,与以往依赖强化学计量氧化剂、高温和较长的反应时间的经典方法相比,这些条件代表了对苄基 C-H 键进行酰胺化反应的一种异常温和的方法。
有了优化的条件,作者接下来关注的是该方法的通用性。为了系统地选择各种 C-H 底物,如下图所示。
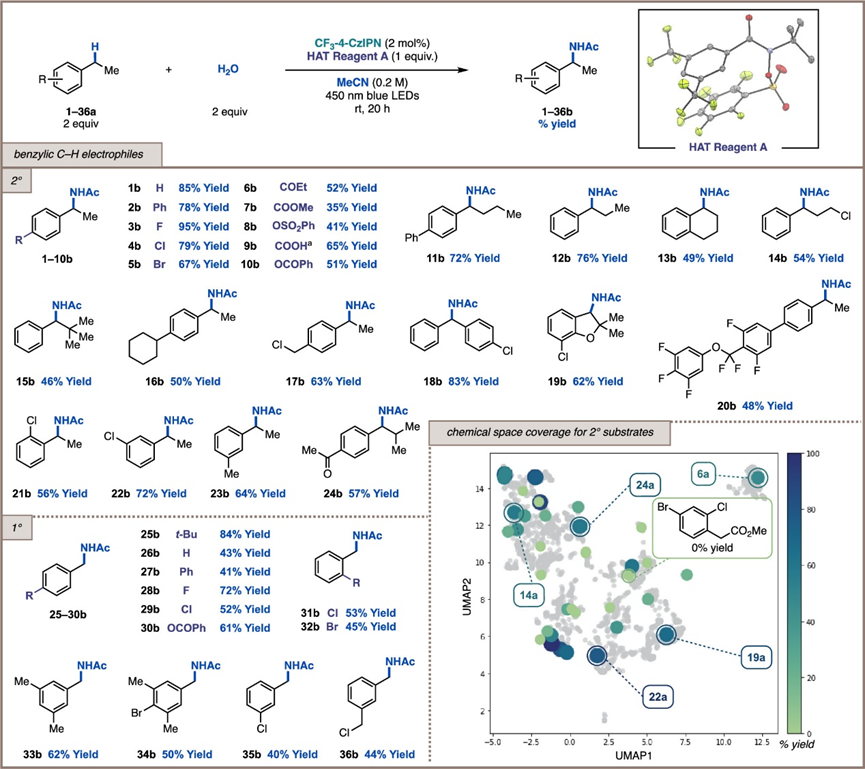
作者接下来对这一策略C(sp3)-H与酰胺、氨基甲酸酯、脲、磺酰胺和唑进行酰胺化反应的通用性进行研究。如下图所示。

作者接下来对机理进行研究。作者假设,HAT 试剂 A 通过氧化光催化淬灭循环在原位生成一个酰胺基自由基,在这一循环中,激发态 CF3-4-CzIPN 对 HAT 试剂进行单电子还原,诱导裂解。此后,氧化光催化剂将负责氧化 HAT 后形成的苄基自由基,完成 ORPC。
作者首先试图确认反应中是否产生了 N-叔丁基自由基。作者从典型的反应混合物中分离出了高产率的 N-叔丁基酰胺 72(A)。此外,当苄基 C(sp3)-H 对和亲核体被 1,1-二苯基乙烯取代时,由于氮中心自由基与烯加成,随后发生氧化和碱介导的消除反应,得到了烯酰胺 73(B)。作者接下来进行了一系列Stern-Volmer 荧光淬灭实验(C)。

HAT 试剂 A 并没有淬灭 CF3-4-CzIPN 的发光,这表明反应不太可能通过这种光催化剂的氧化淬灭进行。其他实验显示,包括乙苯在内的所有反应成分都没有淬灭激发态 CF3-4-CzIPN 光催化剂,因此排除了 C(sp3)-H 底物直接氧化的可能性。紫外可见光谱实验表明,HAT 试剂 A 和CF3-4-CzIPN 之间的电子供体-受体 (EDA) 复合物也不太可能促进单电子氧化还原化学反应。然而,Stern-Volmer 实验确实表明,A 能有效地淬灭 Ir(p-F-ppy)3 的激发态(C)。这表明存在不同的机制,即 Ir(p-F-ppy)3 等还原性较强的光催化剂通过氧化淬灭途径形成产物,而氧化性较强的 CF3-4-CzIPN 在激发态的还原性不足,无法以这种方式激活 HAT 试剂。
作者考虑了其他可能的机制。经测量,这种转化的量子产率为 0.002,这表明自由基链过程不太可能发生或效率很低,而且就光催化剂而言,该反应很可能是非分子反应。其中 CF3-4-CzIPN 的自由基阴离子负责 HAT 试剂的单电子还原。循环伏安图显示,HAT 试剂 A 对 SCE 的还原电位为-1.36 V,这使得 CF3-4-CzIPN 自由基阴离子对 A 的还原在热力学上上升了 ∼ 9 kcal/mol。尽管如此,考虑到光反应器中略微升高的反应温度以及单电子还原之后的不可逆放热步骤,这一步骤还是可行的。为了确定这一基本步骤是否可行,作者对含有 CF3-4-CzIPN 和 HAT 试剂 A 的溶液进行了伏安测定(D)。虽然光催化剂本身的伏安图是可逆的,但当这两种物质同时存在时,作者观察到 PC/PC 对偶的电流响应增大且缺乏可逆性。这些结果表明,HAT 试剂 A 的还原很可能是通过由 CF3-4-CzIPN 的自由基阴离子介导的 SET 机制进行的,这与作者之前的 Stern-Volmer 发光淬灭实验结果一致。
为了进一步了解这种机理的可能性,作者进行了各种光谱研究和对照实验。首先,用蓝色 LED 照射 CF3-4-CzIPN 和 DIPEA 的溶液,观察到颜色从浅黄色变为深黄/橙色。紫外可见光谱显示最大吸收峰发生了蓝移(F 左)。对这两种物质进行照射后,归一化发射光谱显示出一种低色移(从 486 纳米到 428 纳米),表明形成了一种新的物质,这与之前公布的其他基于氰基的光催化剂的结果类似(F 右)。为了验证这种新物种确实是自由基阴离子 CF3-4-CzIPN--,作者进行了电子顺磁共振(EPR)光谱分析(E)。CF3-4-CzIPN--的实验和模拟 EPR 光谱结果一致,支持这种还原型光催化中间体的形成。
为了获得 PC--还原 HAT 试剂 A 的能力的直接证据,作者进行了 1H NMR 实验。光催化剂和 DIPEA 的混合物检测到了 CF3-4-CzIPN 的特征 NMR 信号(G,步骤 1)。将 NMR 管中的溶液直接暴露在 450 纳米的蓝色 LED 灯下 5 分钟后(G,步骤 2),线变宽和信号显著降低,这很可能是由于产生了顺磁性 CF3-4-CzIPN 物种,由于存在一个未配对电子,该物种对 NMR 共振弛豫速率有很大影响。在氮气环境下,这种物质至少能稳定存在 2 小时,将核磁共振管暴露在空气中可将其淬灭,从而将光催化剂转换回基态。在无光条件下,向自由基阴离子物种添加 HAT 试剂 A 时,也能观察到类似的淬灭效果。作者观察到与基态 CF3-4-CzIPN 光催化剂重整一致的核磁共振信号(G,步骤 3)。此外,当向 CF3-4-CzIPN 的 EPR 样品中加入 HAT 试剂 A 时,观察到信号消失,这表明顺磁自由基阴离子物种不再存在,即自由基阴离子 CF3-4-CzIPN- 还原了 HAT 试剂,促使其裂解成具有活性的酰胺基自由基物种,然后再参与 HAT。
虽然所述核磁共振实验表明基态PC--正在还原 HAT 试剂,但在标准反应条件(包括持续照射蓝色 LED)下,作者并不一定能排除连续光诱导电子转移(ConPET)过程,即光触媒基阴离子被第二个光子激发,生成激发态基阴离子 *CF3-4-CzIPN--。
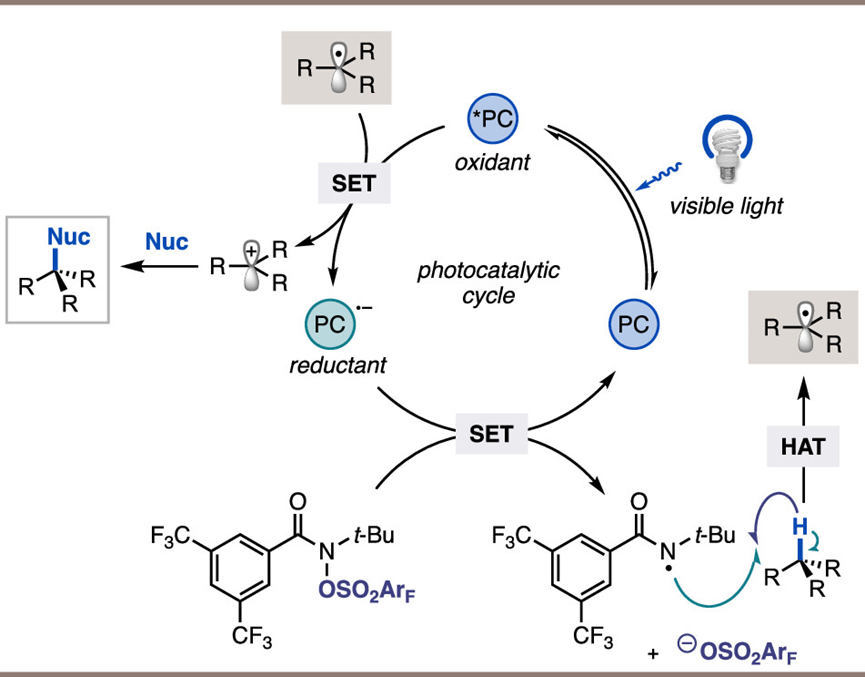
综合来看,反应机理如下图所示。该反应由 *CF3-4-CzIPN 的非循环还原淬灭引发,生成其基态自由基阴离子,随后还原HAT 试剂,接着发生裂解,生成活性酰胺自由基物种。另外,在标准反应条件下,作者观察到 HAT 试剂副产物的形成极少(∼2%),这表明 N-O 键发生了均裂,它也可能在 C-H 底物发生 HAT 时启动催化循环。目前正在进行实验以区分这两种可能性。在催化循环的后续过程中,激发态光催化剂会氧化苄基自由基中间体,从而将循环转向 PC--并产生一个碳正离子。最后,该碳正离子被亲核物捕获,生成所需的产物。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





