光诱导脱氮烷基化/双烷基化实现从烯基叠氮模块化合成α-叔碳伯胺及大位阻无保护1,2-氨基醇
近日,南方科技大学舒伟教授课题组和英国伯明翰大学Paul W. Davies课题组针对α-叔碳伯胺在有机合成上的挑战,首次实现了以烯基叠氮为烷基伯胺前体,在光氧化还原条件下的α-叔碳伯胺高效模块化合成。该策略还可以实现大位阻无保护1,2-氨基醇的一步合成。该方法具有广泛的底物普适性,可用于复杂天然产物分子及生物活性分子的后期修饰。
背景介绍
具有α-叔碳中心的伯胺是普遍存在于天然产物、药物分子、农用化学品和材料领域中的关键结构。例如用于治疗偏头痛和神经性疼痛TRPM8抑制剂,用于治疗心血管疾病的CETP抑制剂以及神经肽Y受体拮抗剂等均含有α-叔碳伯胺结构片段(图1)。因此,高效且模块化的合成此类化合物对生物医药领域的发展具有重要意义。
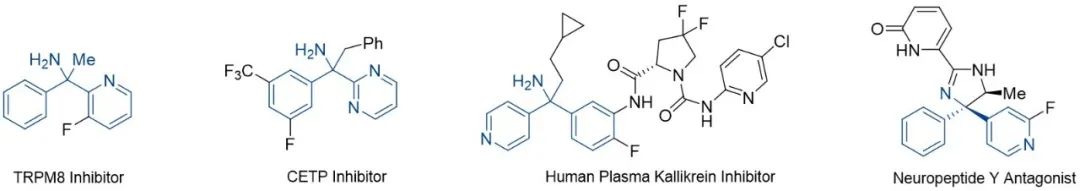
图1. 含有α-叔碳中心伯胺结构的生物活性分子
合成此类分子的传统方法依赖于将化学计量的碳亲核试剂加成到活化的亚胺上,然后再脱保护得到。近年来,通过可见光介导的单电子氧化还原催化实现在温和条件下合成此类骨架分子取得了实质性进展。已知的α-叔碳伯胺合成方法大多通过对胺的α-氢原子转移 (HAT) 或亚胺的单电子还原产生一个共同的α-伯氨基烷基自由基中间体。然而,现有的方法主要集中在氮的α位引入单一取代基,并且烷基上的官能团多样性有限。因此,如何从简单易得的原料出发,直接合成结构多样的α-叔碳伯胺具有很大挑战性和广阔的应用前景。
本文亮点
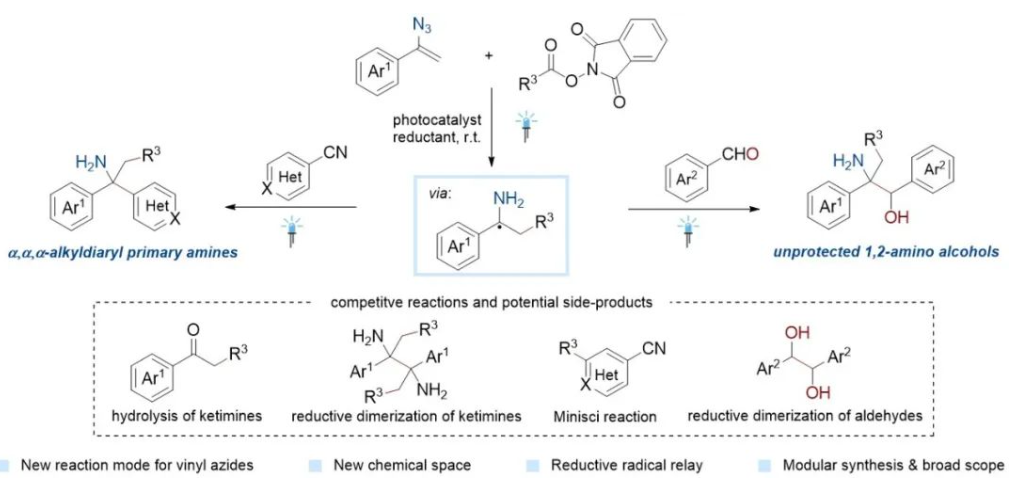
基于上述背景,南方科技大学舒伟教授课题组和英国伯明翰大学Paul W. Davies课题组合作发展了一种利用烯基叠氮作为伯胺前体与烷基羧酸氧化还原活性酯、氰基吡啶或芳基醛在光氧化还原条件下实现了α-叔碳伯胺及大位阻无保护1,2-氨基醇的模块化合成。其中,烯基叠氮首次作为烷基伯胺的前体。
此方法在光催化剂PC-1,还原剂汉斯酯HE-1及DMSO为溶剂条件下,烷基羧酸氧化还原活性酯(1)与烯基叠氮(2)、氰基吡啶(3)反应,以普遍优良收率得到α-叔碳伯胺 (4-7)。该反应兼容一级、二级和三级烷基自由基以及多种取代模式的芳基、杂芳基和官能团。同时,该方法可以放大规模至克级反应,也适用于对复杂天然产物分子的后期修饰(图2)。
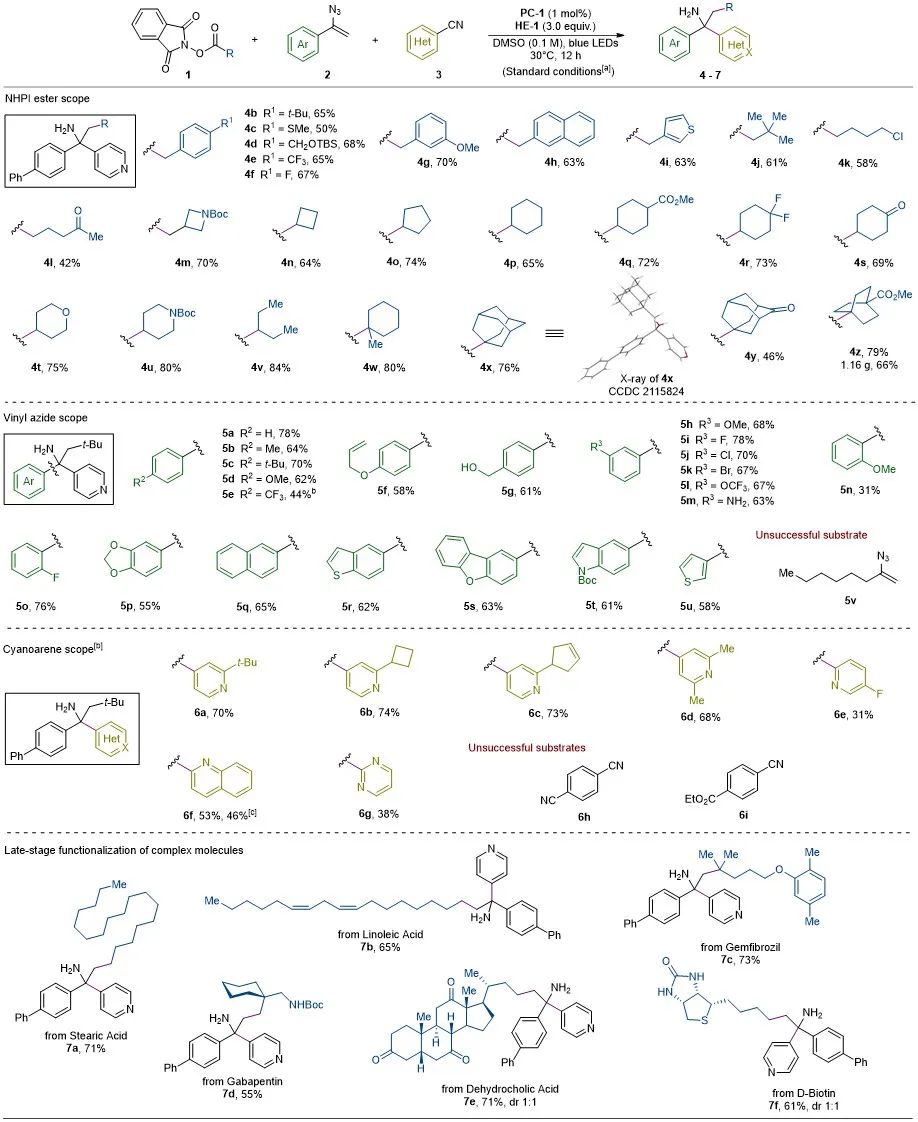
图2. 底物普适性研究
随后,作者将氰基吡啶替换为芳基醛(8),并在有机光催化剂DPZ的催化作用下,以高产率得到一系列大位阻无保护1,2-氨基醇(9)。该反应具有良好的官能团兼容性(图3)。
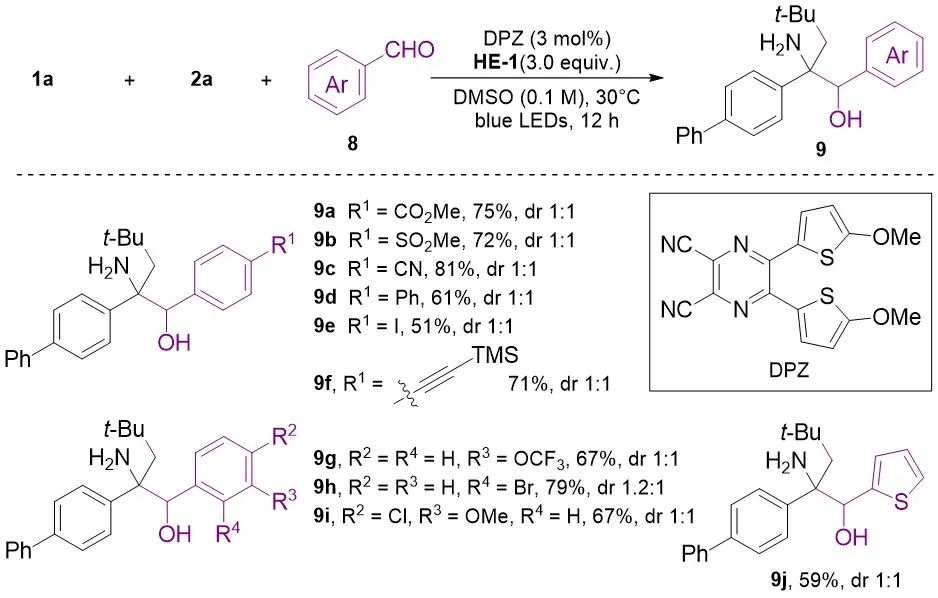
图3. 芳基醛底物适用范围研究
进一步,作者对产物的衍生化进行了研究(图4)。通过此方法合成的一系列2-溴取代的γ-芳胺10在钯催化下实现了分子内C-N键偶联,以高产率得到2,2-二芳基-1,2,3,4-四氢喹啉11。同时,将氧化还原活性酯替换为Togni试剂12a或二苯基碘鎓盐12c可以实现三氟甲基或芳基的引入,得到相应的α-叔碳伯胺。
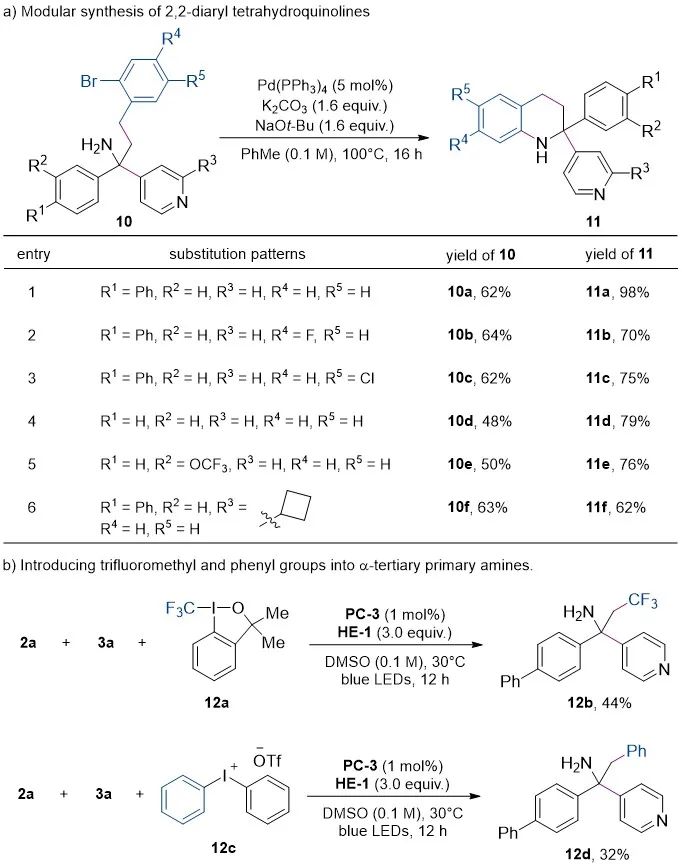
图4. 拓展反应
之后,作者通过自由基捕捉实验、控制实验、荧光淬灭实验以及量子产率测量等多种机理实验对反应的可能机理进行了初步探究(图5)。根据机理实验结果和文献报道,作者提出了一条可能的反应途径(图6):首先,1a在光敏剂作用下或1a和HE-1直接形成电子供体-受体络合物在光照条件下产生烷基自由基Int-I。该自由基与烯基叠氮2发生自由基加成引发脱氮气产生亚胺自由基Int-II并发生氢转移生成亚胺Int-III。随后,亚胺连续质子化(Int-IV)并被单电子还原产生α-伯氨基烷基自由基Int-V。与此同时,芳基负离子自由基Int-VI可由光敏剂单电子氧化还原或激发态汉斯酯*HE-1直接还原产生。Int-V与Int-VI发生自由基-自由基偶联并脱去一分子氰化氢得到目标产物。
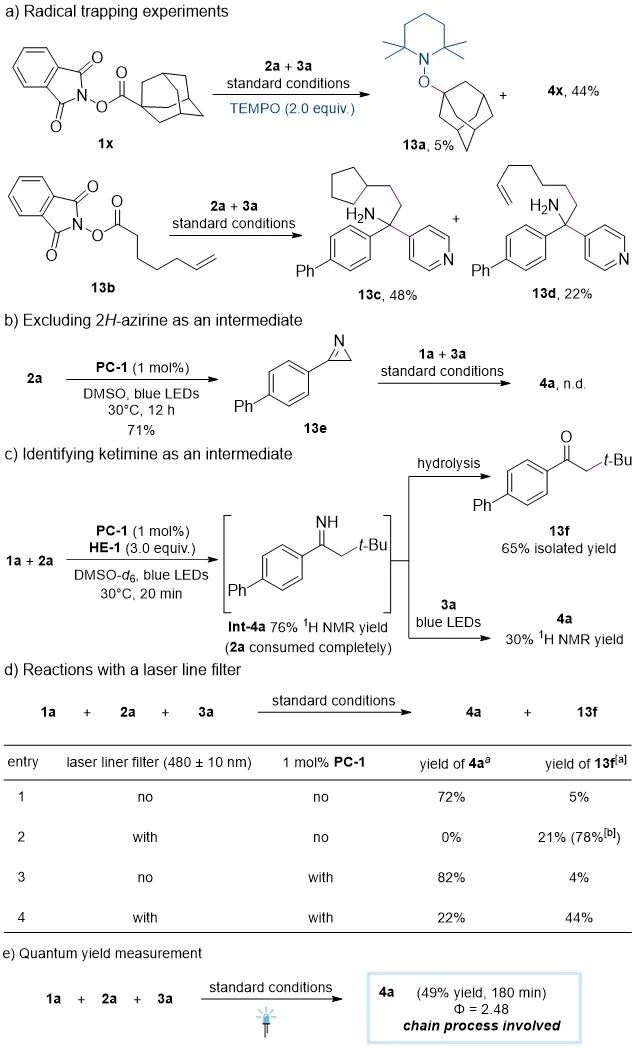
图5. 机理实验研究
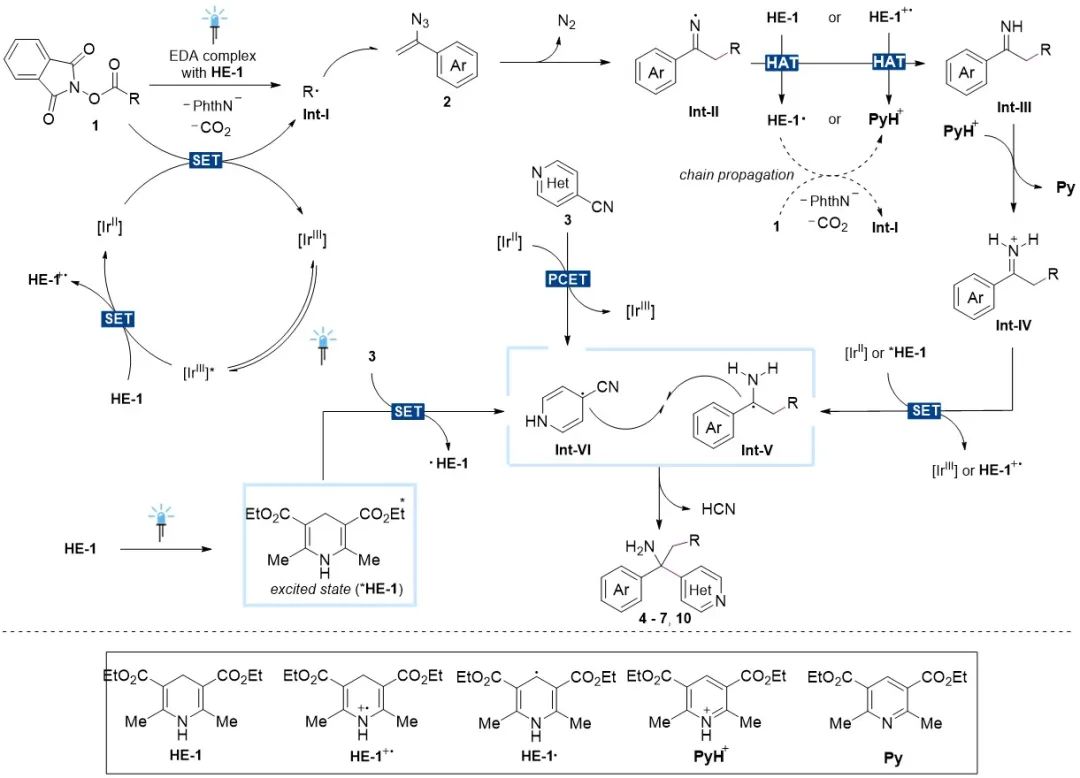
图6. 可能的反应机理
总结与展望
综上所述,本文创造性使用烯基叠氮作为伯胺前体,在光催化条件下与烷基羧酸氧化还原活性酯、氰基吡啶或芳基醛在光氧化还原条件下实现了α-叔碳伯胺和大位阻无保护1,2-氨基醇的模块化合成。机理研究表明反应存在两个平行的光催化自由基级联反应来实现烯基叠氮化合物的高效1,2-双官能团化。
文章详情:
Synthesis of Unprotected α-Tertiary Amines and 1,2-Amino Alcohols from Vinyl Azides by Light Induced Denitrogenative Alkylarylation/Dialkylation
Sifan Li, Hai-Wu Du, Paul W. Davies* and Wei Shu*
Cite this by DOI:
10.31635/ccschem.023.202302999
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




