台州学院马永敏/潘振涛团队 | 光催化C(sp²)–OMe键的断裂及酰胺化反应

研究背景
芳香 C–O 键是广泛存在于天然产物、药物、农用化学品和功能分子中的重要结构单元,许多含有 C(sp2)–O 键的化合物(如芳醚、酯和磺酸盐)都已实现了工业规模的生产。通过芳香族 C–O 键断裂的合成转化,不仅可作为活性芳香卤化物的替代方法,而且作为含 C(sp2)–O 键功能分子的直接转化和快速衍生化的新策略,在过去的几十年里吸引了大量有机化学家们的关注。其中,如何实现较高键能的 C(sp2)–OMe 键的断裂及官能团化反应,是一个极具研究意义和挑战性的课题。
研究内容
近日,台州学院马永敏教授/潘振涛博士团队开发了一种光催化苯甲醚类化合物 C(sp2)–OMe 键断裂及酰胺化反应(Scheme 1)。该方法使用 4CzIPN 作为光催化剂,N-羟基邻苯二甲酰亚胺和邻苯二甲酰亚胺类化合物作为偶联试剂,无需使用金属催化剂,在温和条件下即可实现惰性 C(sp2)–OMe 键的高效断裂,为常规的镍催化方法提供了一种极具吸引力的替代策略。
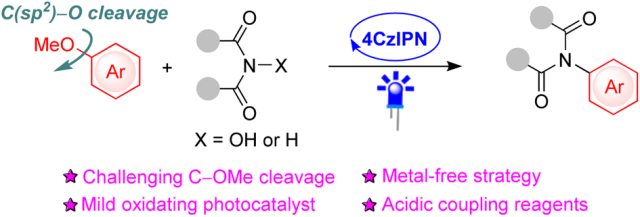
Scheme 1 The cleavage of the inert C(sp2)–OMe bond was developed under a metal-free photocatalytic strategy using 4CzIPN as a mild oxidizing photoredox catalyst.
作者首先通过条件筛选,分别确定了苯甲醚类化合物与 N-羟基邻苯二甲酰亚胺和邻苯二甲酰亚胺类化合物的较佳反应条件。随后进行了底物适用性考察,对于苯甲醚类化合物与 N-羟基邻苯二甲酰亚胺类化合物的酰胺化反应(Table 1),结果显示苯甲醚类底物的吸供电子效应对于反应收率的影响较大:供电子基团的反应收率(67%–82%)要高于吸电子基团(35%–58%)。值得注意的是,即使底物中存在活性更高的 C–O 键(如 C(sp2)−OBn, 1h 和 C(sp2)−OTf, 1j),该反应体系仍能实现对 C(sp2)–OMe 键的高选择性断裂。然而遗憾的是,当使用间位和邻位取代的苯甲醚类底物(1n–1q)时,只获得较低收率(11%–27%)的目标化合物,同时得到收率较可观(35%–54%)的 C4−H 酰胺化副产物。
Table 1 Substrate scope of photocatalytic C(sp2)–OMe bond cleavage and amidation of anisoles with N-hydroxyphthalimides.a
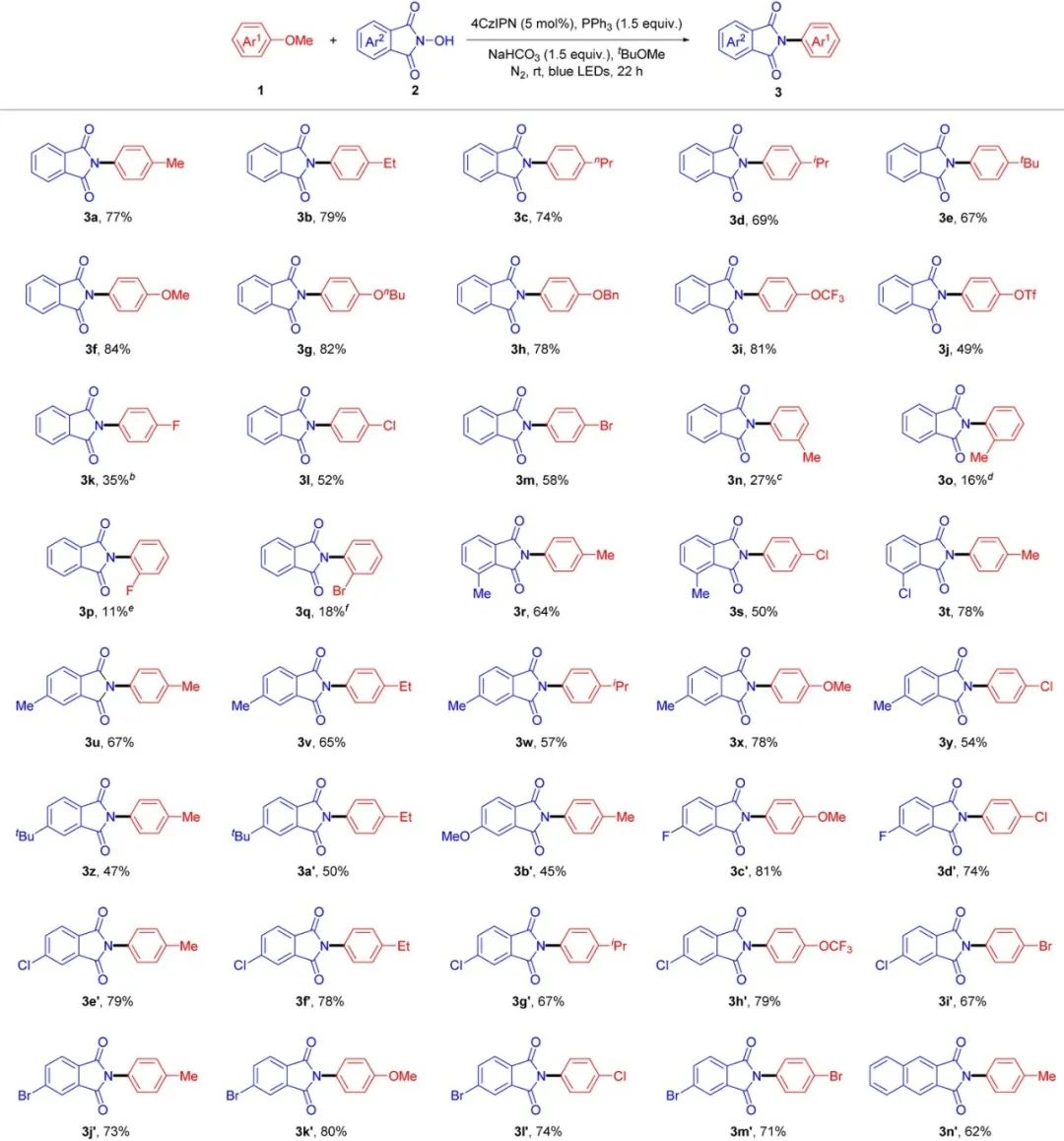
aReaction conditions: 1 (2 mmol), 2 (0.2 mmol), 4CzIPN (5 mol%), PPh3 (1.5 equiv.), NaHCO3 (1.5 equiv.), tBuOMe (0.2 M), 18 W blue LEDs, N2, rt, 22 h. Isolated yields. bAlong with defluorinative amidation product in 21% yield. cAlong with C–H amidation product in 46% yield. dAlong with C4–H amidation product in 54% yield. eAlong with C4–H amidation product in 42% yield. fAlong with C4–H amidation product in 35% yield.
另一方面,对于苯甲醚类化合物与邻苯二甲酰亚胺类化合物的酰胺化反应(Table 2),对于含供电子基团的苯甲醚类底物能获得中等收率的产物 3a−3f,而含吸电子基团的苯甲醚类底物则无法顺利得到目标产物。只有当使用更强氧化性的 [Acr-Mes-Me]ClO4 作为光催化剂时,才能得到一定收率的产物 3k 和 3l;相反的,对于苯甲醚类底物1a−1f,过强的氧化性的光催化剂则会显著降低产物收率。对于该实验结果,作者推测光催化剂与苯甲醚类底物之间的氧化电位匹配程度对于反应的顺利进行至关重要。比如,当使用氧化电位略高于 4-甲氧基苯甲醚(1f)(Ep/2 = 1.30 V vs. SCE)的 4CzIPN(E*red = 1.35 V vs. SCE)作为光催化剂时,产物收率可达 68%;而当使用氧化电位远高于 1f 的 [Acr-Mes-Me]ClO4(E*red = 2.06 V vs. SCE)时,产物收率则大幅降至 13%。此外,光催化剂的氧化电位高于底物对于可见光促进的单电子氧化过程是必要的,因此对于具有较高氧化电位的4-氟苯甲醚(1k),只有使用强氧化性的 [Acr-Mes-Me]ClO4 才能促进反应顺利进行。
Table 2 Substrate scope of photocatalytic C(sp2)–OMe bond cleavage and amidation of anisoles with phthalimides.a
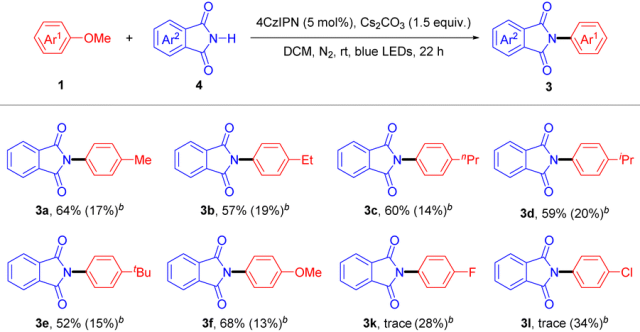
aReaction conditions: 1 (2 mmol), 4 (0.2 mmol), 4CzIPN (5 mol%), Cs2CO3 (1.5 equiv.), DCM (0.2 M), 18 W blue LEDs, N2, rt, 22 h. Isolated yields. b[Acr-Mes-Me]ClO4 was used as photocatalyst.
为了更好地理解反应机理,作者往反应体系中加入了自由基捕获剂 TEMPO(Scheme 2A),实验结果显示,5 当量 TEMPO 的加入对于 4-甲基苯甲醚与 N-羟基邻苯二甲酰亚胺和邻苯二甲酰亚胺两个反应均有着显著的抑制作用,但前者能通过高分辨质谱捕获到 N-中心的邻苯二甲酰亚胺自由基,而后者则未能捕获。据此作者推测了两种可能的反应机理(Scheme 2B),对于 N-羟基邻苯二甲酰亚胺类偶联试剂(路径A),首先被光激发的光催化剂对 NHPI(2a)和 PPh3 发生质子耦合电子转移(PCET)得到 PINO 自由基 I 和 Ph3PH+;随后 I 再与 PPh3 发生自由基加成,得到的 II 进一步发生 β-断裂得到 PhthN˙ 自由基;紧接着 PhthN˙ 加成到 4-甲基苯甲醚中含甲氧基的碳上,得到的关键中间体 III 最后发生单电子还原以及质子化作用最终得到目标产物 3a。另一方面,对于邻苯二甲酰亚胺类偶联试剂(路径B),激发态的光催化剂先对 4-甲基苯甲醚进行单电子氧化得到芳烃自由基阳离子IV,同时 4a 在碱的作用下得到 PhthN− 并进攻 IV 得到关键中间体 III,最终发生路径A中的后续过程得到 3a。
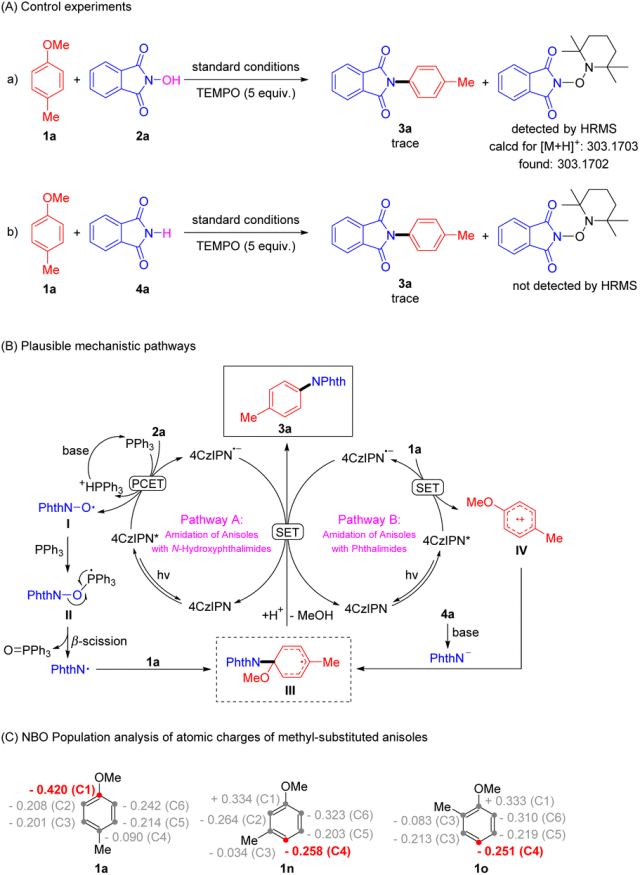
Scheme 2 Mechanistic studies.
在进行底物适用性考察时,作者发现对于间位和邻位取代的苯甲醚类底物,C4−H 比 C−O 位点更易发生酰胺化反应,为了更好地了解苯甲醚的结构特征对于酰胺化区域选择性的影响,作者使用了高斯软件对不同取代基位置苯甲醚中的原子电荷进行了 NBO 布局分析(Scheme 2C),计算结果显示 4-甲基苯甲醚(1a)中的 C1 电荷(−0.420e)负值最大;相反的,3-甲基苯甲醚(1n)和 2-甲基苯甲醚(1o)中的 C1 电荷(+0.334e 和 +0.333e)为正值,而 C4 电荷(−0.258e 和 −0.251e)为负值。因此,1a 的 C1、1n 和 1o 的 C4 位点更易被亲电性的自由基 PhthN˙ 进攻,得到相应的酰胺化产物。
总结展望
综上,作者开发了一种 4CzIPN 促进的光催化 C(sp2)–OMe 键断裂策略,使用 N-羟基邻苯二甲酰亚胺和邻苯二甲酰亚胺类偶联试剂,以中等至较高收率得到一系列 N-芳香邻苯二甲酰亚胺类化合物。
论文信息
Photocatalytic C(sp2)–OMe bond cleavage and amidation of anisoles with N-hydroxyphthalimides and phthalimides
Zhentao Pan, Maier Wu, Jingxi Fang, Aiguo Zhong, Huajiang Jiang, Guan Wang, Jingjing Guo and Yongmin Ma
Org. Chem. Front., 2023, Advance Article





