文献精读:光催化析氧和抗菌仿生修复膜通过HIF1-α途径修复糖尿病创面
首先,将仿生修复膜放入水中。近红外光照射30 min后,使用便携式溶解氧检测仪检测水中溶解氧。测试前用蒸馏水清洗电极,仪表表盘上的读数是溶解氧浓度
Ⅰ型胶原是构成正常成人皮肤的主体(占80%),主要存在于成人皮肤、 肌腱、骨组织。Ⅰ型胶原粗大,在体内构成有横纹的粗径原纤维,是瘢痕组织纤维化的物质基础。在伤口愈合中,若Ⅰ型胶原大量出现,将导致瘢痕结构完全有别于正常的皮肤组织,质地坚硬而没有弹性。胶原蛋白主要由成纤维细胞合成,但成人自身真皮的成纤维细胞只能合成 I 型胶原,这也是人在成长过程中,Ⅲ型胶原占比下降而Ⅰ型胶原占比不断提升的原因。
Ⅲ型胶原则是胎儿和婴儿皮肤的主要胶原蛋白(占60%),主要存在于婴儿皮肤或血管内膜、肠道。Ⅲ型胶原是皮肤中网状纤维的主要组成部分,含量越高纤维束越细,用于支撑皮肤柔嫩度,使皮肤细腻和富有弹性。Ⅲ型胶原含量越高,越能使皮肤细腻柔嫩。在创伤修复中,若Ⅲ型胶原蛋白比例高,则皮肤组织细腻柔滑。III型胶原蛋白可以更好地让伤口恢复,不容易留疤痕
在96孔培养板中加100 μL培养基,接种10 μL菌液,37℃孵育36 h,吸出培养基,每孔用200 μL无菌PBS缓冲液冲洗3次,加100 μL甲醇固定15 min后,将甲醇从培养孔中吸出,自然风干;加入100 μL结晶紫溶液,室温染色5 min。从培养孔中吸出结晶紫染料溶液后,在37℃的烤箱中干燥。充分干燥后,每孔加入100 μL 13%冰醋酸溶液,结晶紫在37 ℃的培养箱中溶解30 min。最后用酶标记仪测定OD值或用荧光显微镜拍照
糖尿病伤口局部血管缺乏,缺损区域产生严重缺氧是创面难以愈合的重要原因。华中科技大学同济医学院协和医院的郭晓东教授、中山大学化学学院、材料科学与工程学院PCFM实验室的全大萍教授与长江大学第一附属医院的Jialin Yu(通讯作者)课题组构建了一种光催化析氧抗菌仿生修复膜(PMP@GFs)用于解决伤口修复问题。通过扫描电镜和透射电镜对PMP@GFs进行表征。用氧传感器测试PMP@GFs的析氧性能。PMP@GFs与金黄色葡萄球菌和大肠杆菌共培养验证PMP@GFs具有良好的抗菌性能。PMP@GFs与成纤维细胞体外共培养,胶原蛋白和HIF1-α的表达明显增加,血管和神经的线粒体活性明显增强。体内实验表明仿生修复膜治疗糖尿病创面的愈合时间明显缩短,胶原蛋白和析氧性能明显增加,血管再生增强。综上所述,PMP@GFs具有优异的光催化析氧和抗菌性能,能显著促进糖尿病创面的修复。
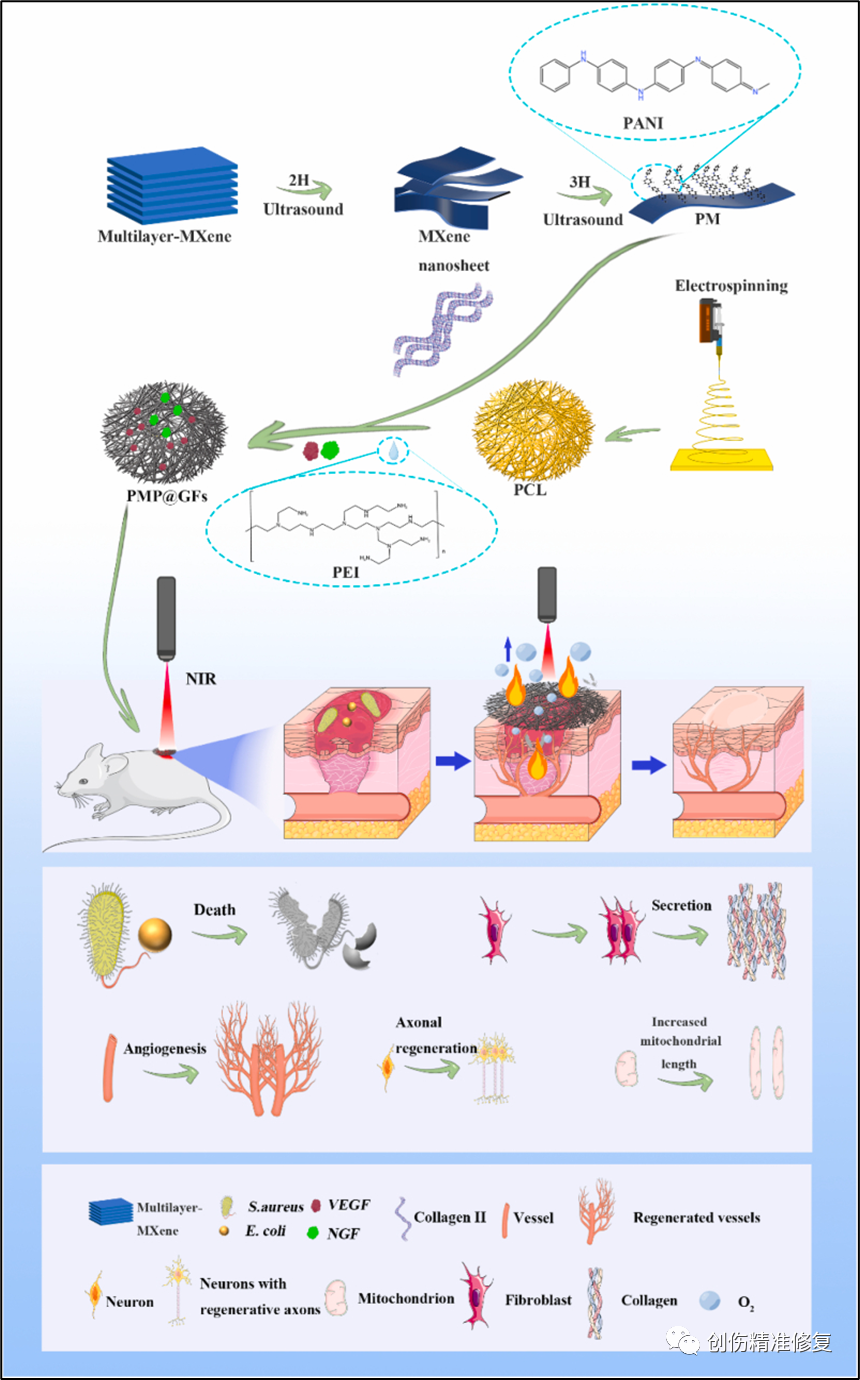
构建仿生膜的第一步是通过静电纺丝法制备聚己内酯(PCL)膜。然后通过胶原II将MXene@PANI(一种还原剂与聚苯胺的结合)加载到PCL膜上。用PEI(聚乙烯亚胺)将NGF(神经生长因子)和VEGF(血管内皮生长因子)负载在仿生膜上形成多功能光催化仿生修复膜(PMP@GFs)。MXene(还原剂)提供光热抗菌效果;PANI(聚苯胺)在近红外光下与MXene一起产生氧气。VEGF和NGF的释放可以协同促进创面的神经和血管再生,生成的血管可以满足组织的持续供氧。
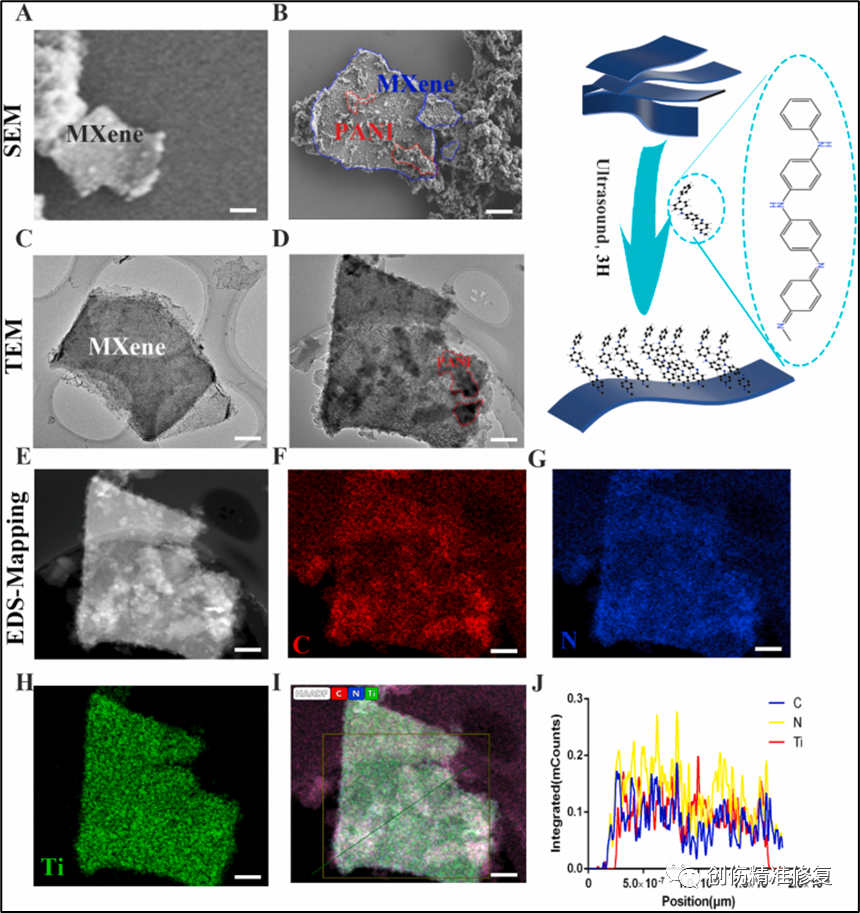
(A、B) MXene与MXene@PANI的扫描电镜图,PANI与几层MXene成功结合。(C、D)MXene与MXene@PANI的透射电镜图,PANI被负载在单层MXene上。(E-I) MXene@PANI的EDS-Mapping图显示C/N/Ti元素。(J) MXene@PANI中的C/N/Ti元素含量。以上结果证实成功合成了MXene@PANI。
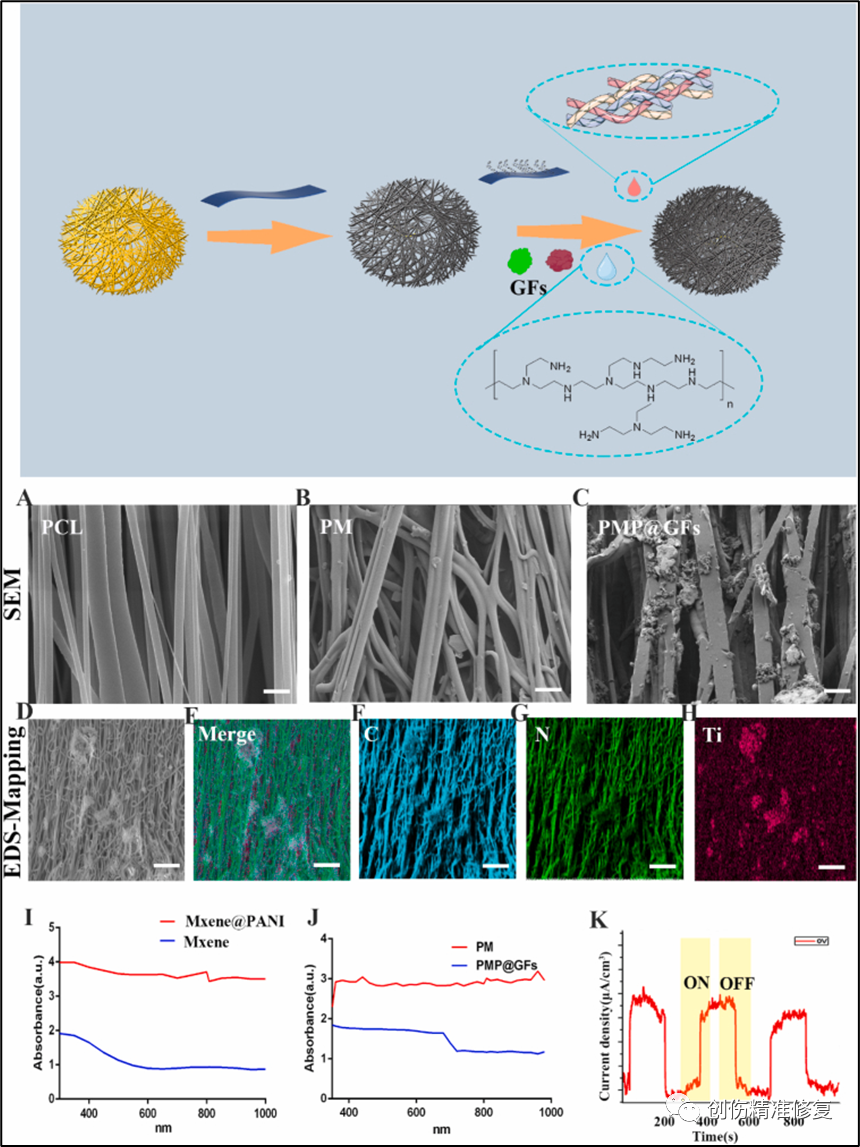
(A-C)PCL/PM/PMP@GFs的扫描电镜。A为PCL电纺丝膜、B为PCL电纺丝膜装载少量层MXene (PM)、C为加载MXene@PANIVEGF和NGF的电纺丝膜(PMP@GFs)。(D-H)PMP@GFs的EDS-Mapping图谱,成功合成PMP@GFs。(I)MXene与MXene@PANI的吸收光谱,MXene@PANI的吸收光谱在近红外波段增加。(J)PM与PMP@GFs的吸收光谱,PMP@GFs在近红外光下的吸收光谱明显增加。(K) MXene@PANI的光电效应,表明MXene@PANI在近红外光区能够吸收更多的光子,然后利用光电效应产生光电电流。以上结果表明成功合成了PMP@GFs。
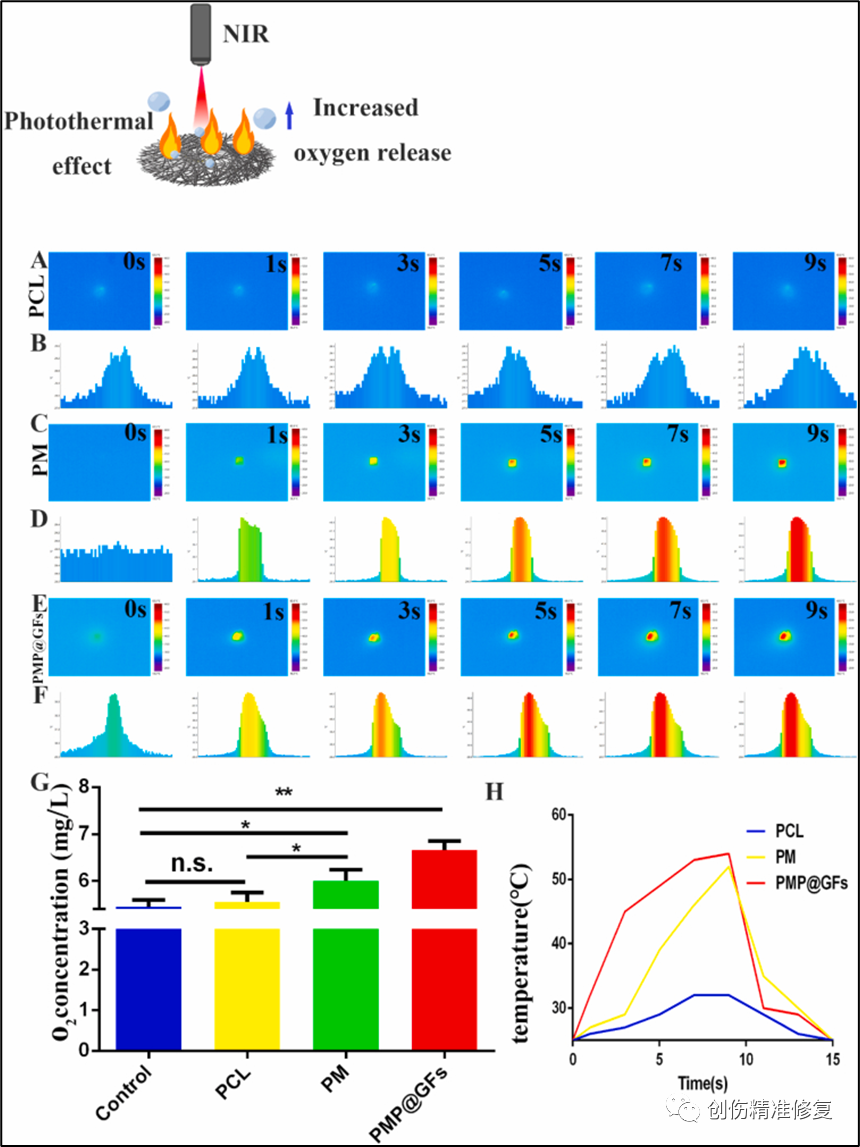
(A-F、H)PCL/PM/PMP@GFs的光热效应、截面温度统计与光热循环。测试PMP@GFs仿生膜的光热效应。在9 s内温度达到52 ℃,而PCL组的温度约为30 ℃,在6 s内还原至初始温度。(G)对PCL/PM/ PMP@GFs进行析氧实验,产氧量可以达到6.6 mg/L。
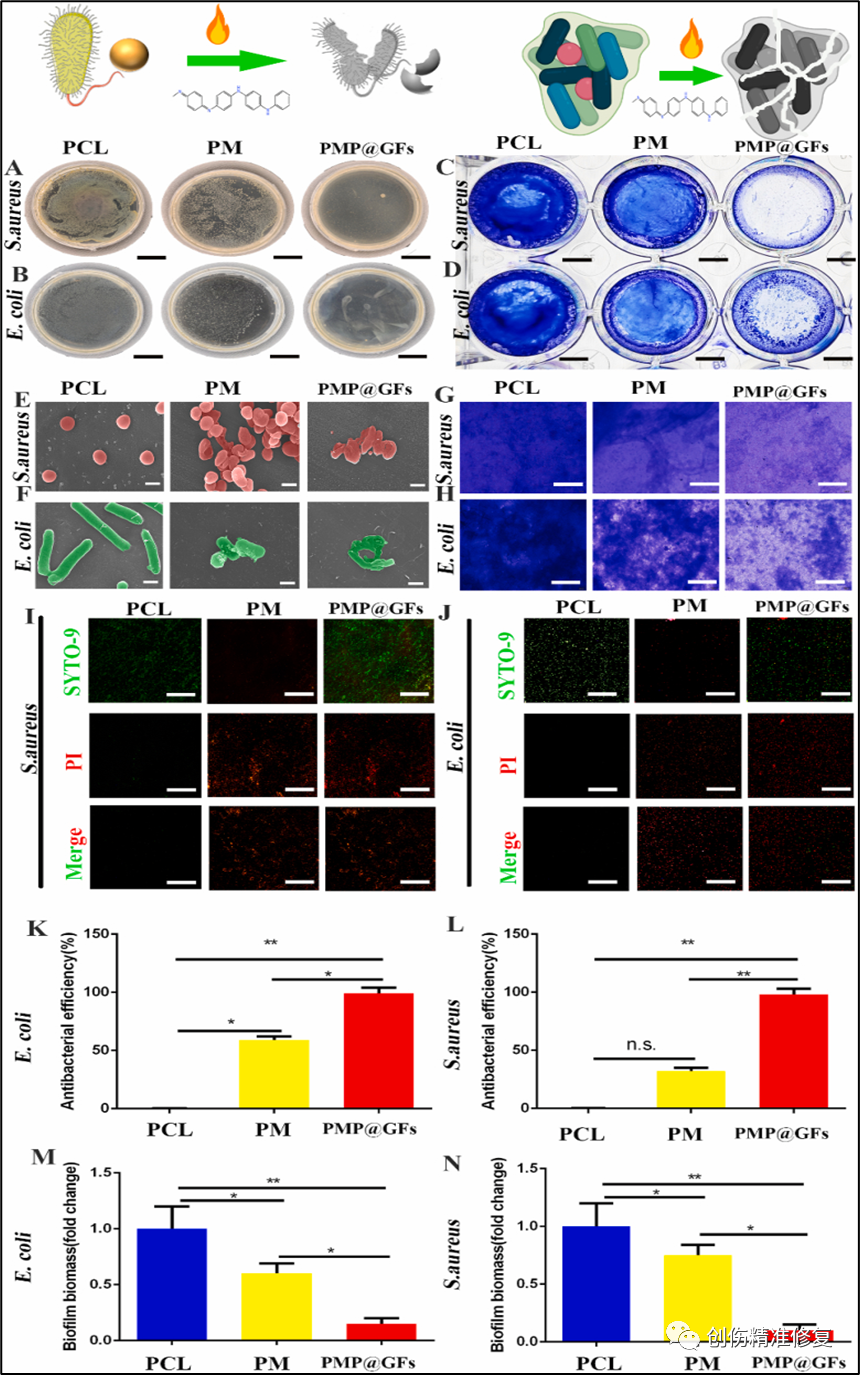
(A、B、K、L)对PMP@GFs的抗菌性能进行测试。用PMP@GFs共同培养金黄色葡萄球菌和大肠杆菌,PMP@GFs对金黄色葡萄球菌的杀伤效率达到95%。PMP@GFs对大肠杆菌的杀伤效率达到98%。(C、D)PMP@GFs的抗金黄色葡萄球菌与抗大肠杆菌效果。(G、H)金黄色葡萄球菌与大肠杆菌生物膜光镜图。(M、N)对PMP@GFs的抗菌生物膜性能进行测试,PMP@GFs减少到PCL组的0.17倍。PMP@GFs仿生细菌膜生物膜的形成减少到PCL组的0.15倍。(E、F)观察PMP@GFs培养金黄色葡萄球菌与大肠杆菌的变化。用扫描电子显微镜监测培养的细菌,金黄色葡萄球菌表面破损,PM仿生膜组中金黄色葡萄球菌的性状表面有特异性的凹陷。在PMP@GFs中大肠杆菌的结构被破坏,在PM中有一定的损伤。(I、J)检测细菌的活/死染色,与PCL组相比,PMP@GFs组死菌较多。
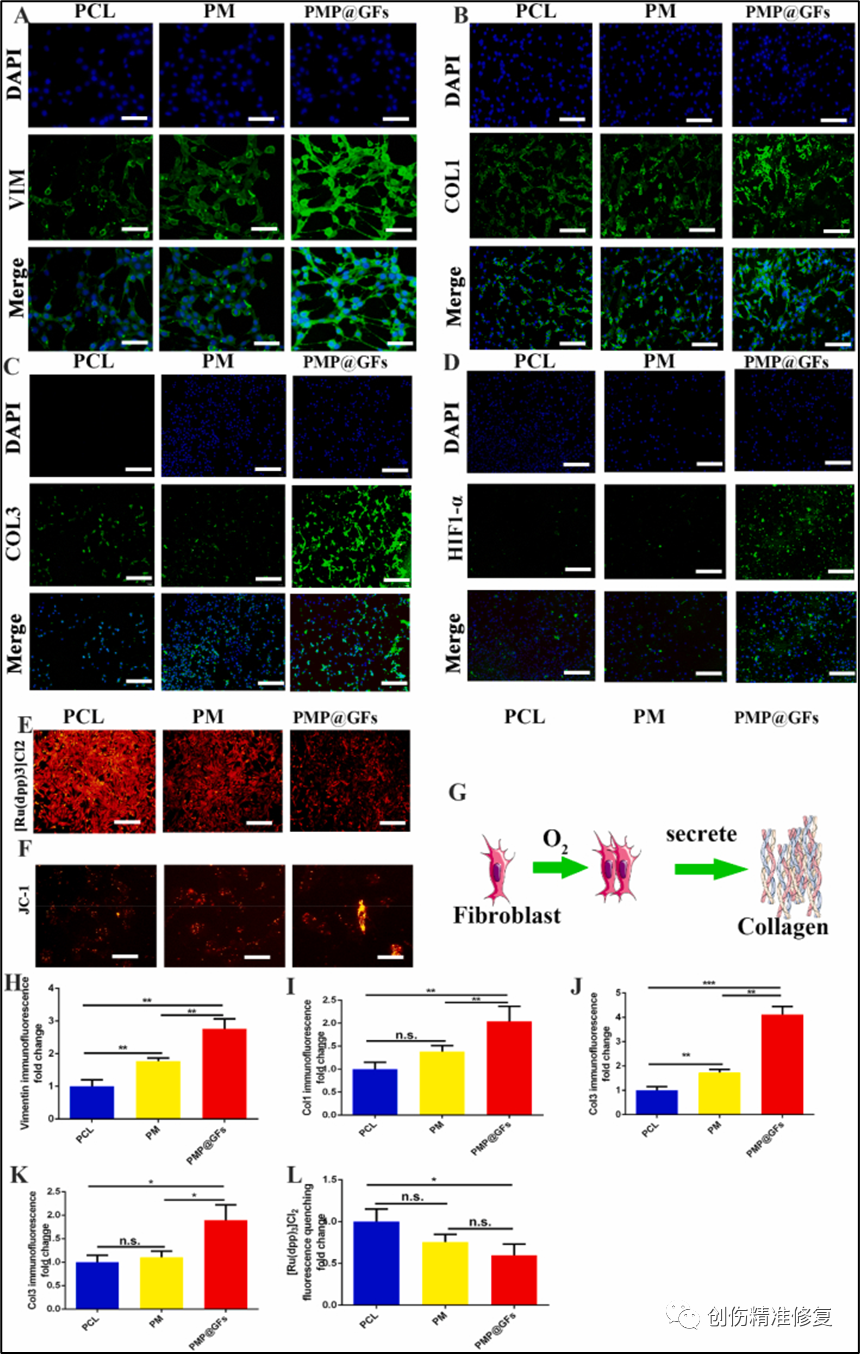
成纤维细胞是真皮的原代细胞,在皮肤创面愈合过程中起着至关重要的作用。(A、H)成纤维细胞标记物Vimentin的免疫荧光染色,将仿生膜与成纤维细胞共培养,统计结果图表示PMP@GFs组是PCL组的2.76倍。(B、I)PMP@GFs组I型胶原的表达量是PCL组的2.03倍。(C、J)对于III型胶原的加入,PMP@GFs组是PCL组的4.11倍。(D、K)成纤维细胞HIF1-α表达的检测,PMP@GFs组是PCL组的1.49倍。以上结果表明PMP@GFs仿生膜能够促进胶原I和胶原III的表达。(E、L)[Ru(DPP)3] Cl2遇氧猝灭,反映氧含量。PMP@GFs组的荧光强度是PCL组的0.59倍。(F)氧在有氧呼吸中起着至关重要的作用,而线粒体是必不可少的参与者,使用JC-1试剂盒检测线粒体膜电位。PMP@GFs的线粒体变长,这可能是导致成纤维细胞活性增强和胶原分泌增加的机制之一。
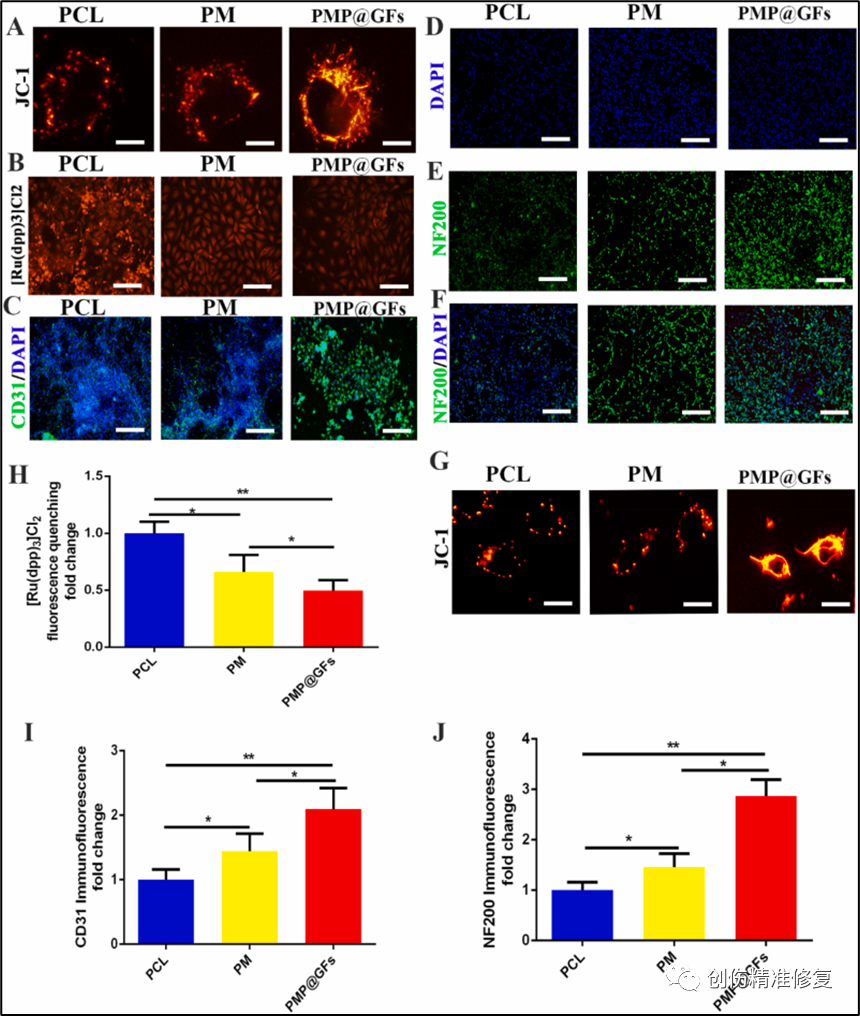
(A)将PMP@GFs与HUVECs共培养,检测细胞内的线粒体,发现PMP@GFs组细胞的线粒体明显增加,荧光强度也明显增加。(B、H)PMP@GFs组的荧光强度是PCL组的0.49倍。(C、I)PMP@GFs组CD31的表达量是PCL组的2.09倍。以上证实PMP@GFs仿生膜可以增强血管内皮细胞的活性。(D-F、J)神经再生在伤口修复过程中也很重要。将PMP@GFs与PC12细胞共培养。PMP@GFs仿生膜组的NF200染色明显增强,是PCL组的2.87倍。(G)检测细胞中的线粒体,PMP@GFs组细胞的线粒体明显增加,荧光强度也明显增加。以上表明PMP@GFs仿生膜在伤口修复过程中对神经和血管的调节具有重要作用。成纤维细胞和HUVEC的线粒体形态延长,其中PC12细胞的线粒体形态延长最为明显,PC12线粒体可能在促氧糖尿病创面愈合中发挥重要作用。
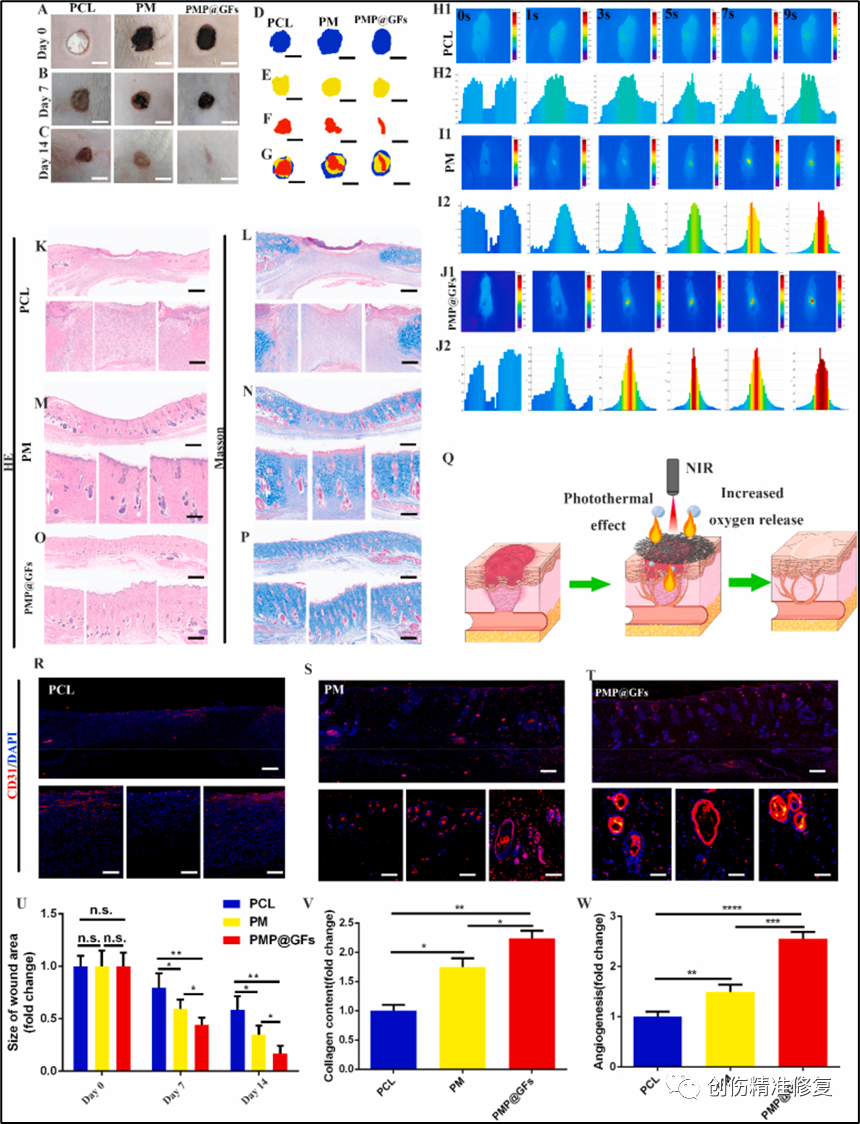
(A-G、U)将仿生膜植入糖尿病大鼠伤口部位。PMP@GFs组创面愈合效果在第14天最好。PMP@GFs组创面面积明显小于PCL组,为初始创面面积的0.17倍。(H-J)对PMP@GFs仿植入后的光热效应进行测试。植入PMP@GFs部位升温最快,在9 s内升至65 ℃。对照组在此过程中仅升温至32 ℃,PCL升温速度明显慢于PMP@GFs组。(K-P)对PMP@GFs修复后皮肤的HE和MASSON染色,PMP@GFs组可以改善创面,对皮肤真皮层和表皮有明显的修复作用。(V)PMP@GFs组胶原蛋白含量明显增加,是PCL组的2.30倍。(R-T、W)对创面血管内皮进行免疫荧光染色。PMP@GFs组显著促进血管的形成,是PCL组的2.55倍。以上实验表明PMP@GFs仿生膜在体内能够促进糖尿病伤口的修复和血管的再生。
光催化析氧和抗菌PMP@GFs在近红外照射下释放氧气,并利用光热效应清除创面中的细菌。在体外,光催化析氧和抗菌PMP@GFs能促进成纤维细胞、血管内皮细胞和神经细胞的活性。在体内,光催化析氧和抗菌PMP@GFs可以释放包括VEGF和NGF在内的生长因子,促进血管和神经的再生,最终达到糖尿病伤口修复的作用。光催化析氧和抗菌PMP@GFs为糖尿病伤口的修复提供了一种新的治疗方法。




