JACS:新双官能团化试剂,光一照,轻松合成脂肪族磺酰氟
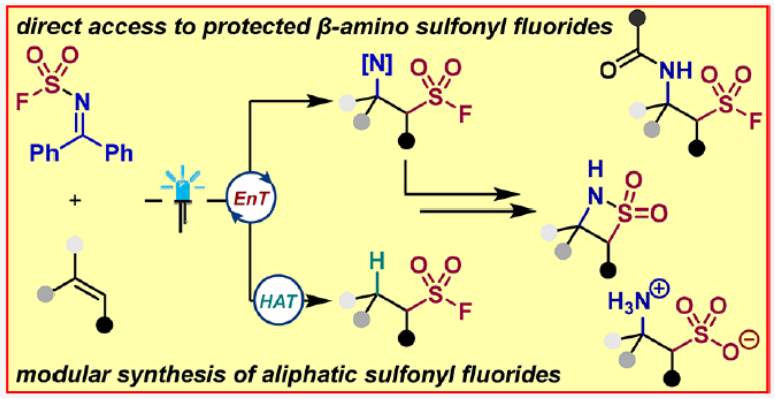
近日,德国明斯特大学(Universität Münster)Frank Glorius课题组发展了一种稳定的亚胺磺酰氟试剂,该试剂在可见光诱导下可发生均裂,从而作为双官能团化试剂与烯烃加成生成一系列保护的β-氨基磺酰氟化合物。值得注意的是,此方法为药物化学相关的多肽磺酰氟化合物的合成提供了强有力的策略,为从烯烃实现β-磺酸铵和β-磺内酰胺的合成提供了新的途径。机理研究表明,此转化涉及一个能量转移(EnT)介导过程。瞬态磺酰氟自由基与烯烃加成后,分别通过自由基-自由基偶联或氢原子转移(HAT)形成相应的产物。相关成果发表在J. Am. Chem. Soc.上,文章链接DOI:10.1021/jacs.2c11295。
(图片来源:J. Am. Chem. Soc.)
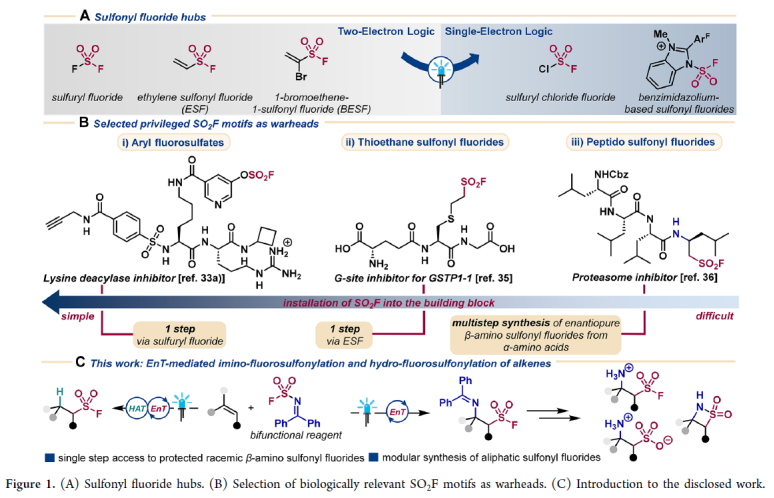
磺酰氟化合物由于其平衡的(水)稳定性和对反应蛋白位点的敏感性,使其能够起到诊断和抑制的作用(Figure 1B)。然而,通过经典的双电子方法引入SO2F的方法有限,因此(脂肪族)磺酰氟的合成并非易事。近些年,基于自由基的合成方法已经成为一种补充策略来实现磺酰氟化合物的合成(Figure 1A)。最近,德国明斯特大学Frank Glorius课题组合成了一种稳定的亚胺磺酰氟试剂,该试剂可在可见光诱导下发生均裂,从而与烯烃加成生成保护的β-氨基磺酰氟化合物。值得注意的是,此方法为实现药物化学相关的多肽磺酰氟化合物的合成提供了强有力的策略,为从烯烃实现β-磺酸铵和β-磺内酰胺的合成提供了新的途径(Figure 1C)。
(图片来源:J. Am. Chem. Soc.)
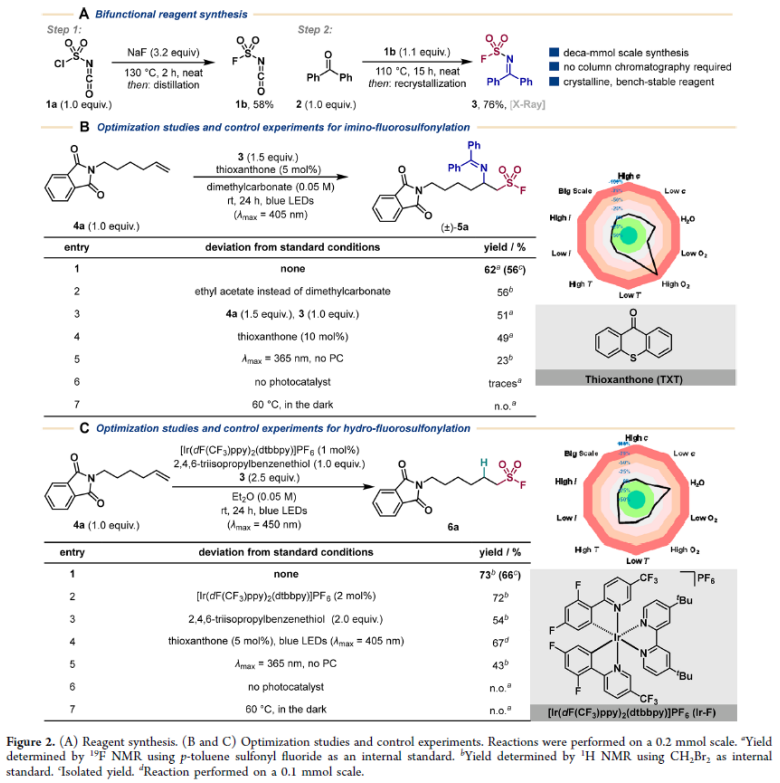
1974年,Clauß, Friedrich和Jensen报道了利用氟磺酰异氰酸酯1b与二苯甲酮来实现胺磺酰氟的合成。2021年,高兵, Sharpless, 董佳家等人报道了利用商业可得的氯磺酰异氰酸酯1a与NaF的卤交换过程实现氟磺酰异氰酸酯的合成。基于上述合成方法,作者对反应条件进行了优化,可以在不需要使用溶剂和柱层析分离的条件下以十克级规模实现了双官能团化试剂胺磺酰氟的合成(Figure 2A)。随后,作者利用非活化烯烃4a作为模板底物进行双官能团化反应。通过一系列反条件筛选,作者发现当使用4a (1.0 equiv), 3 (1.5 equiv), 5 mol% TXT (thioxanthone)作光催化剂,在DMC (dimethylcarbonate)(0.05 M)中,蓝光(λmax = 405 nm)照射下室温反应24小时可以以62%的产率实现亚胺-氟磺酰化产物5a的合成。当将反应放大至10倍规模时候产率仅有轻微的下降(Figure 2B)。接下来,作者变换反应体系,当使用4a (1.0 equiv), 3 (1.5 equiv), TripSH (2,4,6-triisopropylbenzenethiol)(1.0 equiv)作为氢源,[Ir(dF(CF3)ppy)2(dtbbpy)]PF6 (Ir−F)作光催化剂,在Et2O(0.05 M)中,蓝光(λmax = 405 nm)照射下室温反应24小时可以以73%的产率实现氢-氟磺酰化产物6a的合成(Figure 2C)。
(图片来源:J. Am. Chem. Soc.)
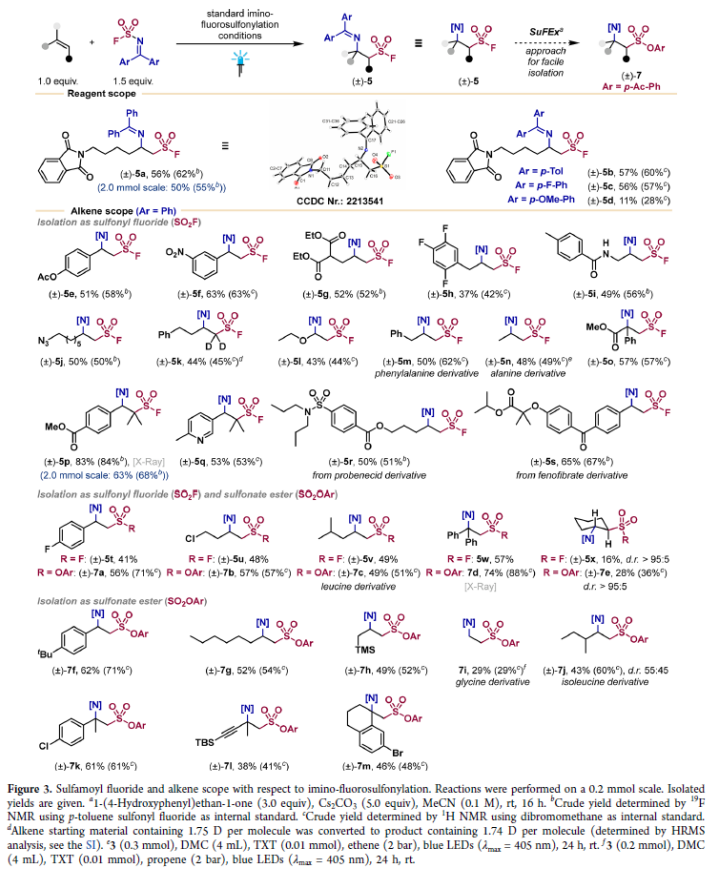
在得到了最优反应条件后,作者首先对亚胺-氟磺酰化反应的底物范围进行了探索(Figure 3)。不同取代的亚胺磺酰氟均可参与反应并实现转化(5a-5d, 11-57%)。但对甲氧基取代的双官能团化试剂产率较低(5d, 11%)。此外,不同取代的苯乙烯、1,1-二取代烯烃、三取代烯烃均可顺利参与反应,得到相应的亚胺-氟磺酰化产物5e-5x。值得注意的是,一系列生物活性分子如alanine(5n)、probenecid(5r)、fenofibrate(5s)等均可兼容。此外,作者在双官能团化反应后可以使用Ball课题组发展的SuFEx反应条件实现磺酸酯产物7a-7m的合成。
(图片来源:J. Am. Chem. Soc.)
接下来,作者对烯丙基醇的反应情况进行了探索(Figure 4)。实验结果表明在标准条件下其可以以45-57%的产率实现环化产物8a-8c的合成。而当使用4b反应时,除了螺环产物8c(49%)之外还以27%的产率观察到了未环化产物5y。
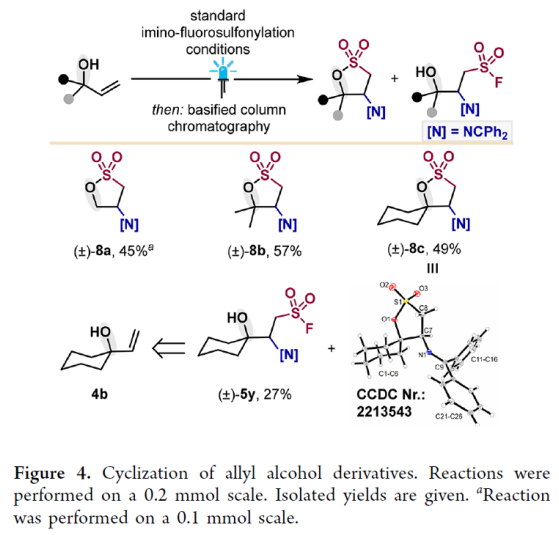
(图片来源:J. Am. Chem. Soc.)
此外,在SuFEx条件下,烯丙基氯衍生的β-亚氨基磺酰氟还可以一锅两步的经过S-O键的形成和关环过程生成刚性环丙基β-亚氨基磺酸酯产物7n(41%, d.r.>95:5)。而若烯丙基氯在经历亚氨-氟磺酰化过程后加入Cs2CO3,则可以以良好的非对映选择性得到环丙基β-亚氨基磺酰氟5aa(d.r.>95:5),但产率较低(15%)(Figure 5A)。有趣的是,磺酰胺9a和高烯丙基氯衍生的β-亚氨基磺酸酯7b在Cs2CO3的存在下均未观察到环化产物(Figure 5B)。
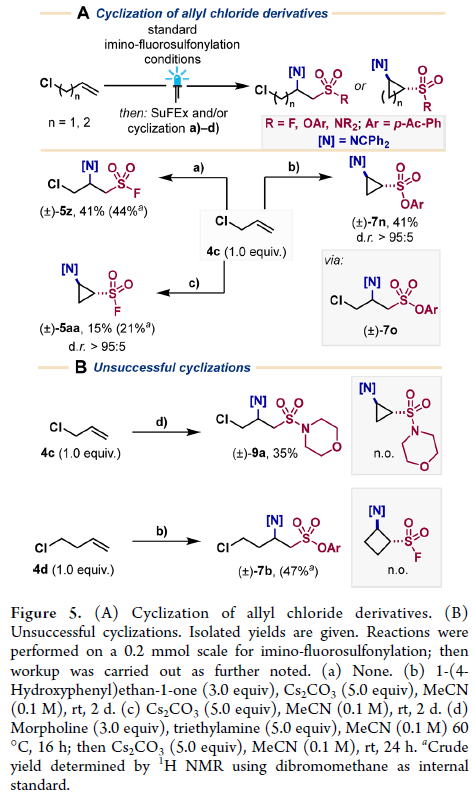
(图片来源:J. Am. Chem. Soc.)
接下来,作者考察了EnT-介导的氢-氟磺酰化体系中烯烃的兼容性(Figure 6)。一系列端烯连有杂芳环、磺酸酯、酯、三氟甲氧基(6b-6d,68-76%)、脂肪链以及卤代芳烃(10a-10c,59-75%)均可兼容。值得注意的是,一系列生物活性分子(D-glucose, ibuprofen, cholesterol)衍生的端烯亦可顺利实现转化,以中等至良好的产率得到产物6e-6g。
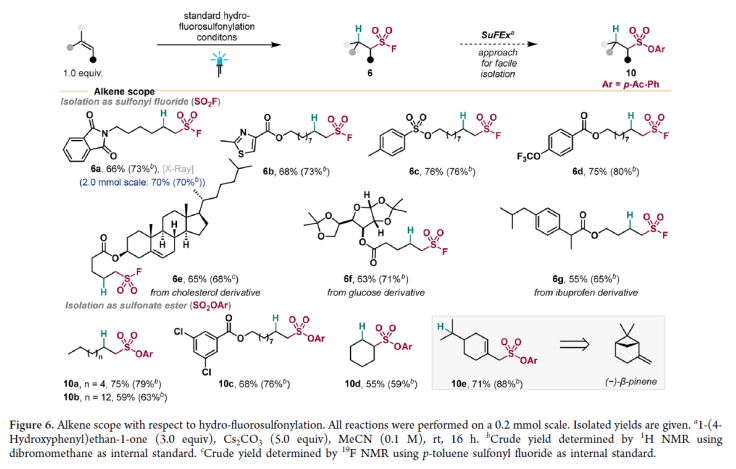
(图片来源:J. Am. Chem. Soc.)
为了证实此转化的应用性,作者对合成的亚胺-氟磺酰化产物进行了多样衍生化(Figure 7)。首先产物5a通过酸性脱保护以82%的产率得到铵盐11。而11可以与Boc保护的甘氨酸反应实现消旋的磺酰氟二肽12(52%)的合成。此外,在碱存在下,11可以发生环化以66%的产率得到具有生物活性的β-磺内酰胺产物13。最后,5p在更严格的酸性条件下会发生完全水解,以定量的产率得到两性离子β-铵盐磺酸盐产物14。

(图片来源:J. Am. Chem. Soc.)
为了深入理解此转化的反应机理,作者进行了一系列控制实验(Figure 8)。TEMPO捕获实验表明,在反应过程中形成了磺酰基自由基和亚胺基自由基(Figure 8A)。当使用三元环底物trans-4e参与亚胺-氟磺酰化反应时,可以观察到开环产物(±)-E-5ab的生成(Figure 8B)。当将4f置于氢-氟磺酰化反应条件下,经SuFEx反应后可以得到5-exo-trig环化产物6h(Figure 8C)。这两个实验均表明反应中涉及磺酰氟自由基与烯烃加成后生成的二级碳中心自由基中间体。通过对亚胺-氟磺酰化反应的UV/vis吸收研究得出只有硫杂蒽酮(TXT)光催化剂在405 nm处有足够的吸收(Figure 8D)。而Stern−Volmer荧光淬灭实验表明(二苯基亚甲基)磺酰氟是激发态光催化剂的唯一淬灭剂(Figure 8E)。接下来,作者对激发光催化剂的三线态能量与产物产率之间的关系进行了考察,实验结果表明在提高光敏剂的三线态能量的同时,产物产率增加,而氧化还原电位并没有明显的影响(Figure 8F)。在没有光敏剂和光照的条件下,外源自由基引发剂(AIBN, DTBP)并不能作为引发剂来引发反应(Figure 8G)。当作者使用395 nm LED进行量子产率分析后,得出亚胺-氟磺酰化反应的量子产率为Φ = 0.72 (Figure 8H)。因此,并不能完全排除自由基链式反应过程的存在。
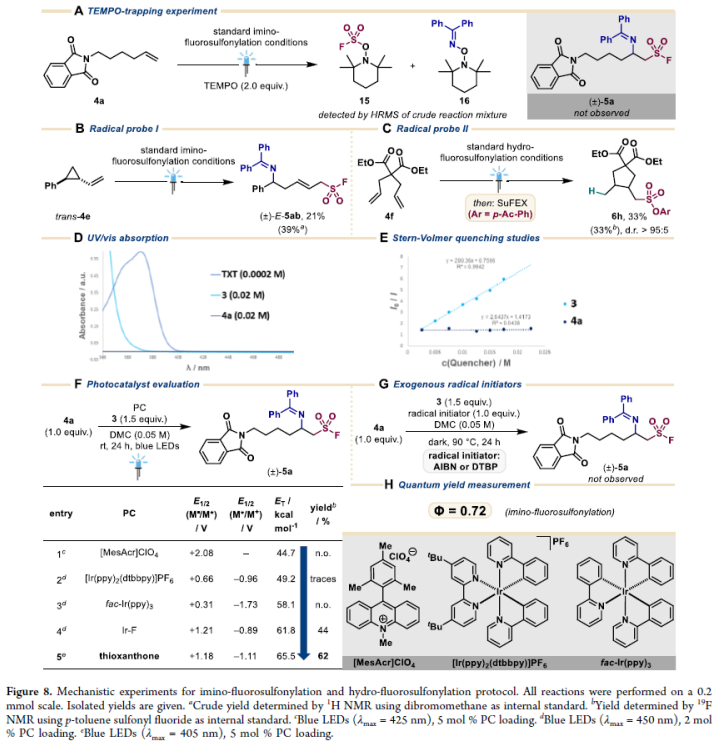
(图片来源:J. Am. Chem. Soc.)
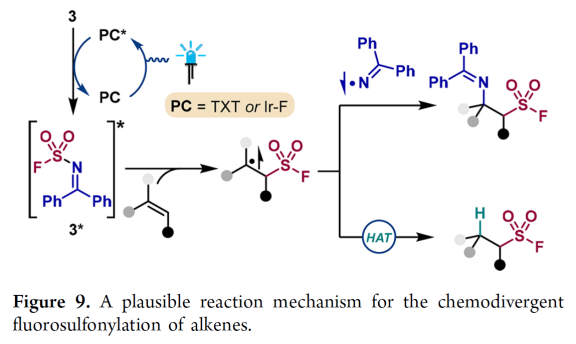
最后,基于上述实验结果和文献报道,作者提出了可能的反应机理(Figure 9)。首先,激发光催化剂(TXT或[Ir(dF(CF3)ppy)2(dtbbpy)]PF6)使(二苯基亚甲基)-氨基磺酰氟3变成三线态3*,并导致较弱的N−S σ-键发生均裂。随后,瞬态缺电子磺酰氟自由基可以与烯烃加成,形成碳中心自由基中间体。接下来,在不同的反应条件下碳自由基与亚胺基自由基结合或发生氢原子转移得到相应的脂肪族磺酰氟产物。
总结
明斯特大学Frank Glorius课题组发展了一种强大的双官能团化试剂−(二苯基亚甲基)-磺酰氟,其可以通过EnT催化与烯烃反应生成多种脂肪族(β-亚氨基)磺酰氟。该反应具有广泛的官能团兼容性(酰胺、叠氮化物、芳香族和脂肪族卤化物、杂环、酯、酮、醚等)和底物兼容性(端烯和三取代烯烃)。无论是亚氨-氟磺酰化反应还是氢-氟磺酰化反应均可实现规模化合成,且亚氨-氟磺酰化产物还可以多样化为β-氟磺酰铵、β-磺酸铵、磺酰氟二肽和β-磺内酰胺等。本文的工作进一步扩展了EnT催化在光化学氟磺酰化领域中的应用。




