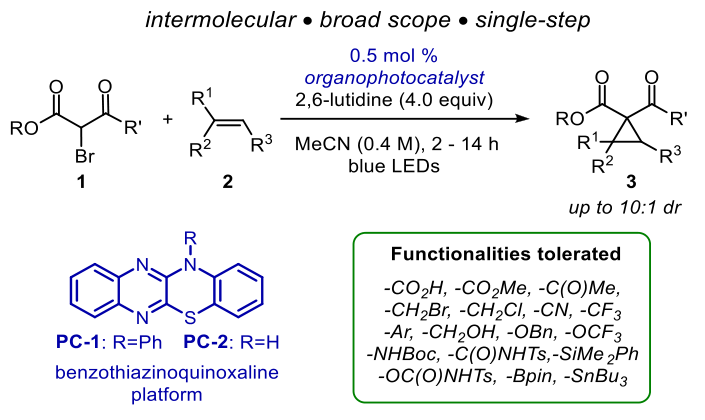
未活化烯烃的分子间有机光催化环丙烷化
环丙烷存在于天然产品、药品、农用化学品和香料中,是有用的合成材料。它们的高应变能和独特的成键模式使它们与众不同,使其具有其他碳环没有的反应性。各种经典的环丙烷化方法已经被设计出来:金属催化的重氮烷烃反应,Simmons - Smith反应,Kulinkovich反应,Corey - Chaykovsky反应,以及碳离子烷基化反应,还有其他方法比如采用贵金属或光催化。近日,来自苏黎世联邦理工大学的Carreira教授报道了第一个分子间有机光催化未活化烯烃与α-溴-β-酮酯和α-溴单酸酯的环丙烷化反应(图1)。
光化学驱动的转变最近成为科学家们研究的焦点。Ir或Ru配合物作为光催化剂,使可见光光催化在合成中的应用成为可能。平行方法,包括有机光催化剂,已被科学家们研究了很多。多芳烃已被用作染料,其在有机光催化中的应用正迅速增加。
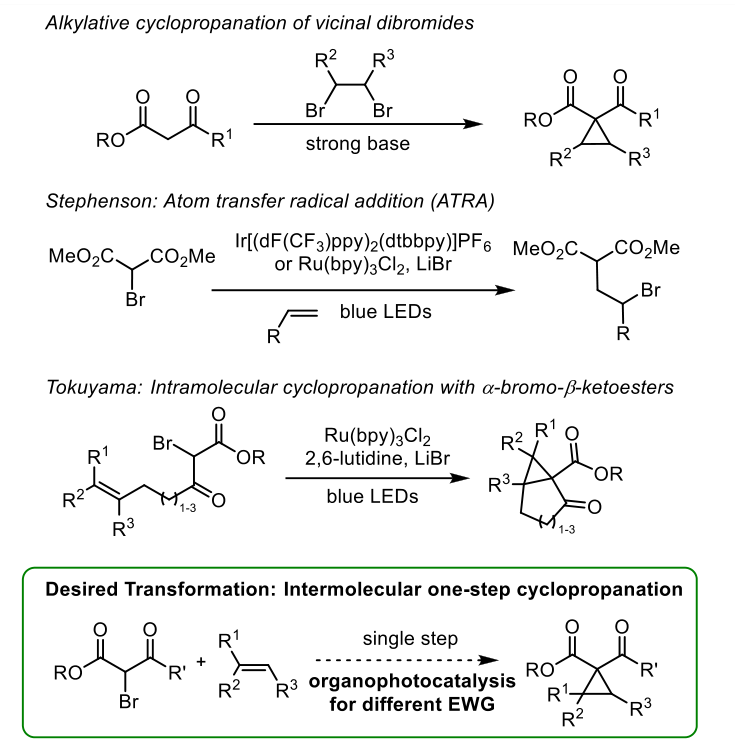
结合作者对烯烃功能化和光催化的兴趣,着手开发取代环丙烷的方法。简单的环丙烷就可以由β-酮酯和副二溴酯经γ-溴-β-酮酯烷基化合成。Stephenson通过分子间原子转移自由基加成(ATRA)法直接从烯烃中获得γ溴龙酸盐(图2)。Tokuyama随后研究了在2,6-二甲基砒啶、溴化锂和Ru(bpy)3Cl2存在下α-溴-β-酮酯的分子内环丙化反应。然而,α-溴-β-酮酯与未活化烯烃的直接分子间环丙化反应仍然是不确定的。
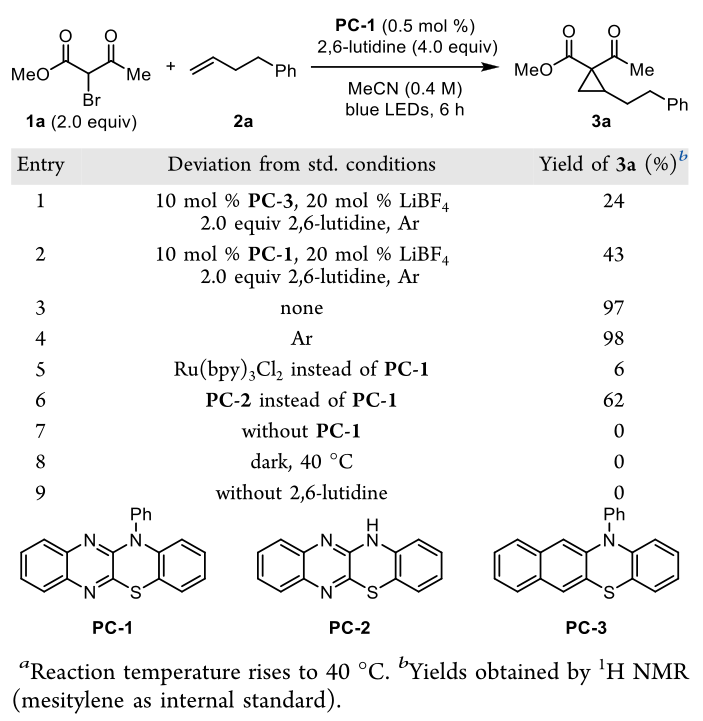
作为半频哪醇重排研究的一部分,Ohmiya和Nagao提出了用苯并噻嗪光催化剂还原溴酸酯的方法。作者假设苯并噻嗪也可以影响溴酮酯的还原,导致环丙烷化。然而,当作者将α溴-β-酮酯1a和苯丁烯2a与n -苯基苯并苯噻嗪(PC-3) (10 mol %)和20 mol % LiBF4,以及2.0 equiv 2,6-二甲基吡啶在惰性气氛下(0.4 M)在MeCN (0.4 M)中分离出环丙烷3a,产率仅为24%(表1,条目1)。对PC-3的紫外-可见光谱分析显示吸光度较差(ε446 nm < 100 M−1 cm−1)。
在确定在蓝光范围内具有较大消光系数的还原光催化剂时,二芳基二炔环磷酸化反应的研究引起了作者的注意。其中,Xu对染料进行了电化学和光化学表征。其中,苯并噻嗪喹啉衍生物PC-1和PC-2的红移吸收最大值显著,在蓝光范围内(ε446 nm > 3000 M−1 cm−1)吸光度增加,还原电位合适。作者推测它们可能是未活化烯烃与α-溴-β-酮酯环丙化反应的合适催化剂。据研究所知,它们还没有作为光催化剂被进一步研究。随后作者对其他反应条件进行了筛选,如避光,换用不同的气体氛围,光催化剂等等,最终确定了反应的最佳条件。
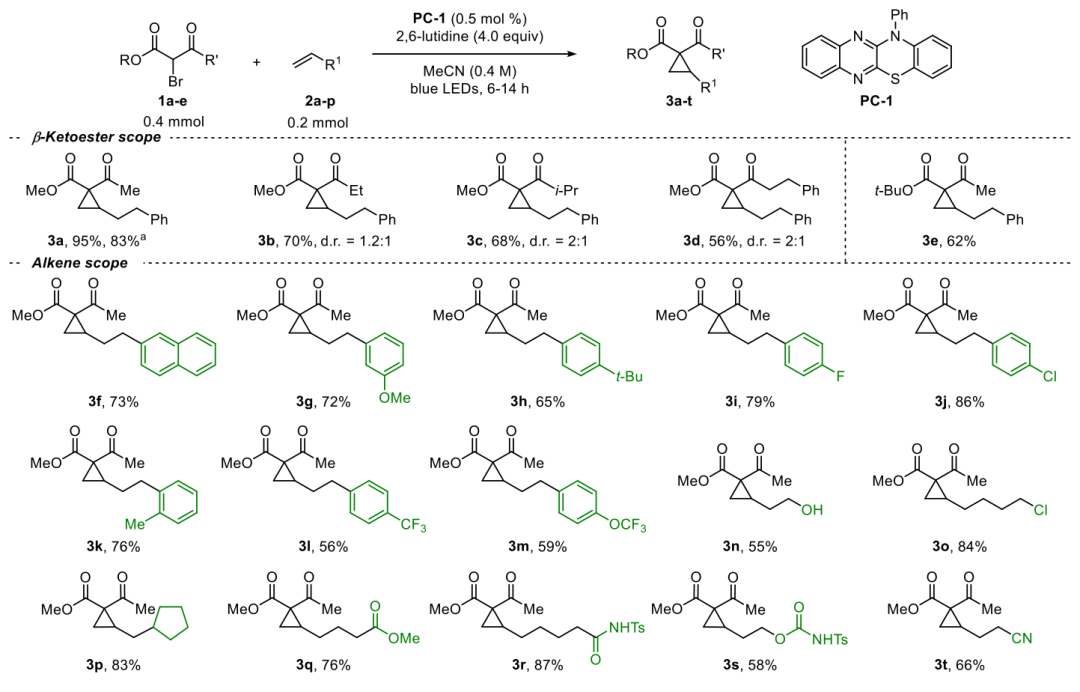
接下来作者研究了α-溴-β酮酯的底物范围(图3)。使用了各种γ取代的α-溴乙酰乙酸酯,包括溴乙酰乙酸和乙基、异丙基和苯乙基酮1a - d,从4 -苯丁烯得到环丙烷3a - d,产率为56 - 80%。缺电子芳基和富电子芳基被耐受,3h ~ m的产率为56 ~ 86%。得到3n伯醇和3o氯烷基,收率分别为55%和84%。值得注意的是,这种转变可以兼容O-H质子官能团,而在涉及碳烯的条件下,它们反而有利于O-H的插入(3p−t,产率为58−87%)。
环丙烷化反应中相当温和的非对映选择性促使作者研究可能诱导非对映控制的酯类。当2,6-二叔丁基苯酯4在反应条件下,以61%的产率和9:1 d.r得到了产物环丙烷6a。使用4构成了一种通解,使所研究的环丙烷化反应具有非对映选择性(图4),并且以45 - 71%的产率和7:1到10:1 d.r得到了环丙烷6b - f。先前已经表明,2,6-二叔丁基苯基环丙烷酸可以皂化以去除辅助物。
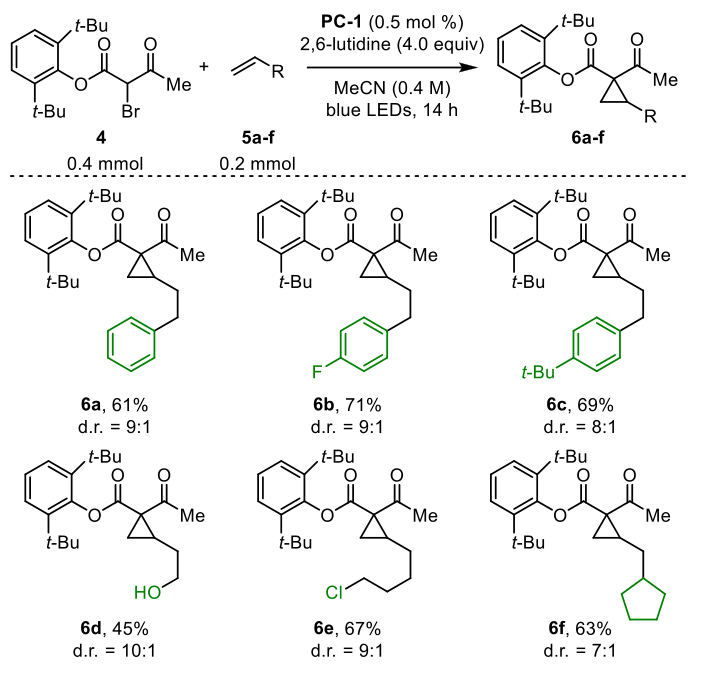
作者接着考察了对烯烃官能团的耐受性,当使用PC-2,加入1当量的LiBF4时,反应效果较好,包括末端、1,1-二取代、1,2-二取代和三取代烯烃。环丙烷9a - k的收率为44 - 93%。乙烯基锡烷8l和乙烯基硼酸频哪醇酯8m分别以73%和53%的收率转化为环丙烷9l和9m,1,1-二取代烯烃8n产率为9n,产率为78%。E-和z -辛2-烯分别产率为9o,产率为64 ~ 65%,d.r为1:1。三取代烯烃耐受性良好,分离出9p和9q的产率分别为80%和51%。9r从1-癸烯中获得,产率为91 ~ 94%,转化为天然产物顺式和反式三烯酸,总产率为72%。最后,9a也以2.0 mmol的规模得到81%的产率,9r以15 mmol的规模得到85%的产率。
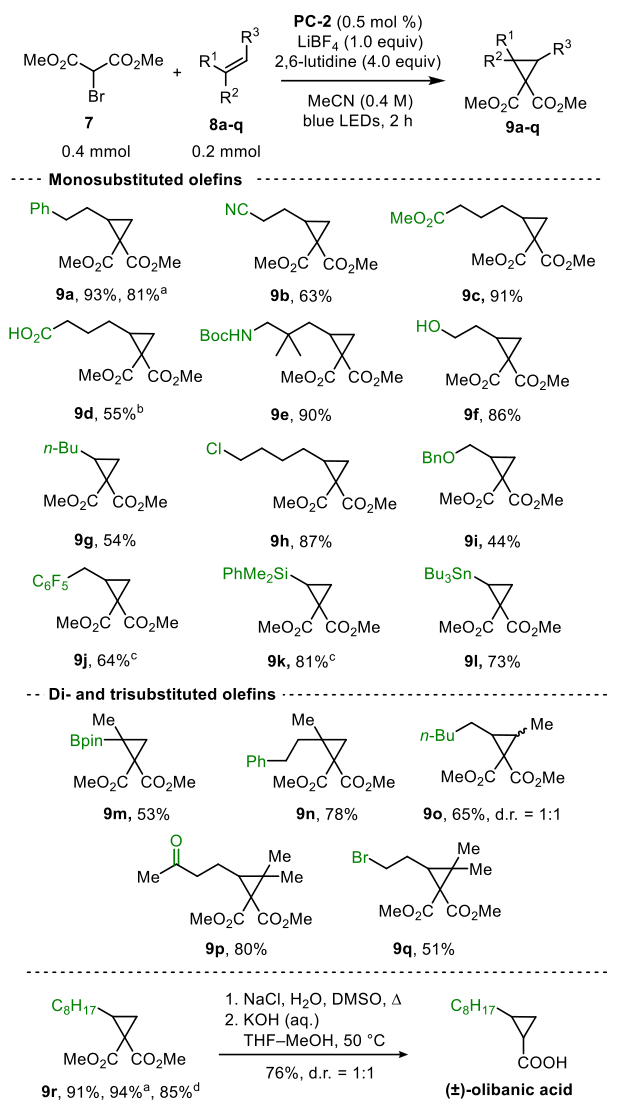
为了了解这种转变的机理,作者设计了一个催化循环(图6)后进行了一系列实验。初步研究集中在PC-1和PC-2的吸光度特性(图7,a)。
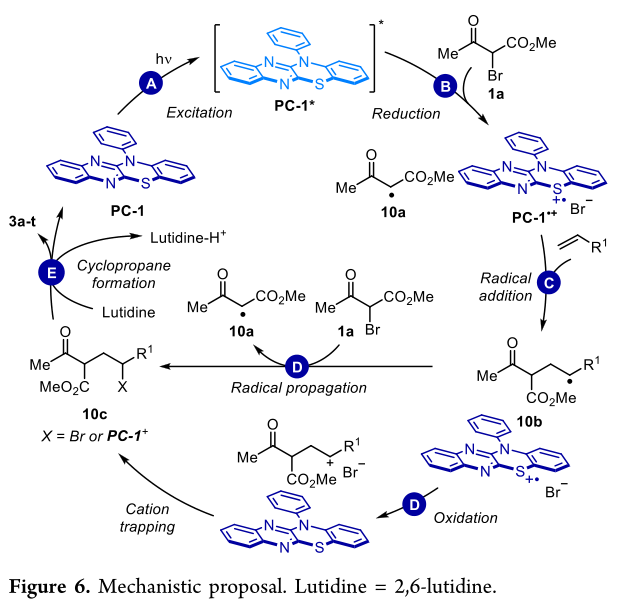
两种光催化剂在蓝光范围内均表现出较强的吸收,吸光度最大值分别为412 nm和414 nm。PC-1和PC-2在催化剂负载浓度为0.5 mol % (c = 1 mM)时,对λ < 457 nm的吸光度均高于3.0(未检测到透射率)。在转换中使用的蓝色LED发射了410到510纳米之间90%的光。因此,蓝色LED光反应器发出的几乎整个波长光谱都可以被PC-1或PC-2吸收(图7,A)。Stern - Volmer关系研究表明,α-溴-β酮酯1a对荧光猝灭,而2,6-二甲基吡啶或2a对荧光猝灭没有观察到。将这些结果与循环伏安法(CV)对PC-1 (E1/2* (PC•+/PC*) =−1.43 V vs SCE)和α-溴-β-酮酯1a (Ep/2 (B/B•−)=−1.03 V vs SCE)的测量结果相结合,作者得出结论,1a的还原是可行的,导致C中心自由基10a(图6)。当反应在1.0等伏TEMPO存在时,没有观察到产物的形成(图7,C)。这与提出的自由基途径和以前对ATRA的研究一致。在烯烃中加入10a后,可以设计出两种可能的机制途径。首先,通过仲烷基自由基10b抽离溴,自由基传播形成仲烷基溴10c (X = Br)和另一个β-酮酯自由基10a(图6,D)。另外,氧化光催化剂PC-1•+ (E1/2(PC•+/PC) = 1.06 V vs SCE)可能会将10b (E1/2(C+/C•)= 0.47 V vs SCE)氧化为碳正离子,然后被溴或PC-1捕获。对于溴酮酯1a和苯丁烯2a (1.0 mmol)的反应,120 min后,烯烃的转化率为8%(见SI),量子产率计算为Φ = 0.012,这与封闭的光氧化还原催化循环一致(图7,D)。
LiBF4在与α-溴酸酯的环丙烷化反应中是必要的,而在与α-溴-β-酮酯的反应中是有害的。对于后者,添加LiBF4导致产率降低(34% vs 95%,见SI),并增加1a的分解。为了实现环丙烷化,中间产物10c被碱基(2,6-二甲基吡啶)烯醇化是必要的(图6,E)。作者假设中间产物丙二酸酯(pKa = 13)的烯醇化是由Lewis酸性Li+促进的,而中间产物乙酰乙酸酯(pKa = 11)的烯醇化不是必需的。为了研究10c的烯醇化,在D2O为1.0当量的d3-MeCN中进行氘化实验(图7,E)。选择甲基丙二酸二甲酯和甲基甲基乙酸甲酯作为10c的模型。在LiBF4和2,6-二甲基吡啶的存在下,丙二酸酯和乙酰乙酸酯的平衡(66%氘掺入)分别在9和5分钟内完成。在没有LiBF4的情况下,只有乙酸酯达到平衡,尽管仅在2小时后。这些实验支持在反应条件下形成烯酸酯,并解释了丙二酸酯(需要Li+)和乙酸酯(不需要Li+)之间观察到的反应活性差异。此外,在碱的存在下,溴酮酯1a发生分解,而溴酸酯则没有观察到这种影响。我们认为,对于Li+,起始物质1a的更大比例被烯化,导致分解增加。因此,中间产物10c的充分烯醇化与起始材料1a的最小烯醇化之间需要一个微妙的平衡(图7,E)。
综上所述,作者首次在有机光催化条件下实现了未活化烯烃与α-溴酸酯的分子间环丙化反应,并与α-溴-β-酮酯进行了分子间环丙化反应。该方法具有广泛的官能团耐受性和多取代烯烃的适用性。作者证明了结构相似的底物α-溴酸酯和α-溴-β-酮酯在这种转变中表现出明显不同的行为。虽然Li+对α-溴酸酯有益,但它对α-溴-β-酮酯是多余有害的。该转化的显著特点是其耐空气性和苯并噻嗪喹啉PC-1和PC-2作为有机光催化剂的成功应用。





