硝基芳烃作为光活性氧化剂用于烯烃的双羟基化反应
近日,德国亚琛工业大学Daniele Leonori和英国曼彻斯特大学Marco Simonetti团队提出了一种使用硝基芳烃作为光活性氧化剂,实现了烯烃的双羟基化反应。在紫色LED照射下,这些配合物可与多种烯烃进行[3+2]-光环加成反应,生成稳定的1,3,2-二噁唑烷中间体。这种中间体可以在溶液中积累,然后通过原位还原生成所需的二醇产物,其中利用易得和易于处理的固体试剂作为H2替代物。文章链接DOI:10.1002/anie.202214508
(图片来源:Angew. Chem. Int. Ed.)
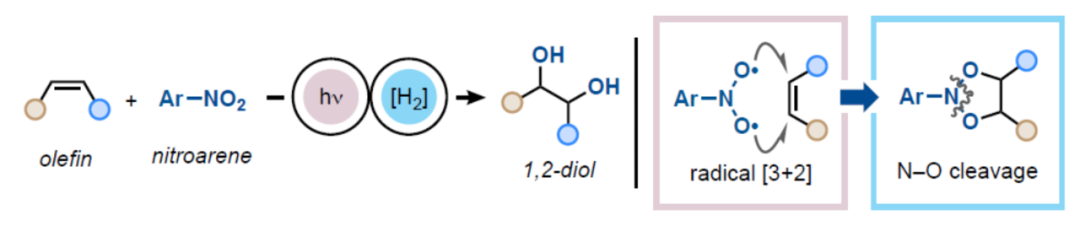
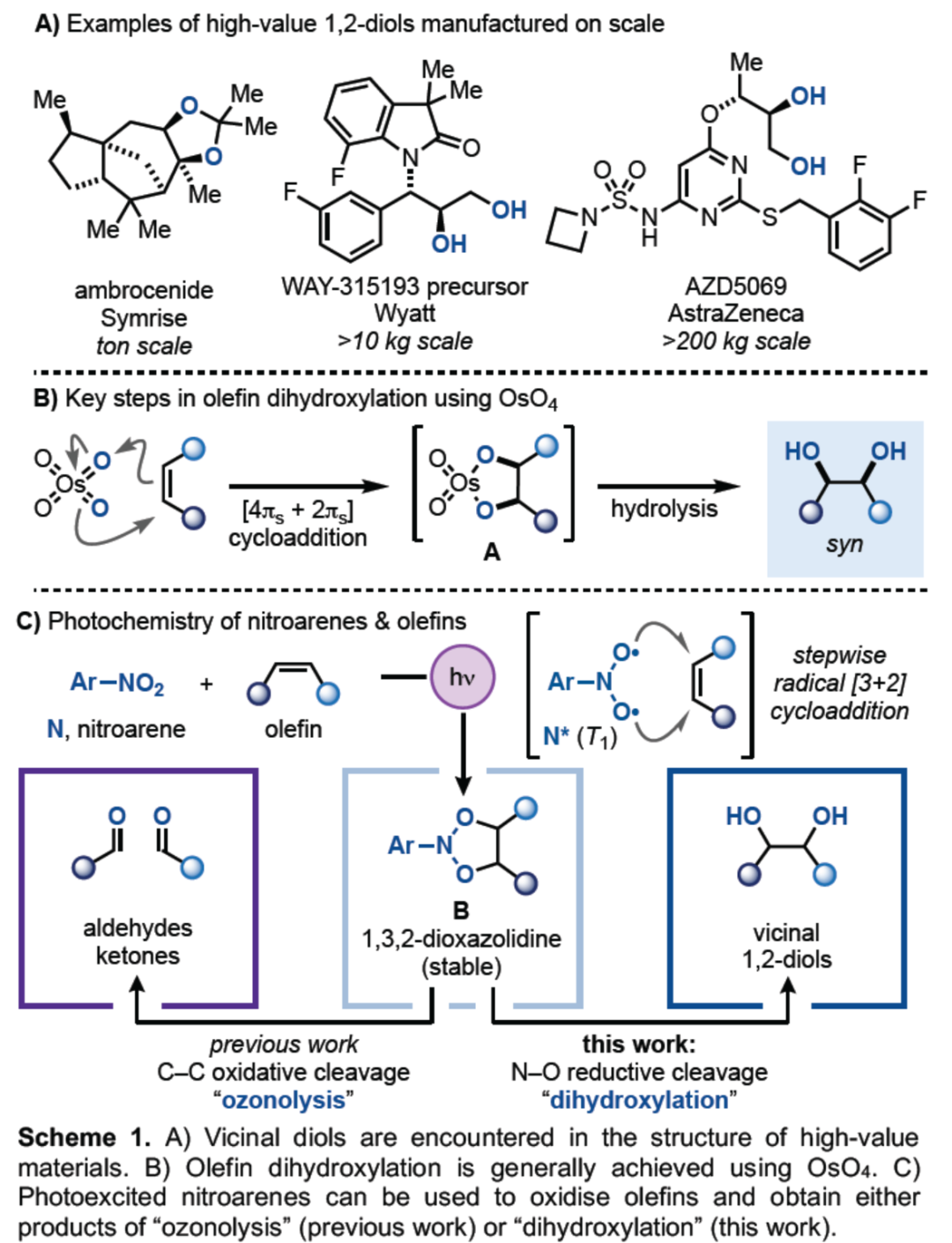
在许多生物活性材料的结构中经常会遇到邻二醇结构单元,并且在制药、农业化学和香料工业生产高价值化合物的过程中也会经常需合成相应的邻二醇衍生物(Scheme 1A)。使用OsO4进行烯烃的双羟基化反应是合成1,2-二醇最为直接的方法,可将烯烃原料转化为高价值的富氧衍生物(Scheme 1B)。其中,OsO4在C-Cπ键上进行的立体专一性[4πs+2πs]环加成可生成锇酸酯(A),其经进一步的水解可获得syn-1,2-二醇(Scheme 1B)。为了在[Os]中起催化作用,这些过程需要使用终端氧化剂,其中N-甲基吗啉N-氧化物(Upjohn procedure)和K3Fe(CN)6(Sharpless不对称双羟基化反应)最为常用。然而,OsO4存在一定的毒性以及价格昂贵的弊端,因此仍需开发一种可替代的策略。虽然化学家们已开发多种使用过渡金属氧化物(如Ru、Fe、Mn、Pd、Mo等)作为替代的策略,但此类反应存在底物范围窄、选择性低以及存在过度氧化生成不期望的副产物等问题。基于逐步烯烃环氧化,然后用O-亲核试剂进行开环的反应,通常用于合成anti-1,2-二醇,但在底物范围和官能团兼容性方面也存在挑战。最近,化学家们已开发了基于电化学、光电化学和光催化的温和的可持续方法,但通常仅限于活化底物(如苯乙烯)的双羟基化反应。其它的策略还包括基于以氧为中心的自由基前体和双硼化,以及新的过氧化物和高价碘体系的策略。在某些情况下,也可使用非活化的烯烃,但存在官能团兼容性和反应效率的问题。总的来说,在温和条件下使用安全试剂将烯烃转化为邻位二醇,并且能够将底物范围扩展至非活化烯烃则具有难度。受到Büchi、De Mayo等团队的启发,使用可见光激发的硝基芳烃可进行烯烃的臭氧分解氧化断裂。近日,德国亚琛工业大学Daniele Leonori和英国曼彻斯特大学Marco Simonetti团队提出了一种使用硝基芳烃作为光活性氧化剂,实现了烯烃的双羟基化反应(Scheme 1C)。其中,该策略基于三重激发硝基芳烃*N和烯烃之间的逐步自由基[3+2]环加成,可生成相对稳定的1,3,2-二噁唑烷配合物B。随后,通过N-O还原断裂,可生成所需的邻二醇化合物。
(图片来源:Angew. Chem. Int. Ed.)
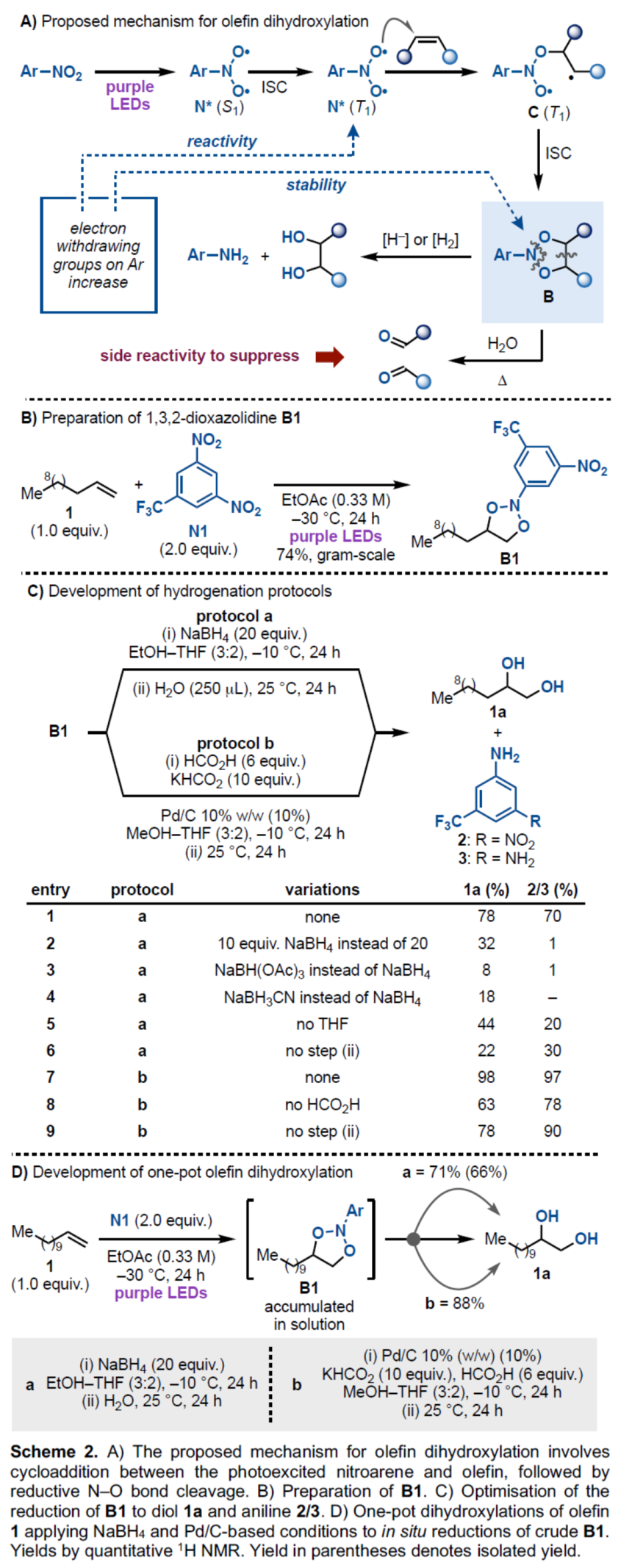
首先,作者提出了一种合理的催化循环过程(Scheme 2A)。硝基芳烃在紫色LEDs照射条件下,可生成单重态激发态(S1)。S1经系间窜越(ISC)可生成长寿命三重态(T1)。T1与烯烃进行加成,可生成三重双自由基C。自由基C经ISC后,可生成1,3,2-二噁唑烷配合物B。配合物B在溶液中不断的积累,可选择性的实现两个N-O键的断裂,获得目标邻二醇产物。
其次,作者进行了1和N1的克级规模实验,可以74%的收率得到1,3,2-二噁唑啉产物B1,这是一种特别稳定的衍生物,仅需通过简单过滤分离,并作为白色固体储存数月(Scheme 2B)。
随后,作者以B1作为模型底物,进行了相关氢化反应条件的筛选(Scheme 2C)。当以Pd/C作为催化剂,KHCO2和HCO2H原位生成H2,在MeOH-THF(3:2)的混合溶剂中-10 oC反应24 h后,再将反应温度提高至25 oC继续反应24 h,可以98%的收率得到二醇产物1a。
为了进一步简化合成的过程,作者进行了一锅两步反应条件的优化(Scheme 2D)。首先,1和N1在紫色LEDs照射下,在EtOAc溶剂中-30 oC反应24 h后,在于上述标准条件(protocol b)下反应,可以两步88%的总收率得到二醇产物1a。
(图片来源:Angew. Chem. Int. Ed.)
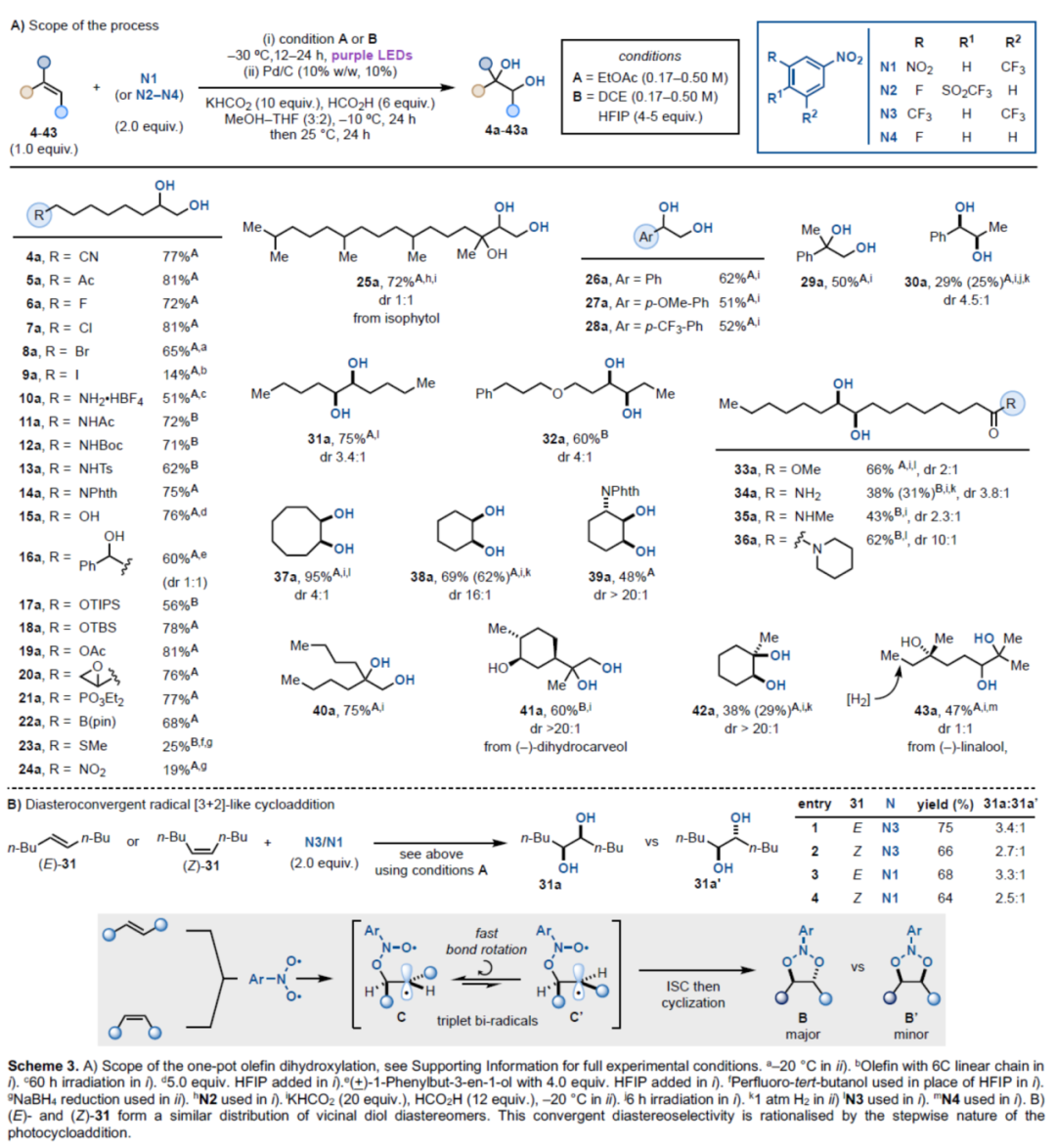
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Scheme 3A)。首先,当末端烯烃中含有-CN、-Ac、-卤素时,均与体系兼容,获得相应的产物4a-9a,收率为14-81%。其中,对于含有碘取代的末端烯烃,反应性较差,如9a。当末端烯烃中含有不同的氮/氧官能团时,也是合适的底物,获得相应的产物10a-19a,收率为51-81%。当末端烯烃中含有-PO3Et2、-B(pin)、-SMe、-NO2时,也能够顺利进行反应,获得相应的产物21a-24a,收率为19-77%。值得注意的是,复杂和具有空间位阻的线性烯烃(异植物醇25),也能够进行反应,可以72%的收率得到1,2,3-三醇25a。其次,具有不同电性取代的苯乙烯,也能够顺利进行反应,获得相应的产物26a-30a,收率为29-62%。二取代烯烃与环状烯烃,也是合适的底物,获得相应的产物31a-39a,收率为38-95%,dr为2:1->20:1。此外,偕二取代的烯烃,也具有良好的反应性,获得相应的产物40a-41a,收率为60-75%。三取代烯烃,也是合适的底物,获得相应的产物42a-43a,收率为38-47%。
随后,作者还对非对映汇聚性自由基[3+2]型环加成反应条件进行了研究(Scheme 3B)。硝基芳烃N3与(E)-或(Z)-31反应时,syn-二醇31a的合成优先于anti-二醇31a’。因此,作者认为,以上结果可通过使三重双自由基C和C’平衡倾向于小位阻的C的快速键旋转来合理解释。ISC和环化可选择性地获得环加成产物B作为主要产物。
(图片来源:Angew. Chem. Int. Ed.)
德国亚琛工业大学Daniele Leonori和英国曼彻斯特大学Marco Simonetti团队提出了一种使用硝基芳烃作为光活性氧化剂,实现了烯烃的双羟基化反应。在紫色LED照射下,这些配合物可与多种烯烃进行[3+2]-光环加成反应,生成稳定的1,3,2-二噁唑烷中间体。这种中间体可以在溶液中积累,然后在原位还原生成所需的二醇。其次,该策略具有反应条件温和、底物范围广泛、官能团兼容性出色等特点。
文献详情:





