Science:光催化不对称分子间烯丙基C-H胺化反应
近日,美国德克萨斯大学达拉斯分校(University of Texas at Dallas) Vladimir Gevorgyan课题组发展了通用的光催化策略,实现了不同取代烯烃与一级或二级脂肪胺的分子间烯丙基C-H胺化反应。此策略与经典的Pd(II/0)途径不同,其使用温和的芳基溴作为氧化剂,通过蓝光诱导的Pd(0/I/II)途径实现了这一转化。此外,作者还利用此体系实现了立体选择性烯丙基C-H胺化过程。相关成果发表在Science上,文章链接DOI:10.1126/science.abq1274。
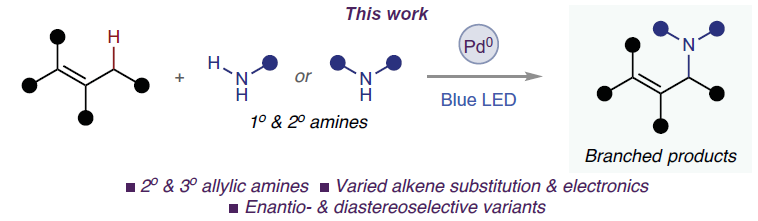
(图片来源:Science)
近些年,烯丙基胺的合成受到了有机化学家们的广泛关注,由于它们既具有不同的生物活性,又可以作为通用的合成子(Fig. 1A)。脂肪族烯丙基胺的传统制备方法之一是使用预官能团化的烯烃进行亲核取代(Fig. 1B, top left),但反应中通常会伴随双烯丙化过程等问题。此外,高效率和高选择性的实现二级烯丙基亲电试剂的取代过程则具有一定的困难。而利用Tsuji-Trost烯丙基取代则可以有效解决此问题,以较高的区域选择性,非对映选择性和对映选择性实现此过程(Fig. 1B, bottom left)。然而,获取复杂的烯丙基亲电试剂则是一项艰巨的任务。而若可以直接实现烯丙基C-H胺化则可以避免对烯烃的预官能团化过程。例如,White课题组(Science, 2022, 376, 276)和江焕峰课题组(Nat. Chem., 2022, 14, 1118)在最近分别报道了利用BF3络合物和简单的二级脂肪胺实现线性三级烯丙基胺的制备(Fig. 1B, top right)。然而,当使用一级胺时却仅能得到双烯丙基化产物。此外,由于烯烃会与亲电性的Pd(II)催化剂配位,因此底物范围仅局限于单取代烯烃,且仅适用于电中性和富电子烯烃(Fig. 1C)。因此,如果能发展出一个互补的氧化还原循环则可以避免Pd(II)催化剂的参与,从而避免底物与催化剂发生配位,则会大大扩展烯烃的范围。2016年,Vladimir Gevorgyan课题组发展了在光催化下生成的杂化芳基Pd(I)自由基可以与脂肪族C(sp3)-H位点发生分子内的氢原子转移(HAT)过程。芳基碳氢键和脂肪族碳氢键之间的键解离焓(BDE)的巨大差异使得这一过程在热力学上是有利的,且在活化C-H键的情况下,这种驱动力进一步增强。最近几个研究小组利用此策略分别使用芳基卤化物实现了此过程。鉴于此,作者设想借助芳基溴作为氧化剂在钯催化中的不寻常作用,首先通过光诱导单电子转移在金属中心发生氧化,随后通过分子间的HAT再氧化烯烃。形成的杂化烯丙基Pd(I)自由基中间体将与π-烯丙基Pd(II)络合物结合,随后被烷基胺捕获得到目标C-H胺化产物并使钯催化剂恢复到原始的氧化还原状态完成催化循环(Fig. 1D)。最近,Vladimir Gevorgyan课题组发展了通用的光催化策略,实现了不同取代烯烃与一级或二级脂肪胺的分子间烯丙基C-H胺化反应(Fig. 1B, bottom right)。
作者首先选择(E)-β-乙基苯乙烯和哌啶进行反应尝试,当使用Pd(PPh3)4/Xantphos催化体系,溴苯作氧化剂,Cs2CO3作碱,苯作溶剂,在蓝色LED照射下室温反应15小时可以以4%的产率得到目标烯丙基胺化产物1,初步实现了反应。随后作者通过一系列条件筛选,当使用Br-12作氧化剂并在体系中添加TBAB可以以92%的产率得到烯丙基胺化产物1(Fig. 1D)。值得注意的是,此体系仅需要2当量烯烃即可实现,这与之前报道的涉及芳基自由基中间体的转化(通常需要多于5当量烯烃)相比具有较大优势。控制实验表明钯催化剂和可见光的照射对此转化至关重要。
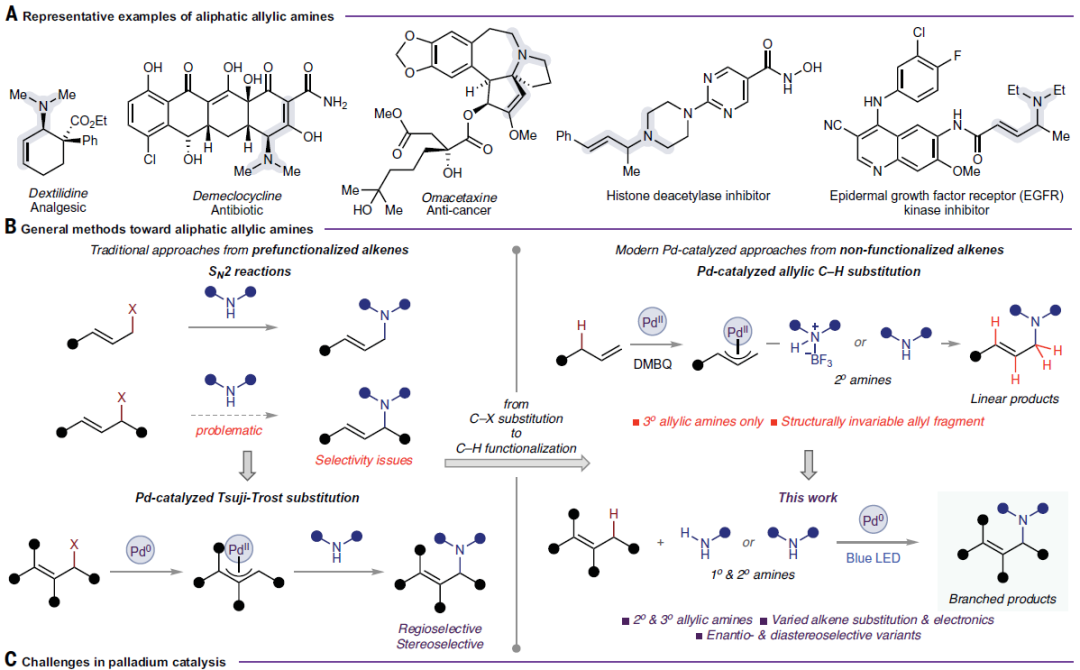
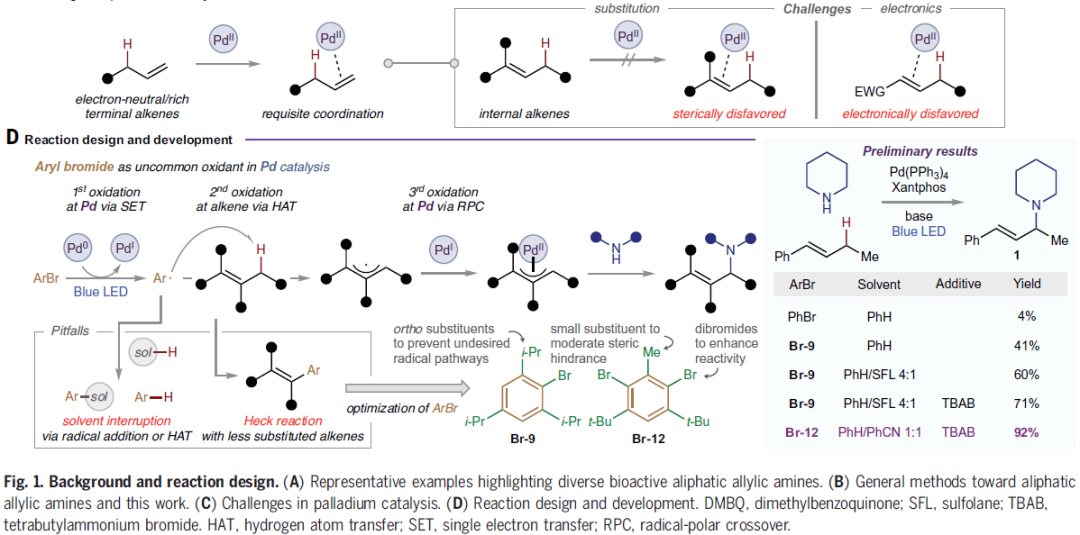
(图片来源:Science)
在得到了最优反应条件后,作者对此转化的底物适用性进行了探索(Fig. 2)。首先,作者对一系列烯烃的兼容性进行考察(Fig. 2A)。烯烃上的芳环取代可以存在多种变化(2-26)。如具有亲核性的酚羟基(4)、可以进一步衍生的芳基氯(12,21)、芳基溴(13)、芳基甲磺酸酯(14)、芳基硼(15)等基团均可兼容。一系列不同电性的杂芳环骨架,如氮杂环(27-29)、氧杂环(30)、硫杂环(31,32)等均可兼容。值得注意的是,在传统方法中不能兼容的Michael受体可以有效实现此转化,通过1,4-加成以良好的化学选择性实现C-H胺化(36,37)。除了活化的烯烃外,烷基烯烃也可以顺利参与反应,以43-84%的产率得到产物39-42。对于含有不同烯丙位C-H的脂肪族烯烃,利用此方法可以优先实现这种基于芳基自由基的转化,使较强的一级C-H键位点与较弱但不易接近的三级或二级反应位点相比优先发生选择性胺化(43-45),这与大多数分子间HAT反应优先实现较弱的C-H键胺化相反。同样地,当在不同空间位阻环境下存在多个二级C-H位点时,选择性胺化发生在位阻较小的位置(46)。
接下来,作者对脂肪胺的底物范围进行考察(Fig. 2B)。具有不同大小尺寸的环胺,如氮杂环丙烷、氮杂环丁烷、吡咯烷、氮杂环庚烷、哌啶、哌嗪、吗啡啉、硫代吗啉等均可以作为亲核试剂实现转化(47-65)。此外,非环状的二级胺也可兼容,但产率相对较低,为41-66%(66-70)。值得注意的是,包括药物相关的环丙基甲基胺(71)和环丁胺(72)在内的一级胺可以顺利实现转化,以42-46%的产率实现产物71-76的合成。对于在经典的C-H胺化反应(Pd(II/0)催化循环)通常不能兼容的端烯,其在此转化中可以以73%的产率的到目标产物77。对于非脂肪单亲核试剂,如苯胺、磺酰胺、氨基甲酸酯、酰亚胺以及氮杂环,均可在此反应中作为亲核试剂实现转化(78-83)。
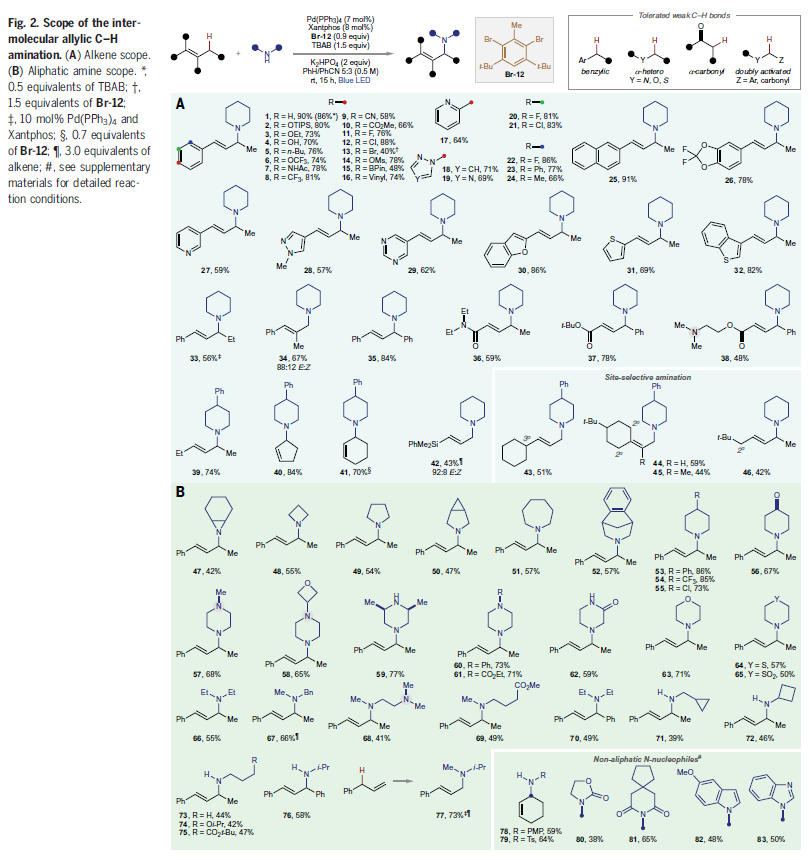
(图片来源:Science)
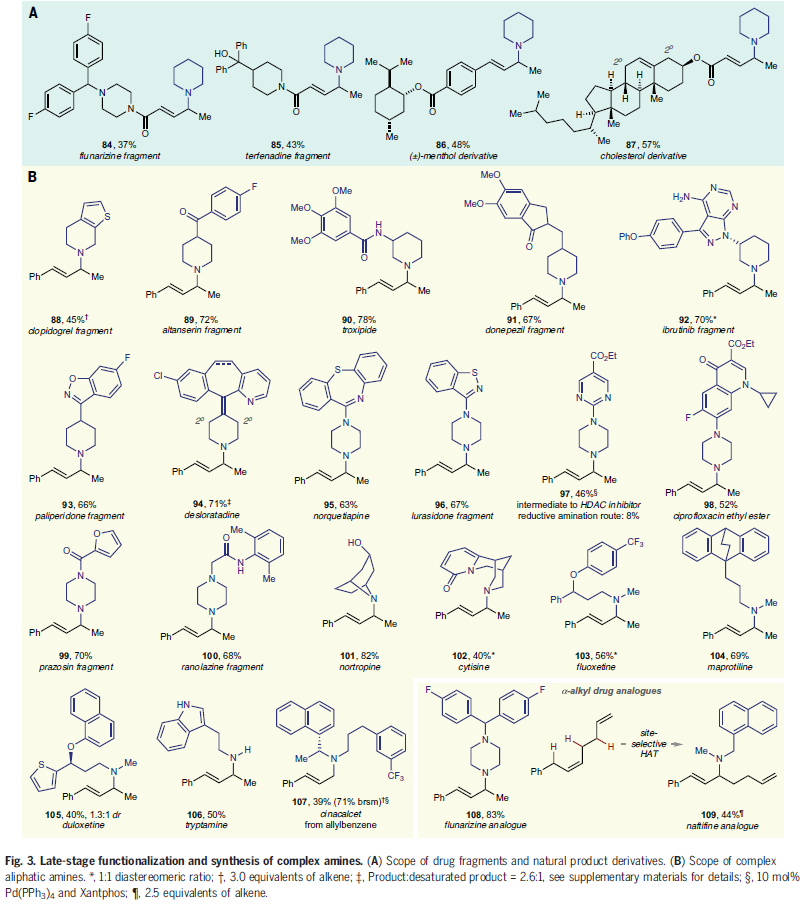
接下来,为了验证此光催化转化的实用性,作者对复杂分子的普适性进行考察(Fig. 3)。一系列药物片段以及天然产物衍生物,如氟桂利嗪(flunarizine)、特非那定(terfenadine)、(±)-薄荷醇(menthol)、胆固醇(cholesterol)等均可以成功实现烯丙基C-H胺化,以37-57%的产率实现产物84-87的合成(Fig. 3A)。此外,鉴于含有哌啶和哌嗪骨架的分子通常具有一定的药物活性,作者在此胺化反应中尝试了一系列含有此类骨架的药物(或其片段),可以以良好的产率实现其相应的烯丙基胺88-100的构建。为了进一步证明此方法的实用性,作者考察了多种具有生物活性的环状(101,102)和非环状(103-107)胺,均可顺利实现转化。值得注意的是,利用此方法还可以实现氟桂利嗪(flunarizine)以及萘替芳(naftifine)等知名药物分子的α-取代类似物108和109的合成。
(图片来源:Science)
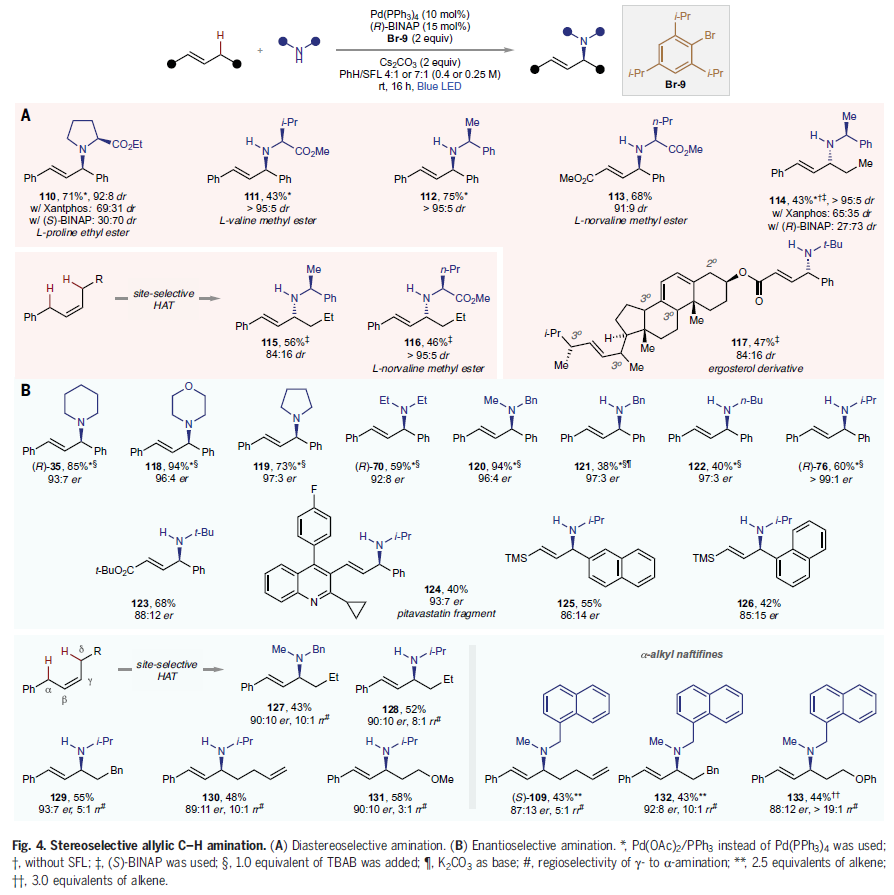
尽管利用钯催化的烯丙基取代反应来构建对映体富集的烯丙基胺已经得到了广泛的发展。然而却并没有应用在高对映选择性烯丙基胺化反应中。这主要是由于烯烃的限制,其总是优先生成不含立体中心的线性产物。而利用作者发展出的方法则可以实现支链烯丙基胺产物的生成,并构建了一个新的立体中心。首先,作者探索了此反应的非对映选择性转化(Fig. 4A)。利用1,3-二苯基丙烯可以与天然的手性胺(L-脯氨酸酯)可以在Pd/(R)-BINAP体系的诱导下发生非对映选择性C-H胺化过程,以71%的产率得到110(dr = 92:8)。其它的手性胺,如L-缬氨酸酯、L-戊氨酸酯等均可以在此体系下经历C-H烯丙基胺化过程,得到产物111-113。类似的烷基取代产物114-116也可以利用此催化体系得到,但(S)-BINAP的效果最佳。值得注意的是,利用此策略还可以实现麦角固醇(ergosterol)衍生物117的合成。最后,作者考察了此反应中更具挑战性的对映选择性转化过程(Fig. 4B)。一系列对称取代的烯丙基体系可以很好的实现对映选择性控制,分别实现了(R)-35, (R)-70, (R)-76, 118-122的合成。对于非对称的烯丙基体系仍可以以良好的对映选择性实现产物123-126的合成。对于含有多个烯丙基C-H反应位点的底物,此反应会专一的在烯烃的α-C-H位发生HAT并得到烯丙基胺产物127-131。值得注意的是,一些药物类似物参与的转化也均可以实现良好的区域选择性和对映选择性控制,得到产物(S)-109, 132, 133。总的来说,上述结果证实了用单一催化剂将激发态自由基化学与基态不对称过程相结合的可行性。
(图片来源:Science)
美国德克萨斯大学达拉斯分校Vladimir Gevorgyan课题组发展了通用的光催化策略,实现了不同取代烯烃与一级或二级脂肪胺的分子间烯丙基C-H胺化反应。此策略与经典的Pd(II/0)途径不同,其使用温和的芳基溴作为氧化剂,通过蓝光诱导的Pd(0/I/II)途径实现了这一过程。作者通过对此反应的立体选择性转化进行探索,证实了利用单一催化剂将激发态自由基化学与基态不对称过程相结合的可行性。





