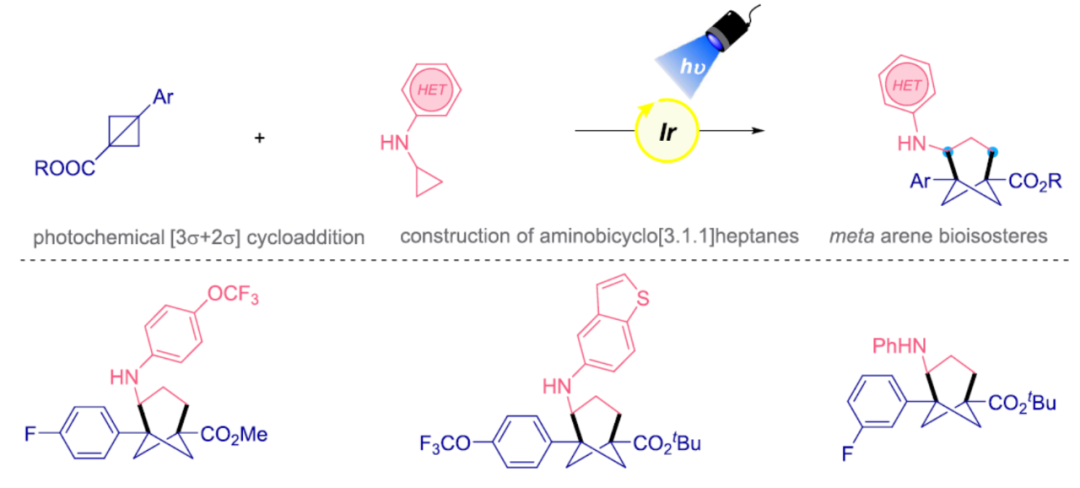
光化学分子间[3σ+2σ]-环加成构建氨基双环[3.1.1]庚烷
近日,美国宾夕法尼亚大学Gary A. Molander课题组首次报道了一种光诱导双环[1.1.0]丁烷和环丙胺的[3σ+2σ]环加成反应,合成了一系列三取代双环[3.1.1]庚烷衍生物。同时,该反应具有反应条件温和、操作条件简单等特点。其次,通过该策略还可合成独特的间位取代芳烃生物等排体。此外,通过后期的衍生化实验,进一步证明了反应的实用性。文章链接DOI:10.1021/jacs.2c11501
(图片来源:J. Am. Chem. Soc.)
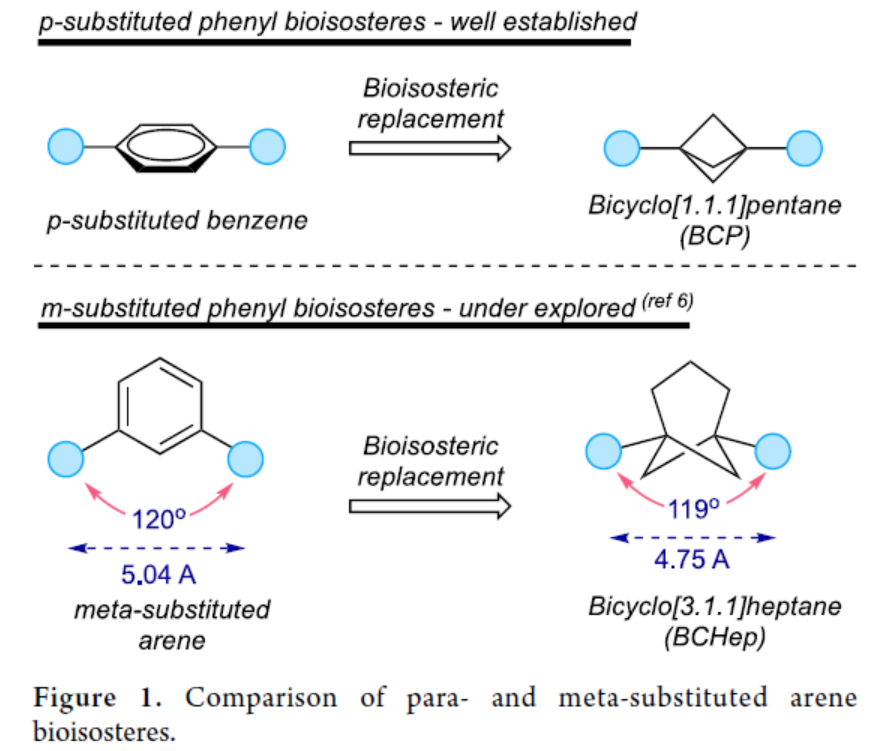
双环烃已经证明了在治疗分子中取代芳香环的能力,具有更大的溶解度、代谢稳定性以及增强的药代动力学特性。由于这些特性,这些生物等排体骨架在药物分子设计中受到了相当大的关注。其中,在小环笼状烃中研究最多的是一种双环[1.1.1]戊烷(BCPs),其用作邻位和对位取代的苯环以及叔丁基的生物等排体取代物。目前,化学家们也开发了几何互补的间位取代芳烃生物等排体的新型合成方法。然而,此类策略主要使用桥联取代的BCPs和双环[2.1.1]己烷用于探索这些骨架,尽管这些骨架并不完全模拟间位取代芳烃中显示的键载体。最近,Brown和Glorius课题组开发了一种有效的[2π+2σ]光环加成策略,用于合成双环[2.1.1]己烷。从合成的角度来看,制备能够精确再现间取代芳烃几何结构的生物等排体一直具有挑战。最近,通过使用[3.1.1]丙烯作为原料制备双官能团化的双环[3.1.1]庚烷研究表明,这些亚结构可作为间位取代芳烃的类似物(Figure 1)。
(图片来源:J. Am. Chem. Soc.)
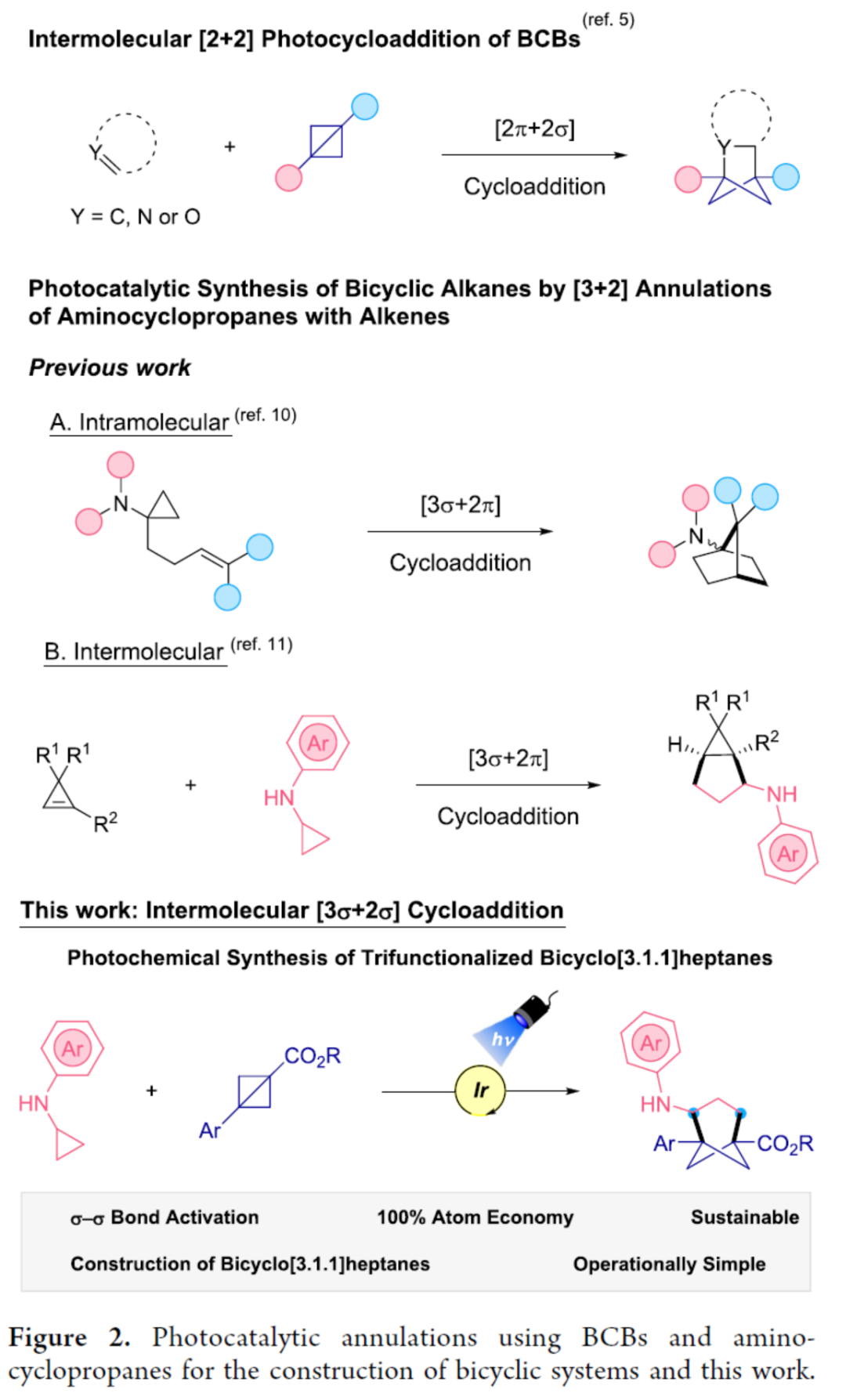
环丙胺(CPAs)具有多功能性,可作为获得高价值含氮有机化合物的砌块。环丙胺与烯烃的[3+2]环化反应可用于构建复杂的环胺。它们作为合成骨架的用途源于最初氧化为氮自由基阳离子时不可逆的开环。1998年,Cha和Iwata团队报道了含有烯基的N,N-二烷基氨基环丙烷用于构建氨基八氢戊烯。在合成双环氨基烷烃的光化学[3+2]环加成发展中,使用双环CPAs通过钌光催化分子间的方式进行反应。后来,化学家们还报道了氨基/亚氨基环丙烷和烯烃的分子内和分子间环加成反应(Figure 2)。近日,美国宾夕法尼亚大学Gary A. Molander课题组首次报道了一种光诱导双环[1.1.0]丁烷和环丙胺的[3σ+2σ]环加成反应,合成了一系列三取代双环[3.1.1]庚烷衍生物。
(图片来源:J. Am. Chem. Soc.)
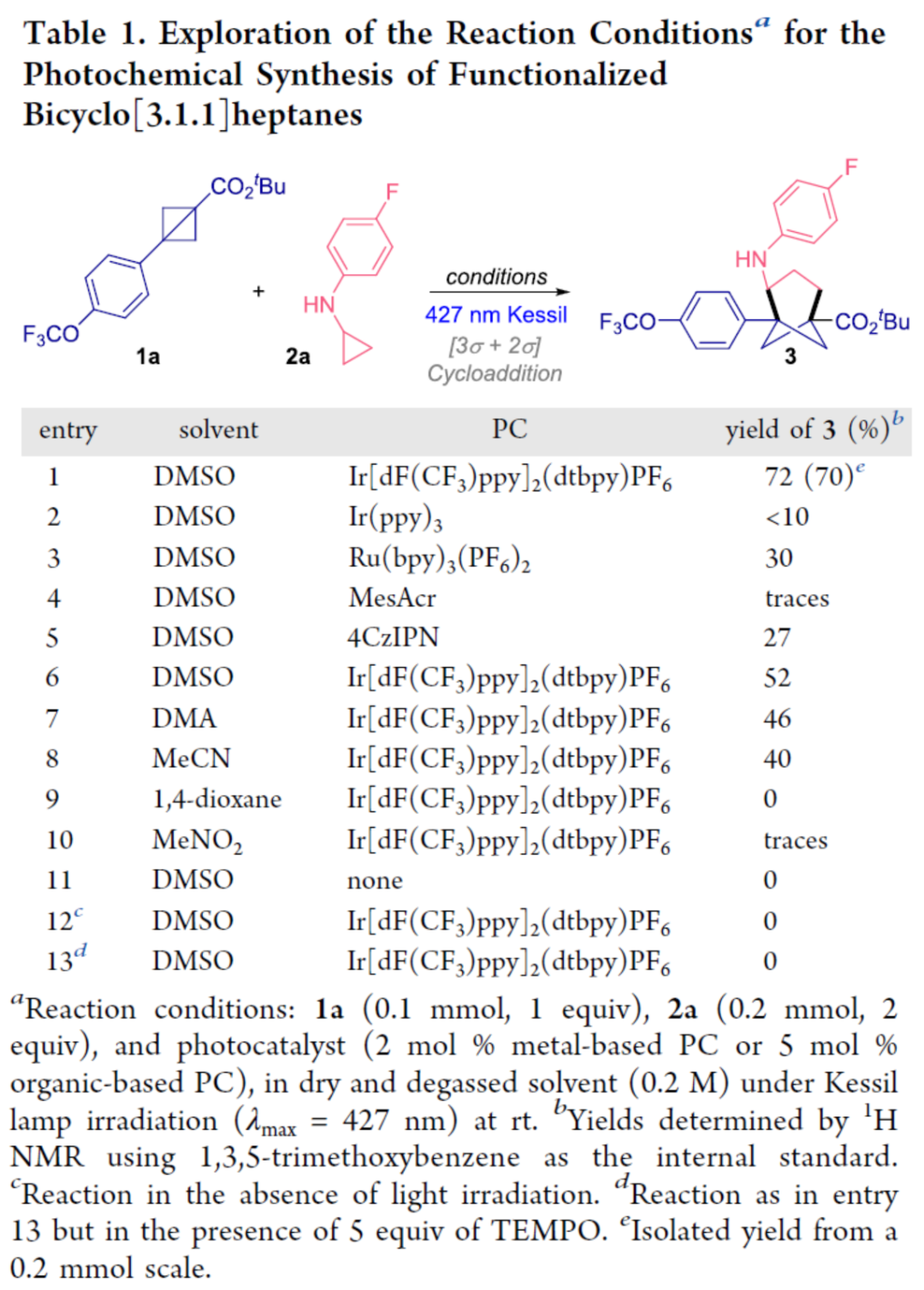
首先,作者以BCB 1a与CPA 2a作为模型底物,进行了相关环加成反应条件的筛选(Table 1)。当以Ir[dF(CF3)ppy]2(dtbpy)PF6作为光催化剂,427 nm Kessil Lamp作为光源,在DMSO溶剂中室温下反应36 h,可以70%的收率得到双环[3.1.1]庚烷产物3。
(图片来源:J. Am. Chem. Soc.)
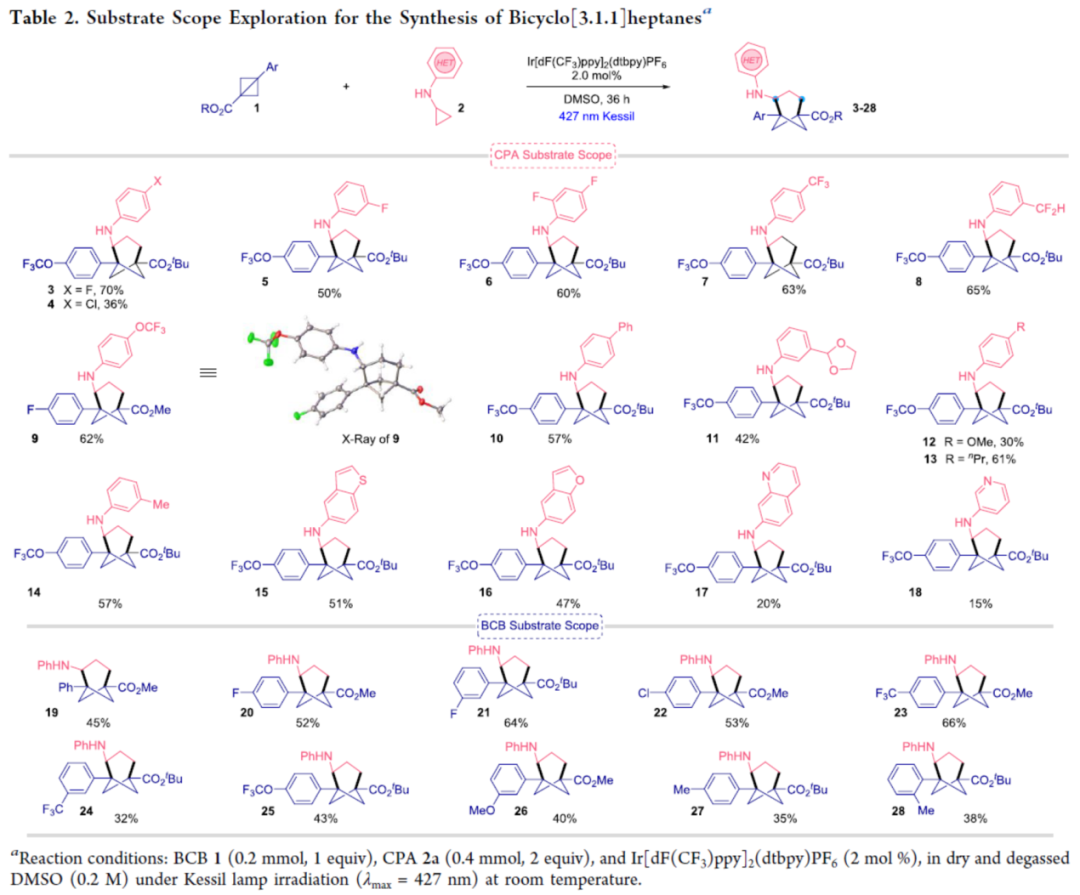
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Table 2)。首先,当底物1中含有不同电性取代的芳基时,均可顺利反应,获得相应的产物3-14,收率为30-70%。同时,当底物1中含有苯并噻吩和苯并呋喃基时,也与体系兼容,获得相应的产物15-16,收率为47-51%。当底物1中含有喹啉和吡啶基时,反应性较差,获得相应的产物17-18,收率为15-20%。其次,当底物2中含有不同电性取代的芳基时,也能够顺利反应,获得相应的产物19-28,收率为32-66%。
(图片来源:J. Am. Chem. Soc.)
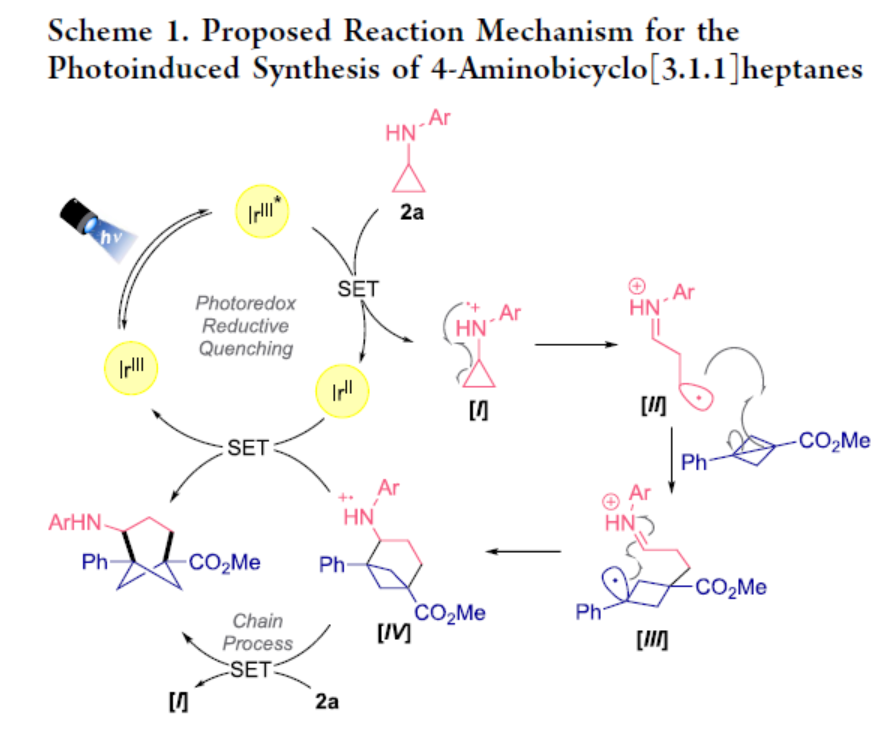
基于前期相关文献的查阅,作者提出了一种可能的催化循环过程(Scheme 1)。首先,IrIII光催化剂通过紫外光照射进行光激发之后,可生成光激发态(IrIII*)。环丙基苯胺(2)的单电子转移可诱导自由基阳离子配合物I的形成,然后通过β-断裂开环生成双离子自由基阳离子(II)。其次,将该反应性的中间体添加到BCB 1中,可生成另一种相对稳定的双离子自由基阳离子,其中自由基位于二级苄基位(III)。随后,配合物(III)经环化后可生成自由基阳离子IV。最后,在还原淬灭光还原循环中,IV可被还原生成IrII配合物。或者,在存在环丙基苯胺2a条件下IV进行还原,从而获得目标产物。此外,通过对这两种反应过程的光化学量子产率研究表明,链传递过程是一个更有可能的机理途径,因为IV还原2a是一个焓驱动的步骤。
(图片来源:J. Am. Chem. Soc.)
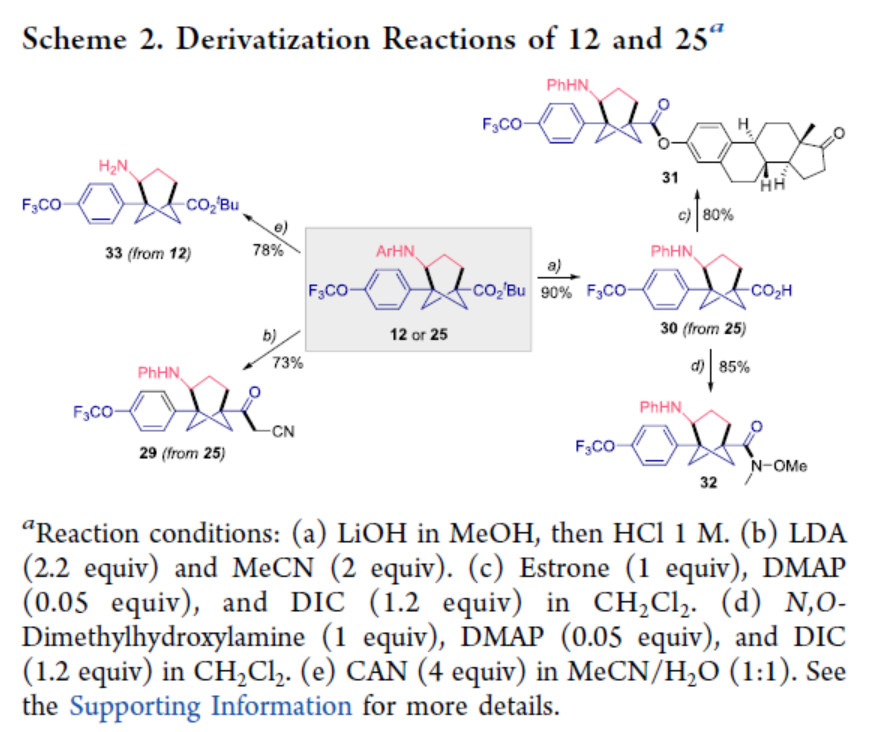
最后,作者对反应的实用性进行了研究(Scheme 2)。首先,25在LDA/MeCN条件下进行官能团化反应,可以73%的收率得到3-氧代丁烷腈29。该官能团单元含有α-亚甲基活性质子,为后期官能团化提供了进一步的机会。其次,25在LiOH/MeOH/HCl条件下进行水解,可以90%的收率得到相应的羧酸化合物30。30与雌酮在DMAP/DIC条件下进行偶联,可以80%的收率得到化合物31。30与N,O-二甲基羟胺在DMAP/DIC条件下进行反应,可以85%的收率得到Weinreb酰胺化合物32,作为合成酮、醛或醇的羰基的前体。因此,游离羧酸30的使用为制备其它生物等排体化合物提供了进一步的机会。最后,12在CAN/MeCN/H2O条件下进行脱保护,可以78%的收率得到氨基化合物33,可作为有趣的氨基酸砌块用于进一步衍生化。
(图片来源:J. Am. Chem. Soc.)
Gary A. Molander课题组开发了一种用于构建4-氨基双环[3.1.1]庚烷的温和、通用且高度实用性的方法。其中,以双环[1.1.0]丁烷和环丙胺为底物,经光诱导的[3σ+2σ]环加成反应,合成了一系列官能团化的新型双环[3.1.1]庚烷衍生物。通过后期的衍生化实验,进一步证明了反应的实用性。总体来说,本文通过光化学[3σ+2σ]环化成反应,能够获得前所未有的由BCBs和CPAs构建的4-氨基双环[3.1.1]庚烷。这些骨架可以作为药物发现和相关领域中有用的间位二取代芳烃生物等排体。
文献详情:





