JACS:可见光诱导能量转移合成多取代2-氧杂双环[2.1.1]己烷
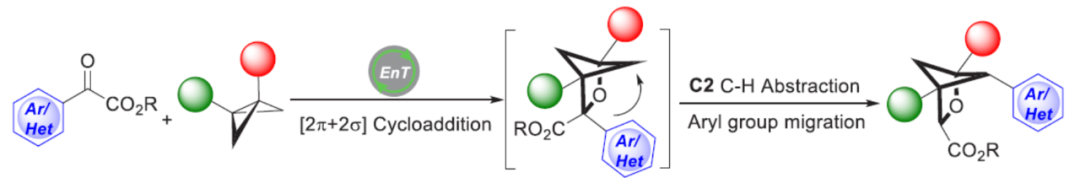
近日,德国明斯特大学Frank Glorius课题组开发了一种可见光诱导三重态能量转移的催化策略,通过易得的苯甲酰甲酸酯与双环[1.1.0]丁烷一步合成了一系列多取代2-氧杂双环[2.1.1]己烷衍生物。同时,该策略涉及形式的[2π+2σ]光环加成反应/攫氢反应(backbone C-H abstraction)/芳基迁移的串联过程。文章链接DOI:10.1021/jacs.2c09248
(图片来源:J. Am. Chem. Soc.)
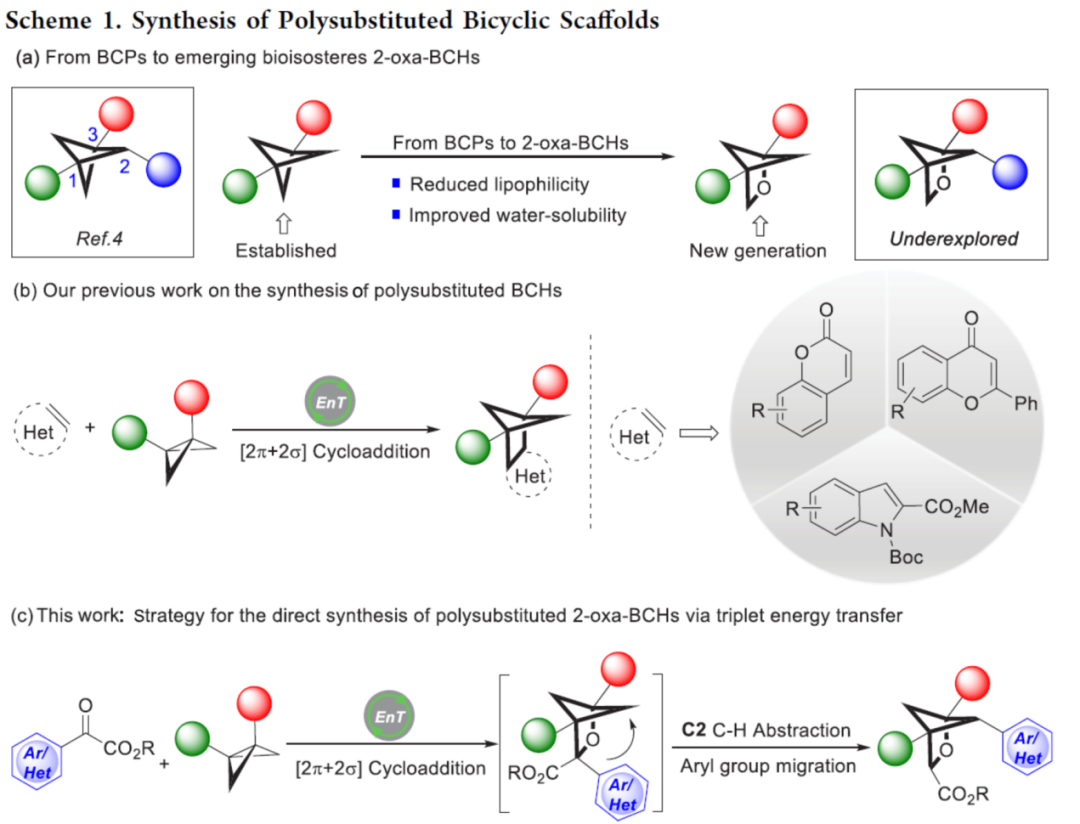
在过去的十年里,将三维骨架引入药物分子中通常会增强生物活性、物理化学性质和代谢特征。因此,化学家们对其合成引起了极大的兴趣。其中,双环[1.1.1]戊烷(BCP)骨架由于其潜在的苯基生物等排性(bioisosterism)而成为深入研究的主题。虽然此类化合物大多数集中于单取代或桥头二取代(C1和C3)BCPs的合成研究上,但秦天课题组开发了一种分子内偶联方法,可用于合成多取代(C1、C2和C3)BCPs,其被认为是备受追捧的邻/间取代苯模拟物(Scheme 1a)。值得注意的是,最近的研究表明,与相应的苯或BCP类似物相比,2-氧杂双环[2.1.1]己烷(2-oxa-BCHs)表现出更高的水溶性、改善的代谢稳定性和降低的亲脂性。因此,2-氧杂双环[2.1.1]己烷衍生物的合成引起了化学家的极大关注。尽管如此,目前大多数的方法主要集中于单/双取代2-oxa-BCHs的合成,对于多取代2-oxa-BCHs的合成则具有挑战。
近年来,[2+2]光环加成是有机合成中最基本的转化之一,可直接且以原子经济的方式构建环状骨架。在这一领域,可见光诱导的能量转移催化由于其温和的反应条件以及出色的选择性,而备受关注。底物在三重激发态下的反应性为有机合成提供了多种机会。虽然化学家已对[2π+2π]光环加成反应进行了很好的研究,但可见光诱导的[2π+2σ]环加成却较少有相关的研究。最近,Glorius课题组报道了一种杂环烯烃与双环[1.1.0]-丁烷(BCBs)的[2π+2σ]光环加成反应,合成了一系列多取代双环[2.1.1]-己烷(BCHs)(Scheme 1b)。近日,德国明斯特大学Frank Glorius课题组开发了一种苯甲酰甲酸酯与BCBs的形式[2π+2σ]光环加成反应,合成了一系列多取代2-oxa-BCHs,涉及三重态能量转移、攫氢反应以及芳基迁移的串联过程(Scheme 1c)。
(图片来源:J. Am. Chem. Soc.)
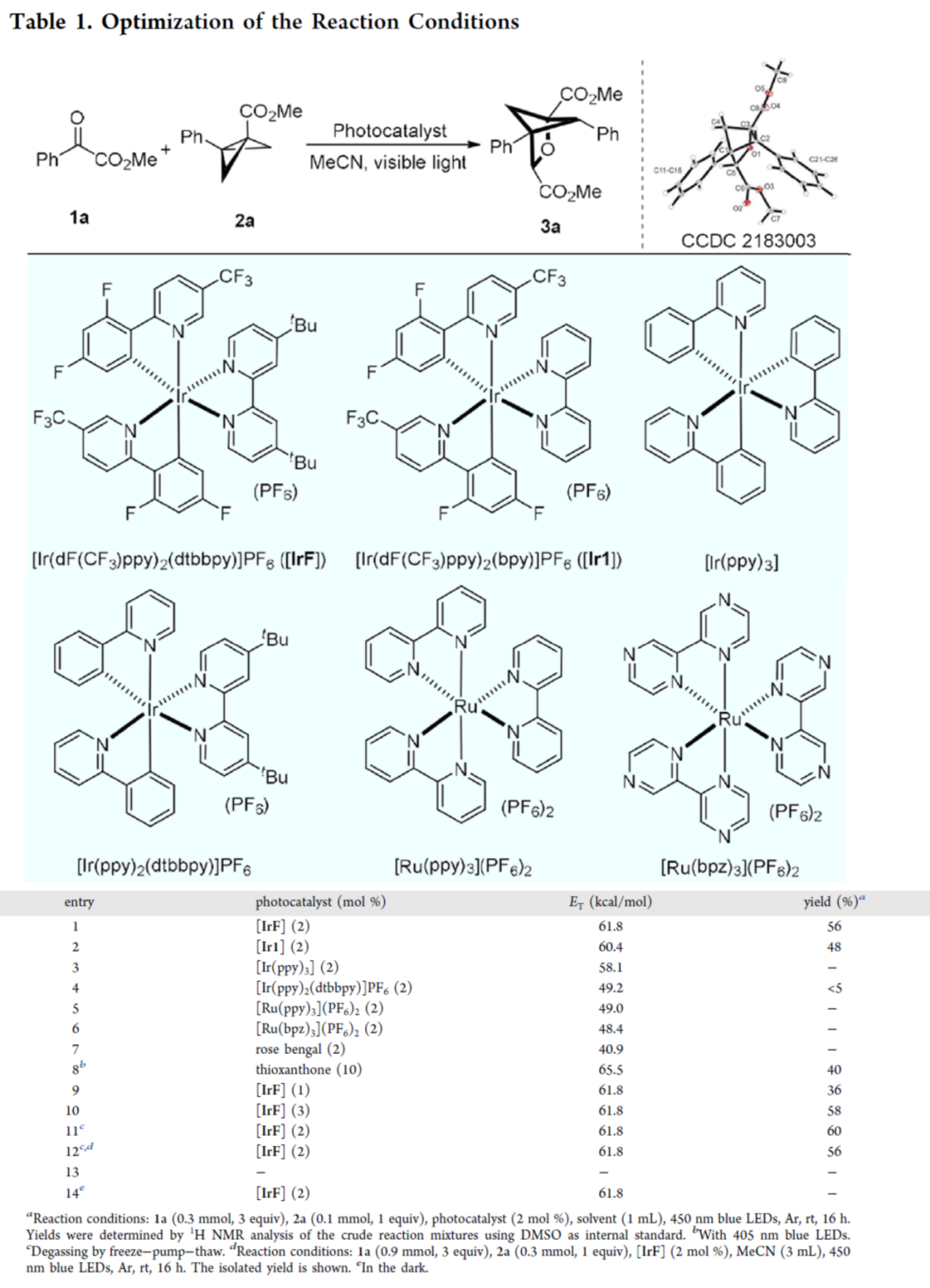
首先,作者以苯甲酰甲酸甲酯1a与BCB 2a作为模型底物,进行了相关反应条件的筛选(Table 1)。当以[Ir(dF(CF3)ppy)2(dtbbpy)]PF6([IrF])作为光催化剂,在MeCN溶剂中于蓝色LEDs(λmax = 450 nm)照射下室温反应16 h,可以56%的收率得到产物3a。
(图片来源:J. Am. Chem. Soc.)
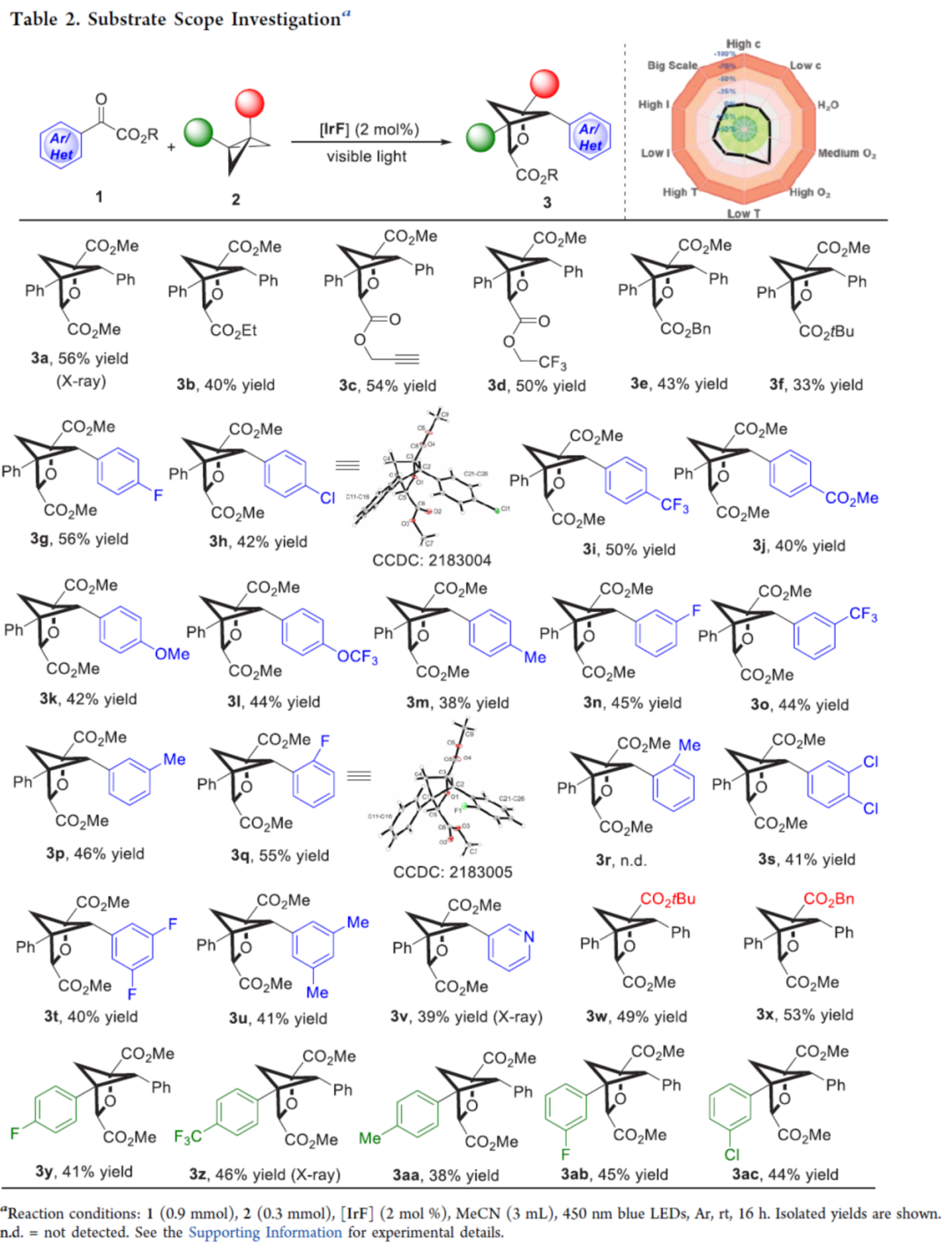
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Table 2)。首先,当底物1中的R为不同的烷基时,均可顺利进行反应,获得相应的产物3a-3f,收率为33-56%。当底物1中的α-取代为不同电性的芳基(除邻位含有甲基取代的芳基)以及吡啶基时,均与体系兼容,获得相应的产物3g-3v,收率为38-56%。其次,当底物2中的-CO2Me改为-CO2tBu与-CO2Bn时,可获得相应的产物3w-3x,收率为49-53%。此外,当底物2中含有不同电性的芳基时,也能够顺利进行反应,获得相应的产物3y-3ac,收率为38-46%
(图片来源:J. Am. Chem. Soc.)
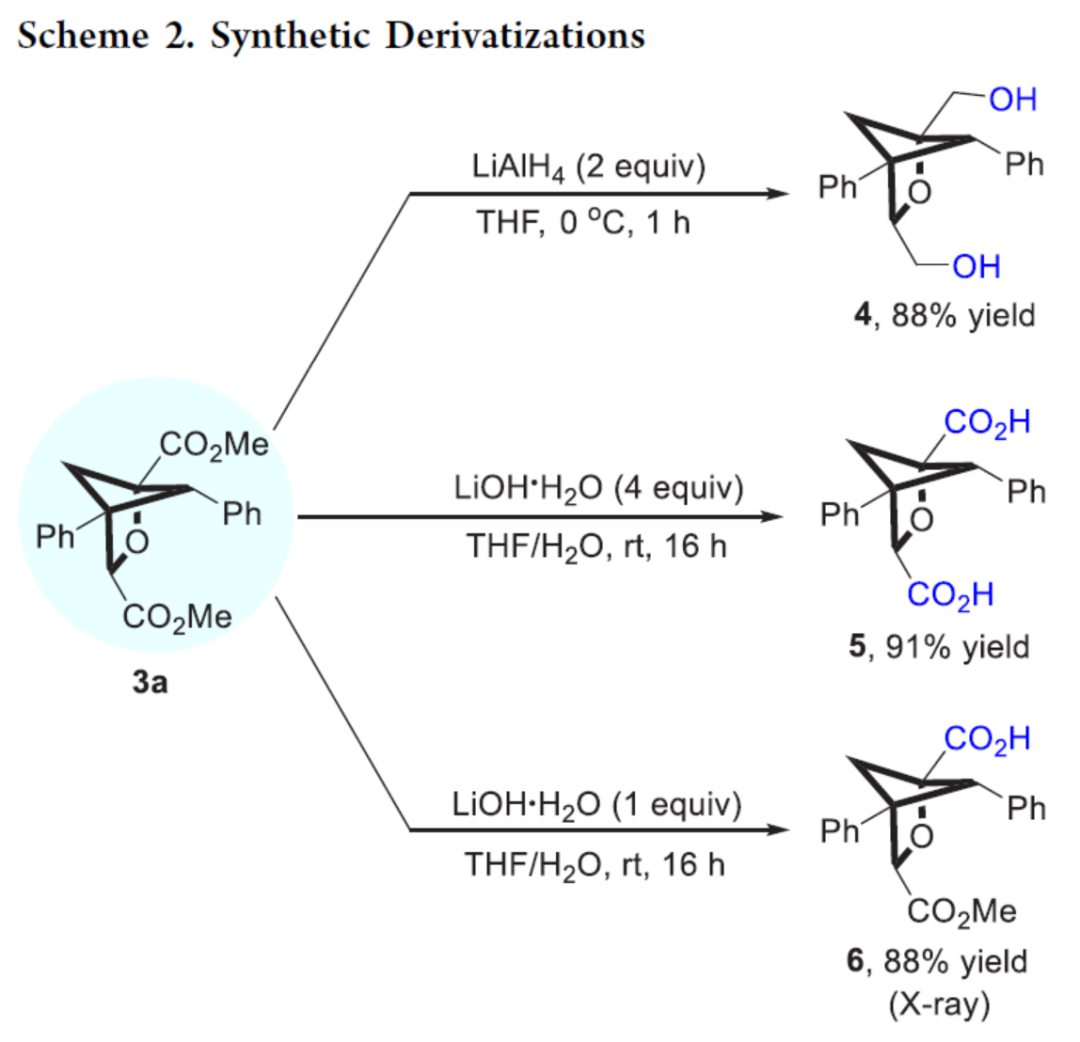
紧接着,作者对反应的实用性进行了研究(Scheme 2)。首先,3a在LiAlH4条件下进行还原反应,可以88%的收率得到二醇化合物4。其次,3a在使用四当量的LiOH·H2O进行水解反应后,可以91%的收率得到二羧酸化合物5。同时,3a在使用一当量的LiOH·H2O进行水解反应时,可以88%的收率得到羧酸化合物6。
(图片来源:J. Am. Chem. Soc.)
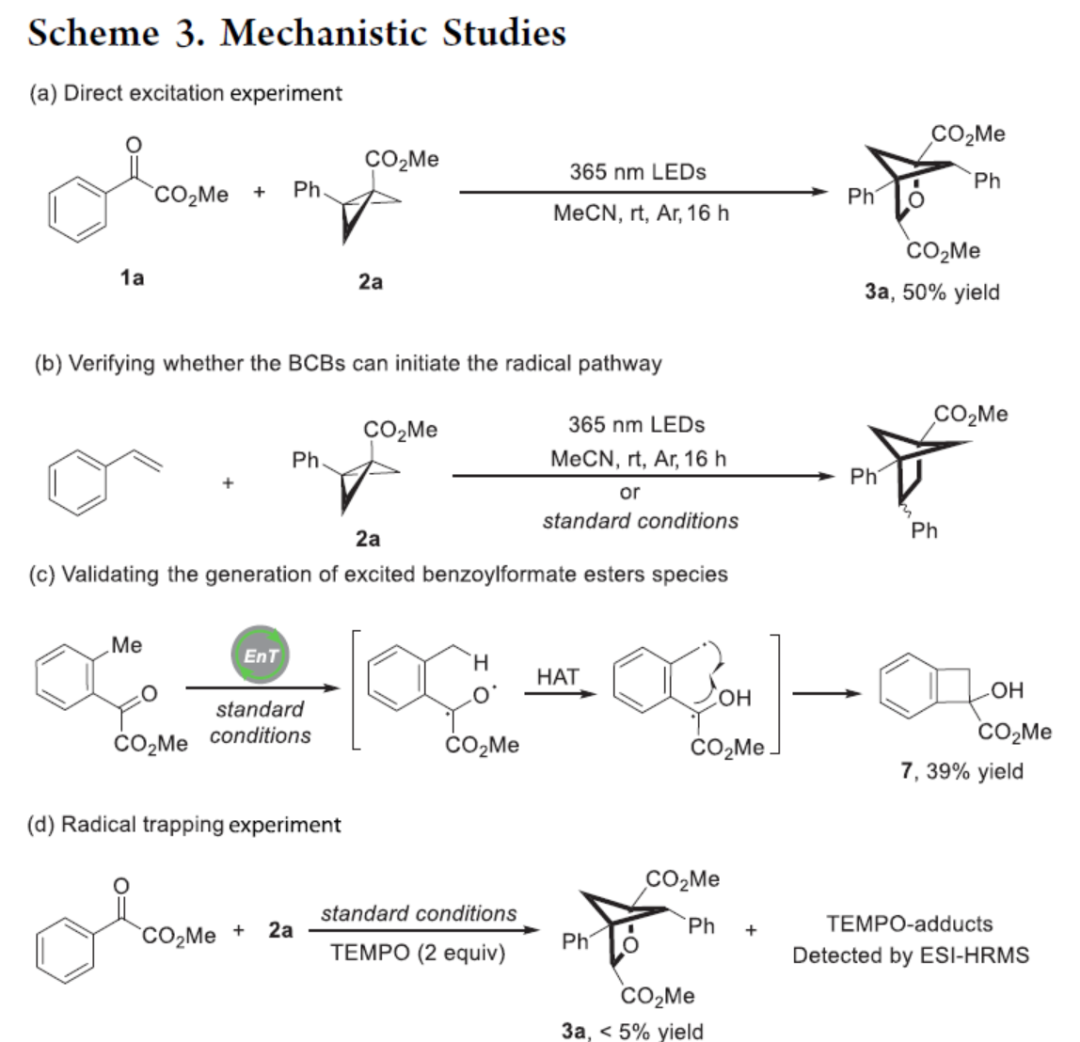
紧接着,作者对反应机理进行了进一步的研究(Scheme 3)。首先,Stern-Volmer淬灭实验表明,两种底物可以相似的速率淬灭激发态光催化剂。CV实验可排除单电子转移过程,因为两种底物的氧化还原电位都超出了激发态光催化剂的范围。UV/vis检测表明,1a和2a之间并未形成电子供体−受体配合物。由于淬灭表明底物和激发态光催化剂之间的相互作用,上述结果支持能量转移机理,并表明两种底物都可以敏化为三重态。其次,1a与2a在365 nm LEDs照射下进行直接激发实验,可以50%的收率得到产物3a(Scheme 3a)。同时,苯乙烯与2a在标准条件下,未能发生反应(Scheme 3b)。上述结果表明,2a可能无法通过自由基途径引发反应。此外,含有邻甲基取代的底物在标准条件下反应时,可以39%的收率得到Norrish II型产物7,从而表明在反应过程中生成激发的苯甲酰甲酸酯(Scheme 3c)。上述这些结果表明,激发的苯甲酰基甲酸酯最有可能启动[2π+2σ]环加成步骤。同时,在1a和2a的标准反应体系中,加入TEMPO时,反应完全被抑制,从而表明反应涉及自由基的历程(Scheme 3d)。
(图片来源:J. Am. Chem. Soc.)
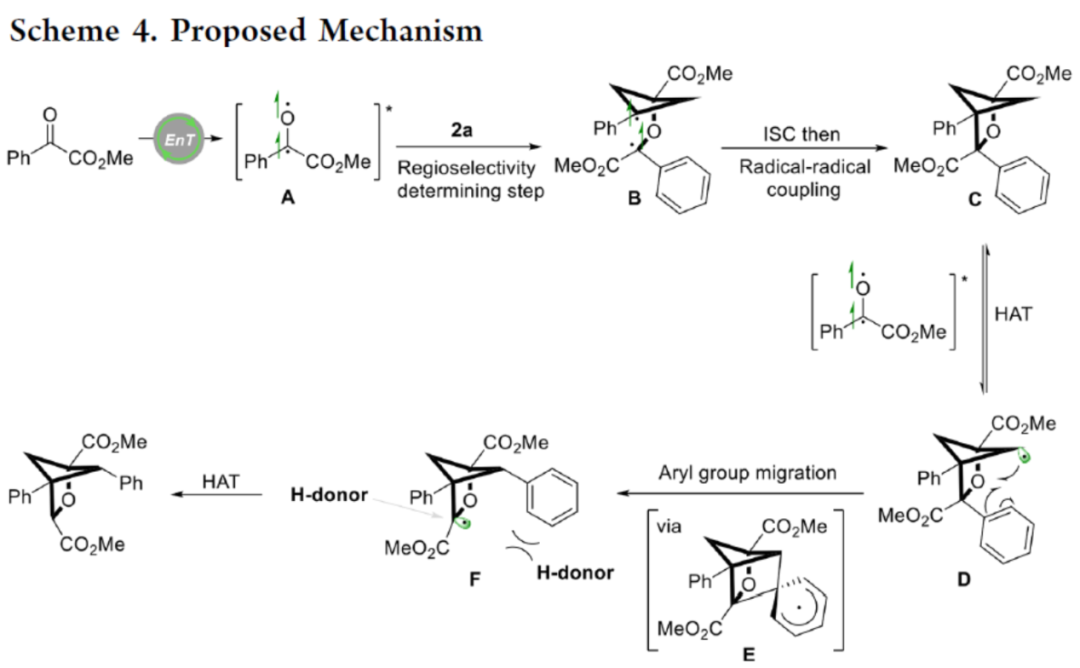
最后,作者提出了一种合理的反应机理(Scheme 4)。首先,从激发态光催化剂*[IrIII]到苯甲酰甲酸酯的能量转移生成配合物A,A与2a反应生成更稳定的双自由基配合物B,作为区域选择性决定步骤。随后,B经系间窜越(Intersystem crossing)与自由基-自由基偶联,生成中间体C。C与激发配合物A通过HAT过程,生成自由基中间体D。D经芳基迁移,可生成更稳定的自由基配合物F,涉及中间体E的形成。最后,由于芳基在骨架位置的空间效应,氢供体可以从空间位阻较小的位置进攻配合物F,从而获得最终的产物。
(图片来源:J. Am. Chem. Soc.)
德国明斯特大学Frank Glorius课题组开发了一种可见光诱导三重态能量转移的催化策略,通过易得的苯甲酰甲酸酯与双环[1.1.0]丁烷一步合成了一系列多取代2-氧杂双环[2.1.1]己烷衍生物。同时,该策略涉及形式的[2π+2σ]光环加成/攫氢反应/芳基迁移的串联过程。其次,该反应具有反应条件温和、底物范围广泛、官能团兼容性高等特点。此外,通过后期的衍生化实验,可分别获得二醇、二羧酸和单羧酸修饰的2-oxa-BCH砌块,从而进一步证明了反应的实用性。





