镍/光氧化还原催化氮杂环丙烷与缩醛C(sp3)-C(sp3)偶联
近日,美国普林斯顿大学的Abigail G. Doyle教授课题组报道了一种在光/镍协同催化体系下,氮杂环丙烷与芳基缩醛之间的C(sp3)-C(sp3)交叉偶联反应。反应中两种烷基偶联底物的正交活化模式有助于实现优异的交叉选择性。其中苯甲醛二烷基缩醛通过HAT过程实现β-碳氧键断裂活化,而氮杂环丙烷通过对还原性Ni物种的氧化加成实现活化。作者还通过化学计量的金属有机实验和线性自由能关系等研究,证明了氮杂环丙烷的活化步骤是以一种独特的对Ni(I)氧化加成路径进行的。
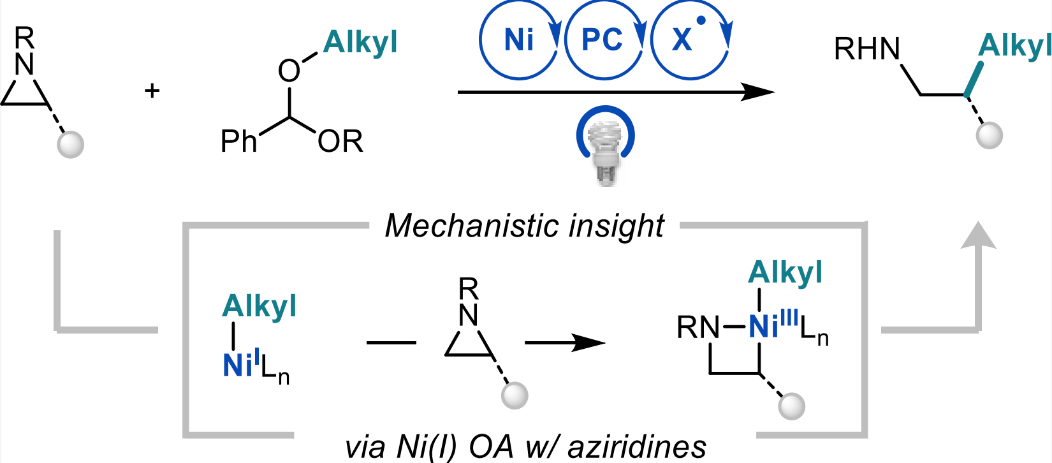
图1. 光/镍协同催化氮杂环丙烷与缩醛C(sp3)- C(sp3)偶联(图片来源:J. Am. Chem. Soc.)
使用两种不同碳亲电试剂进行选择性交叉偶联,已成为构建C-C键的重要策略。近年来,镍催化(拟)卤代物的C(sp3)-C(sp2)交叉亲电偶联取得了众多进展(图2A)。机理研究表明这些镍催化还原偶联反应的交叉选择性主要依赖于两种亲电底物的杂化形式和电性差异,从而产生不同活化机制。然而,对于两种反应性只有细微差异的C(sp3)亲电底物,如何实现其选择性交叉偶联依然没有通用的解决方案。最近在这一领域,使用镍或铜催化,通过化学计量还原剂或电化学条件实现交叉还原偶联取得了一定进展,这些方法通常依赖于底物的当量比、(拟)卤代物的差异或碳中心的空间位阻效应差异来实现选择性。光催化氧化还原可以实现两种烷基偶联底物的独立活化机制,目前已成为控制其选择性偶联的有效策略。
氮杂环丙烷已被人们广泛用作交叉偶联反应中的C(sp3)亲电试剂,前期的一些工作表明,通过氮杂环丙烷参与的偶联反应可以获得多取代乙胺产物,这是药物化学中重要的含氮片段。一些金属亲核试剂,如有机锌和有机硼试剂已被用于与氮杂环丙烷进行交叉偶联,用于构建C(sp3)-C(sp2)键和C(sp3)-C(sp3)键。作者此前也发展了使用化学计量还原剂或光催化还原体系用于氮杂环丙烷与芳基碘化物的交叉亲电偶联(J. Am. Chem. Soc. 2017, 139, 5688)。与其它交叉偶联反应一样,这些方法也是通过偶联底物的差异性实现其选择性。然而,由于烷基卤代物和氮杂环丙烷在镍催化还原偶联中相似的反应性,无法直接发展两者的选择性交叉亲电偶联 (图2B)。基于此,作者提出可以使用与氮杂环丙烷氧化加成的活化模式不同的烷基偶联底物进行C(sp3)-C(sp3)选择性偶联。
在前期的研究基础上,作者报道了一种氧化还原中性镍/光协同催化氮杂环丙烷的烷基化反应 (图2C)。该方法能实现一系列β-取代磺酰胺类化合物的合成,这些化合物此前无法通过传统的涉及氮杂环丙烷的交叉偶联反应获得。该反应中,苯甲醛二烷基缩醛是另一C(sp3)偶联底物,其在氧化过程中通过C(sp3)-O键断裂实现活化,这与氮杂环丙烷的活化模式正交。这种相互独立的活化机制可以实现两种底物反应速率的灵活调控,以最易于改变的反应参数(如光强度)实现交叉选择性。
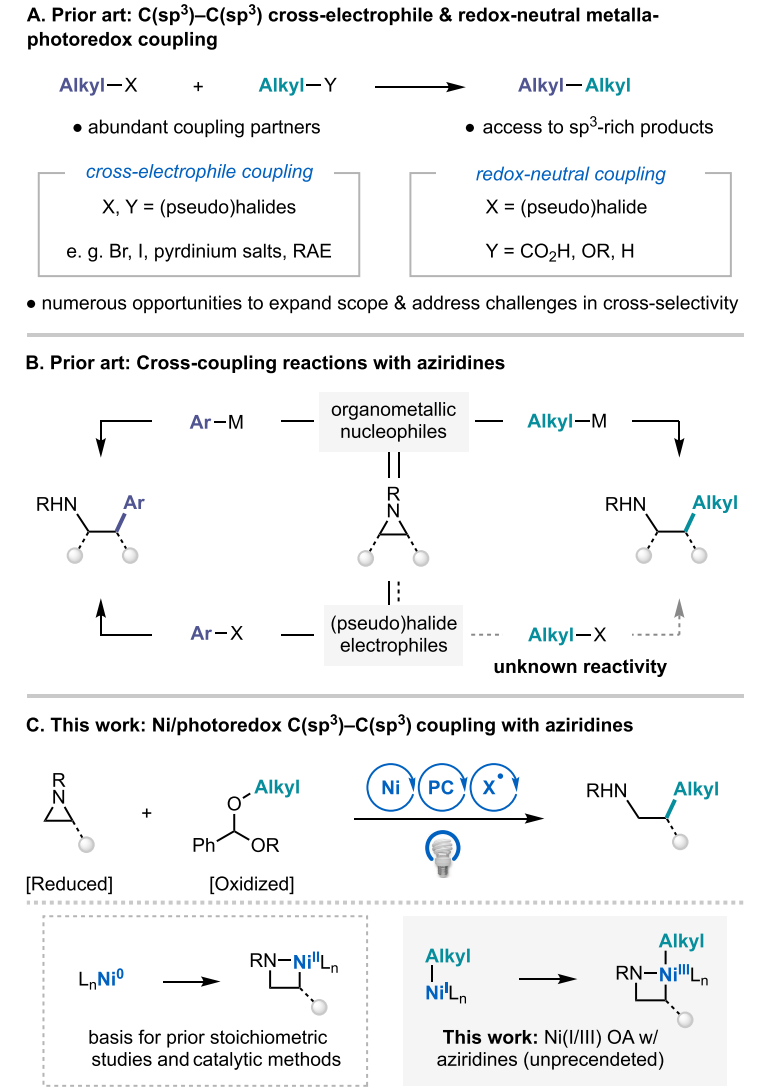
图2. C(sp3)前体的亲电偶联与光催化偶联(图片来源:J. Am. Chem. Soc.)
首先,作者以2-(4-氟苯基)-1-(对甲苯磺酰基)氮杂环丙烷(1a)和苯甲醛二甲基缩醛(2a)作为交叉偶联前体进行反应条件优化。作者基于此前开发的方法,探索了以卤化物盐作为氢原子转移(HAT)过程中的卤素自由基前体。当使用2.5 mol% Ni(cod)2、5 mol% NH4Br (E1/2[Br–/Br·] = + 0.80 V vs SCE, DCE溶液中)以及2 mol% Ir[dF(Me)ppy]2(dtbbpy)PF6(IrII/IrIII* = + 0.97 V vs SCE, MeCN溶液中),在25 °C 下,使用427 nm 蓝光照射,能以22% 的产率获得所需交叉偶联产物3a。通过对缩醛的当量、溴源、镍催化剂以及温度等反应参数进行详细优化,最终发现以NiBr2·glyme为催化剂,LiBr为溴源,使用2.4当量的缩醛为底物时能以82%的最优收率得到产物3a。
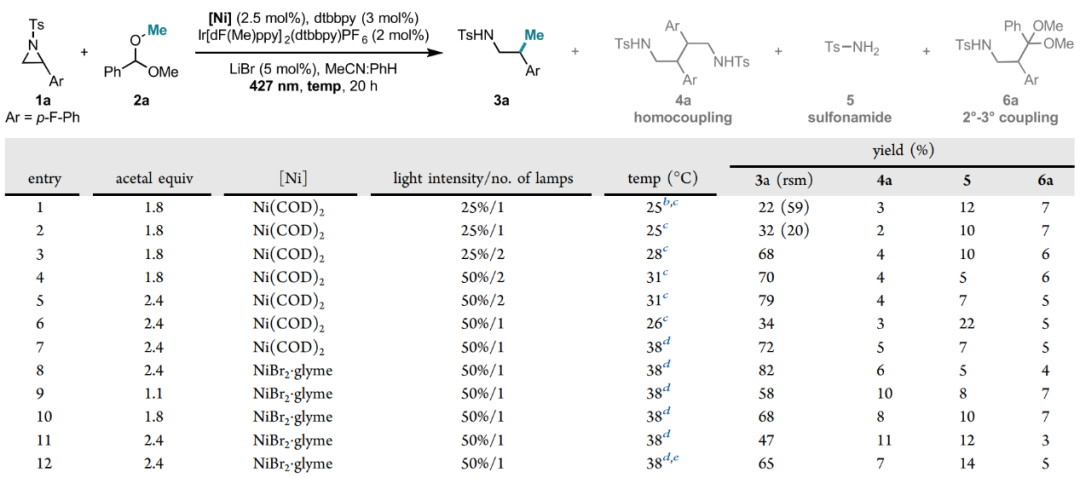
图3. 反应条件优化(图片来源:J. Am. Chem. Soc.)
作者首先在优化的反应条件下研究了使用苯甲醛二甲基缩醛作为甲基化试剂与各种氮杂环丙烷反应的底物适用范围。如图4所示,众多苯基取代氮杂环丙烷均适用于此反应。含缺电子基底物如p-CF3 (3b)与p-CN (3c)分别以77%和50%的产率得到β-甲基化磺酰胺产物。芳环上取代的苯基氮杂环丙烷 (3d) 以及带有给电子基如p-t-Bu (3e) 和p-OPh (3f) 的底物也能以良好的产率得到甲基化产物。该反应对芳环上的空间位阻效应不敏感,3g能以59%的产率获得。芳基 (3h-3k)、苄基 (3l,3m) 和烷基磺酰胺,如甲磺酰胺 (3n) 和环丙基磺酰胺(2o),均能顺利完成此转化。未取代的氮杂环丙烷也分别以75%和76%的产率得到氘甲基和甲基化产物3p和3q。而脂肪族氮杂环丙烷在标准反应条件下或延长反应时间均不能以较好的收率得到产物3r。
随后,作者进一步探索了缩醛底物的适用范围。氘甲基 (3s) 以及一些其它非活化烷基,如乙基 (3t)、正丙基 (3u)、正戊基 (3v)、异戊基 (3w)以及含刚性骨架乙基 (3x),能以49-83% 的产率得到目标烷基化产物。此外,β-取代的烷基底物如新戊基 (3y) 也适用于此反应。值得注意的是,亚甲基环丁基能以51% 的产率得到 3z,其中直接交叉偶联产物3z1和自由基开环末端烯烃产物3z2比例为3:1。一些含氮烷基,如邻苯二甲酰亚胺(3aa) 和哌啶(3ab),含醚 (3ac)和硅烷基 (3ad) 的烷基偶联底物也能以良好的收率完成此转化。
在此前有关Negishi偶联反应的报道中,氮杂环丙烷与仲烷基之间的偶联是难以发生的。而在此反应中,作者使用5, 5′-二氟-2, 2′-联吡啶代替dtbbpy作为配体,则成功实现了氮杂环丙烷与仲烷基底物之间的交叉偶联。环状和非环状仲烷基均能完成此反应 (3ae-3ag),当使用异丙基缩醛作为偶联底物时,能得到支链和直链丙基比例为1:1.5的混合交叉偶联产物(3ah)。
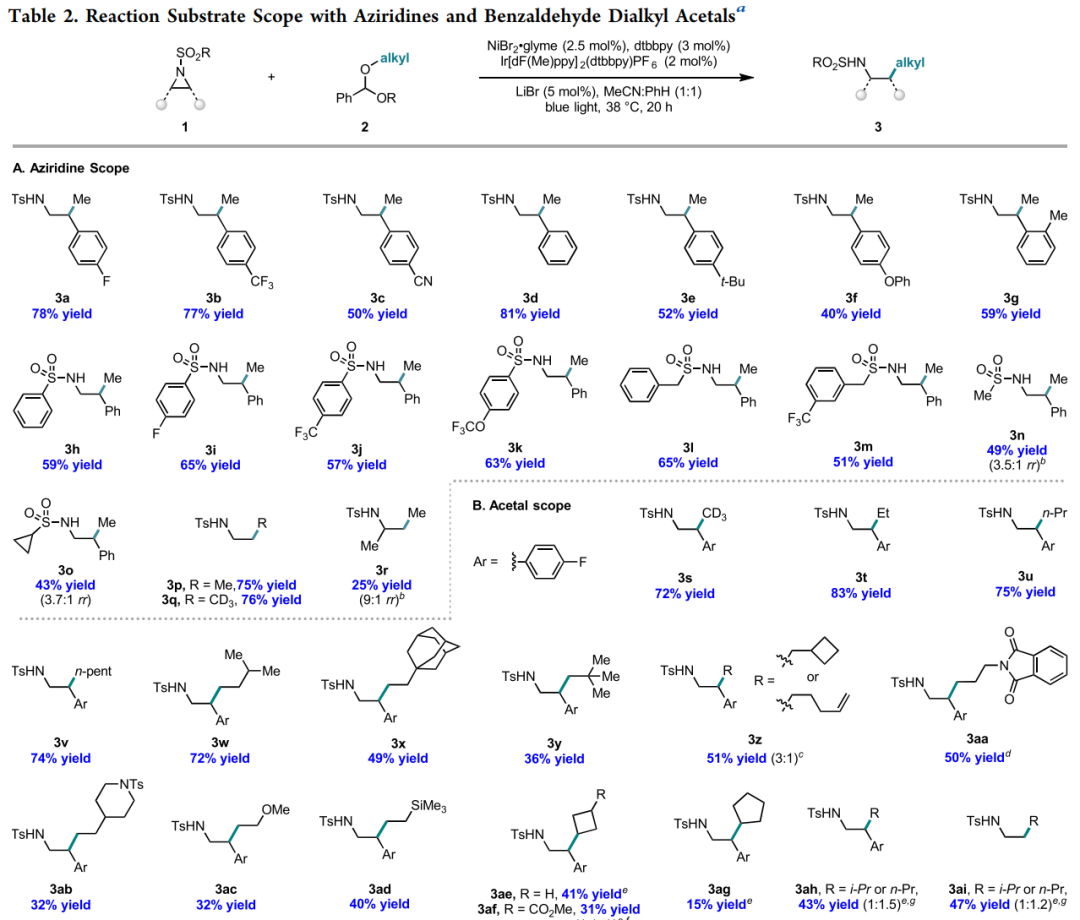
图4. 底物普适性研究(图片来源:J. Am. Chem. Soc.)
当使用一些含活性C-H键的常见溶剂作为该反应的溶剂时,作者发现氮杂环丙烷会直接发生溶剂分子C(sp3)-H的烷基化。例如,使用甲苯和THF作为烷基化试剂,而非使用苄基醇或四氢呋喃醇,能分别以50%和66%的产率得到3aj和3ak (图5)。
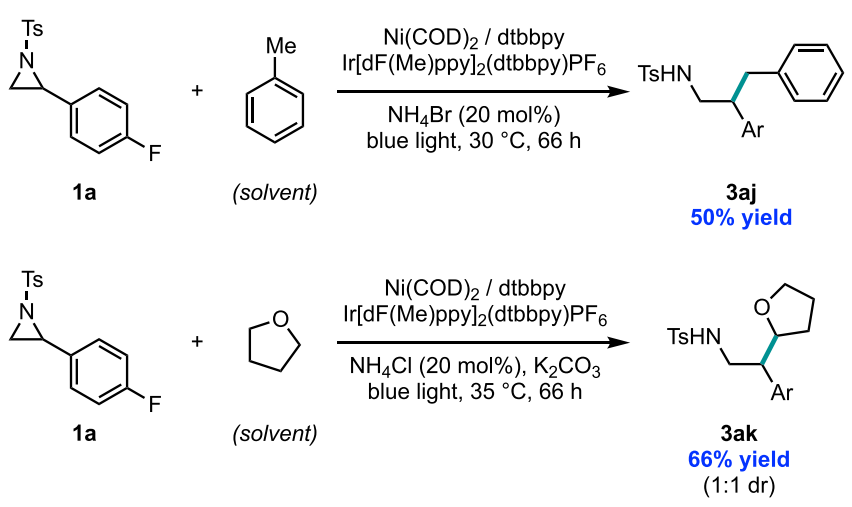
图5. 氮杂环丙烷对C(sp3)-H的插入实现烷基化(图片来源:J. Am. Chem. Soc.)
此前的研究已经证实了氮杂环丙烷可以对Ni(0)进行氧化加成,由此得到的Ni(II)氮杂金属环被认为是涉及氮杂环丙烷交叉偶联反应中的中间体物种。因此,作者最初推测在此反应也是通过Ni(0) 氧化加成以生成Ni(II)氮杂金属环II,其随后捕获烷基自由基以生成Ni(III)物种,最后还原消除得到目标产物。由于溶液中存在Br-的催化作用,Ni(0)也可能通过与原位生成的中间体7进行氧化加成得到Ni(II)物种 (图6A)。
然而,在使用非环仲烷基偶联底物进行反应时,会同时生成直链和支链异构体,这与上述途径明显相悖。由于异构化需要一个空的配位位点和一个寿命相对较长的中间体,β-H消除和再插入在低价Ni(I)中心应该更为有利,而非上述Ni(III) III物种。存在Ni(I)烷基物种VI则意味着氮杂环丙烷的活化是通过Ni(I)-Ni(III) 氧化加成进行的,这是在涉及氮杂环丙烷的反应中未有过的先例 (图6B)。
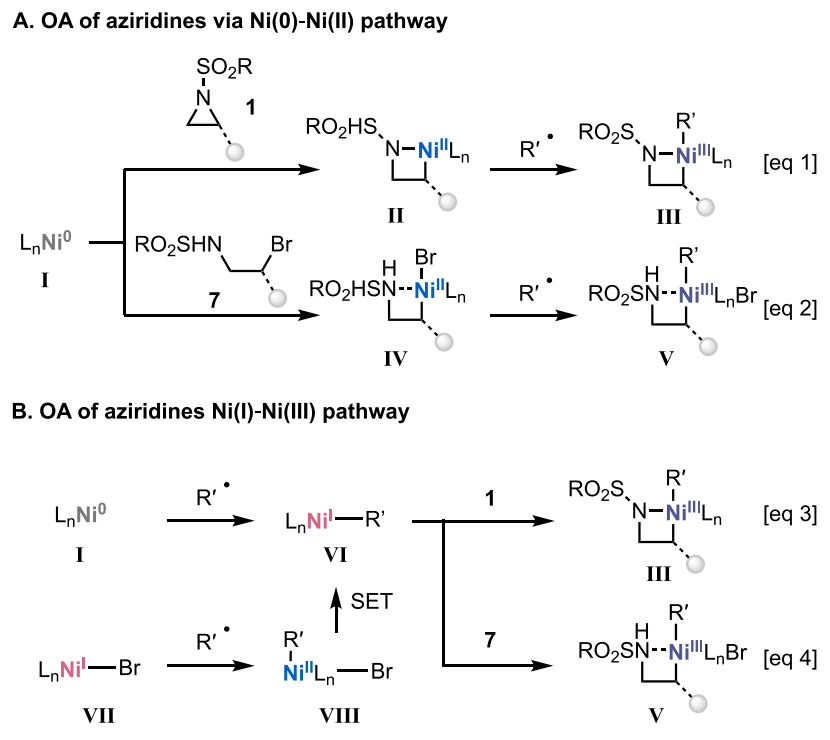
图6. 可能的反应路径(图片来源:J. Am. Chem. Soc.)
为了揭示氮杂环丙烷活化的机理,作者首先合成了Ni(II)氧化加成络合物IIa,其在标准反应条件下的化学计量反应并没有生成目标产物。随后,通过使用4-三氟甲基苯基氮杂环丙烷1b作为底物,在10 mol% 氮杂金属环IIa作为唯一的镍催化剂源条件下进行反应,作者发现来自IIa (3a) 的产物不足1%,而来自1b的产物的产率为32% (图7)。此外,在反应过程中的原位光谱监测中也未观察到IIa的信号。
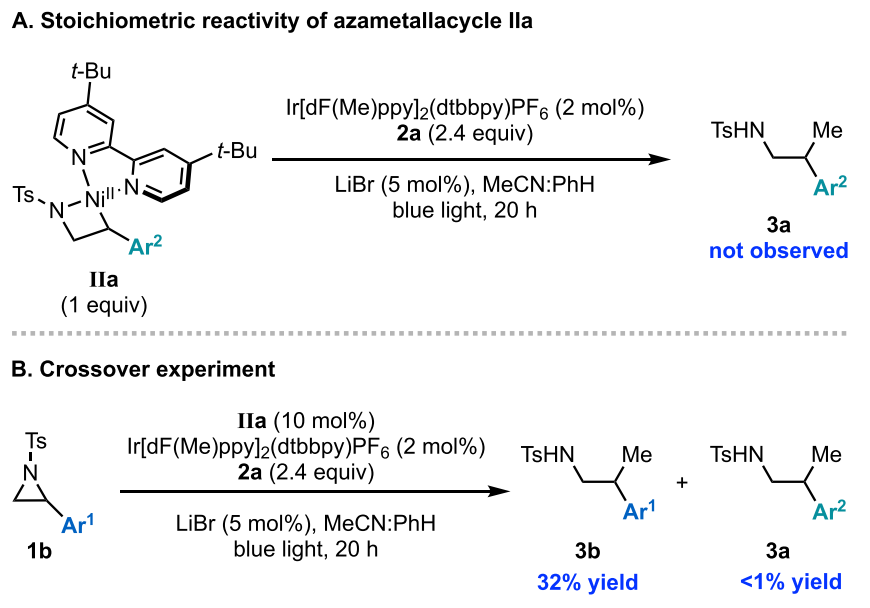
图7. 交叉实验以及金属中间体IIa的反应性研究(图片来源:J. Am. Chem. Soc.)
随后,作者又研究了图6中涉及苄基溴中间体7的可能反应路径。当直接苄基溴化合物7a进行反应时,仅产生1%的产物。大部分底物7a转化为二聚体4a和还原的氮杂环丙烷8。当在氮杂环丙烷1b存在下添加催化量7a进行反应时,观察到1.6%源自7a的产物,而源自1b的产物能以51%收率获得 (图8)。
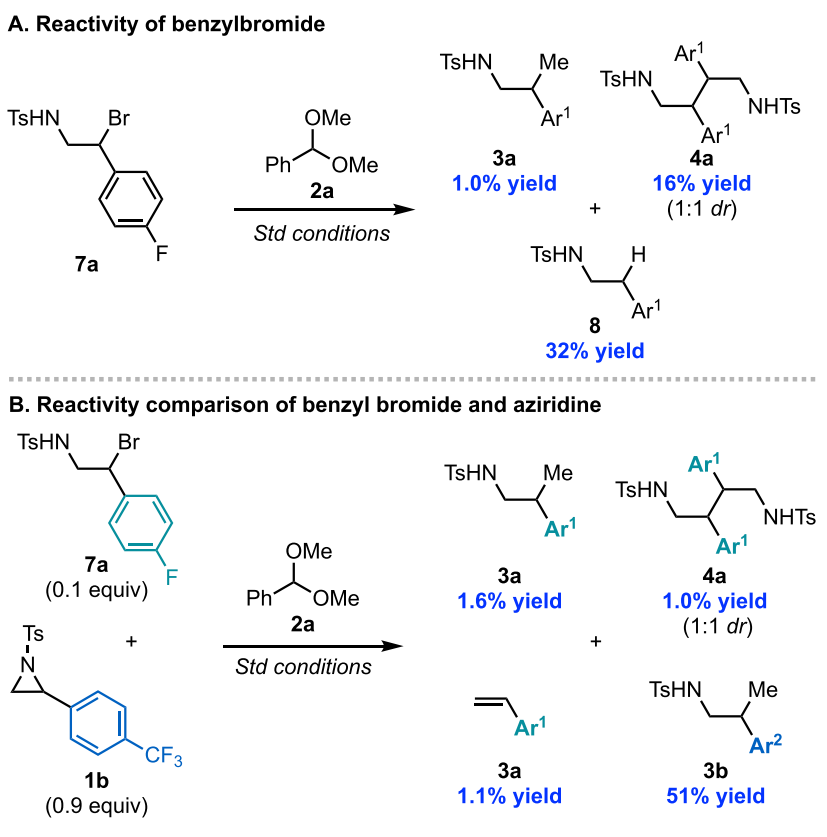
图8. 苄基溴化合物7a的反应性(图片来源:J. Am. Chem. Soc.)
综上所述,这些实验结果与Ni(I)与氮杂环丙烷氧化加成的途径最为一致。因此作者期望寻找出能支持此路径的直接实验证据。然而可分离的dtbbpy-Ni(I)烷基络合物无法合成。Martin课题组此前在对CO2在Ni(I)上的反应性研究中,报道了(均三甲基菲咯啉)Ni(I)(CH2-t-Bu) VI的合成(J. Am. Chem. Soc. 2020, 142, 10936)。因此,作者尝试以此为替代测试该Ni(I)烷基络合物与1a的氧化加成反应性。作者首先验证了使用均三甲基菲咯啉(L2)代替dtbbpy(L1)也能得到类似的结果,随后开始了化学计量反应实验 (图9)。VI可通过L2Ni(I)Br与新戊基溴化镁反应原位制备,再加入氮杂环丙烷1a,成功得到了11%的交叉偶联产物3y和28%的烯酰胺产物9。在确定了Ni(I)中间体的催化相关性后,作者尝试使用手性底物,进一步了解Ni(I)物种发生后续氧化加成的机理。通过将氮杂环丙烷对映体(R)-1d (99% ee)置于标准反应条件进行反应,最终获得的3d为完全外消旋产物 (图10)。
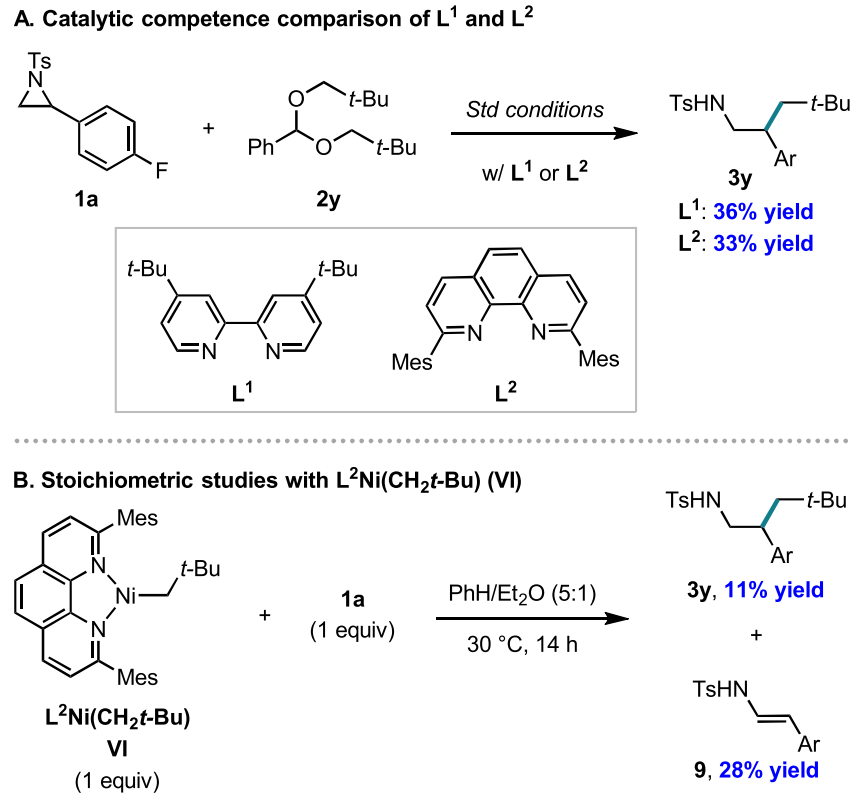
图9. Ni(I) 络合物VI的反应性(图片来源:J. Am. Chem. Soc.)
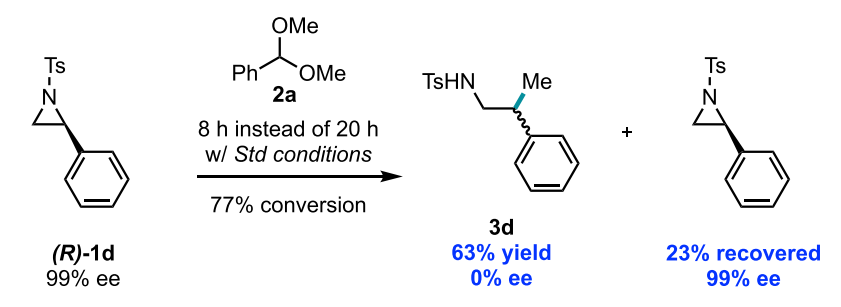
图10. 反应的对映选择性研究(图片来源:J. Am. Chem. Soc.)
最后,作者进行了Hammett分析用于探究氮杂环丙烷的取代基对甲基化相对速率以及与异丙基缩醛2ah烷基化产物的支链/直链比率的影响(图11)。氮杂环丙烷底物的两个位点被分别研究,即苯磺酰胺和苄基芳烃。当苯磺酰胺上的取代基发生变化时,可以观察到log[(b/l)k]/[(b/1)H] 与正ρ值具有高度线性相关性(R2 = 0.98,ρ = 1.1)。正值但相对较低的斜率表明磺酰胺上的吸电子基团能加速氧化加成。类似的实验表明苄基芳烃的取代基对氧化加成速率的影响可以忽略不计。通过改变磺酰胺上的芳烃和苄基上的芳烃时获得的不同ρ值,结合偶联反应的立体化学过程的结果,表明这与单电子转移氧化加成最为一致,即Ni(I)还原氮杂环丙烷生成Ni(II)-磺酰胺络合物和苄基物种,随后快速插入苄基得到Ni(III)物种。
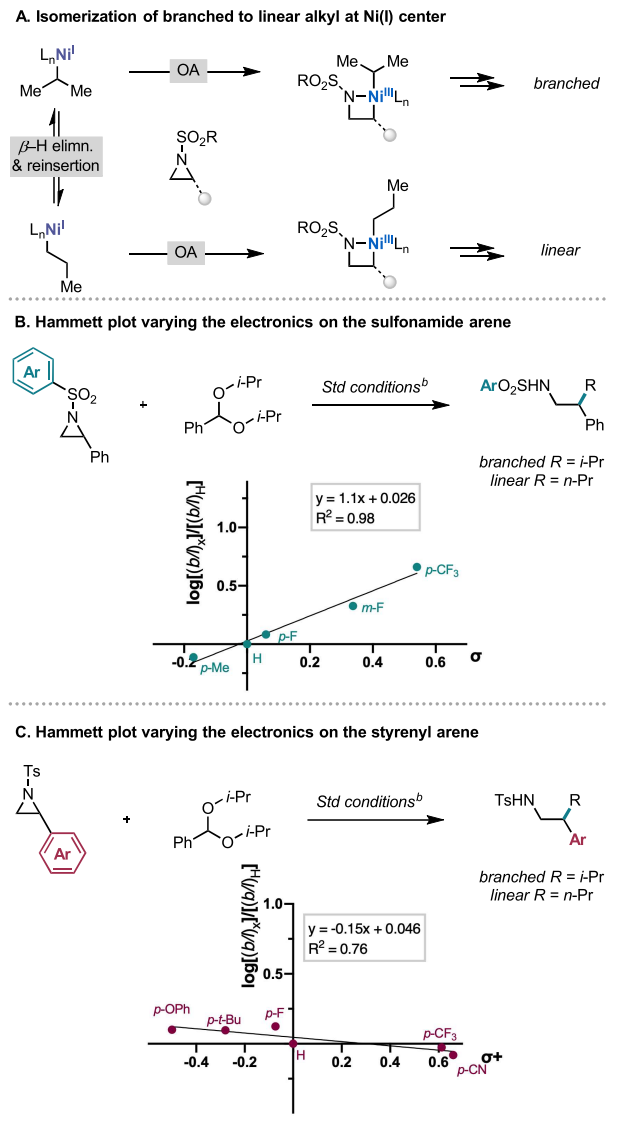
图11. Hammett分析(图片来源:J. Am. Chem. Soc.)
基于上述机理研究,作者提出以下可能的反应路径(图12)。首先在蓝光照射下,激发态的Ir光敏剂氧化Br-, 生成的溴自由基攫取苯甲醛二烷基缩醛的苄位氢原子,然后发生β-碳氧键断裂得到烷基自由基。与此同时,通过Ir(II)将NiBr2·glyme还原为Ni(0)物种I,以进入Ni催化循环。在该循环中,首先捕获β-碳氧键断裂产生的烷基自由基,以提供Ni(I)-烷基物种VI,也可以通过先生成烷基-Ni(II)-Br中间体VIII,然后经历SET过程以生成相同的Ni(I)-烷基中间体VI。基于前期化学计量实验、催化和光谱监测,作者提出Ni(I)-烷基中间体VI通过单电子转移机制氧化加成到氮杂环丙烷上得到Ni(III) III络合物,最后发生还原消除得到交叉偶联产物,并再生Ni(I)物种VII。VII被光敏剂还原态Ir(II)还原为Ni(0),完成催化循环。
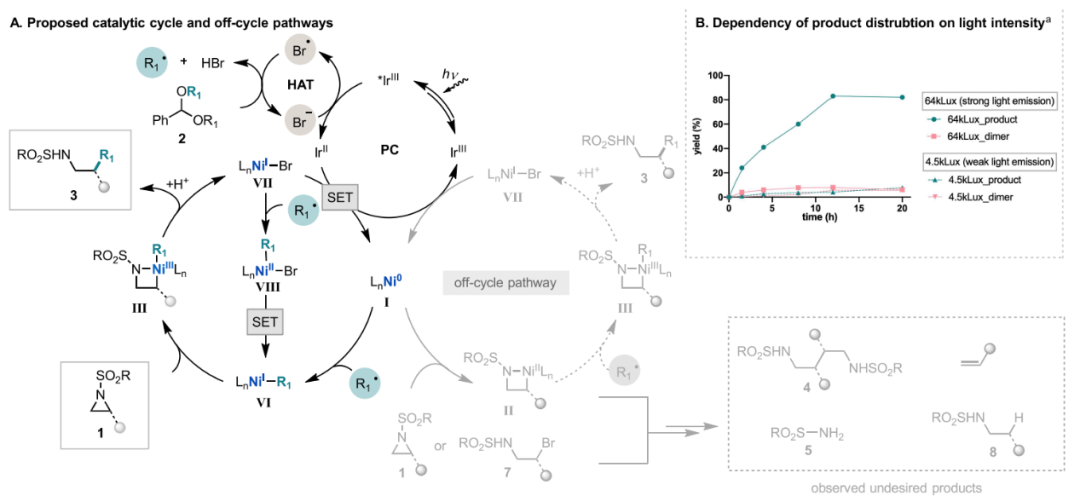
图12. 可能的反应机理(图片来源:J. Am. Chem. Soc.)
Abigail G. Doyle课题组开发了氮杂环丙烷与苯甲醛二烷基缩醛之间的C(sp3)-C(sp2) 选择性交叉偶联反应。两种偶联组分的正交活化模式赋予了两种C(sp3)偶联前体之间的优异交叉选择性。不同于此前报道的氮杂环丙烷与Ni(0)氧化加成路径,机理研究表明在该反应中氮杂环丙烷的活化是通过Ni(I)-Ni(III)氧化加成实现的。这种新型机理的研究揭示了非常规C(sp3)前体的独特活化模式,为发展新型交叉偶联反应提供了理论依据。
文献详情:





