单体光催化剂催化的烯烃的α-酰化反应
烯烃的双官能团化反应是最高效的构建两个相邻官能团的方法之一,它具有操作简单,步骤简便的有点。比如,烯烃的酰化双官能团化反应特别是对于β位选择性的酰化反应,最成熟的是使用催化自由基继电器。对于α位选择性的酰化双官能团化反应,烯烃β位上的自由基加成是优先的,因此,酰基前体的激活再与烷基自由基偶联是至关重要的。目前,科学家们已经开创了两种方法,一种是过渡金属催化的烯烃分子间选择性羧化反应,其中烷基被酰基金属络合物捕获。另一种是N-杂环卡宾催化,其中来自醛或芳酰基氟化物的酮基使自由基−自由基与烷基发生偶联。在没有过渡金属或NHC催化剂的情况下,瞬时烷基和酰基的背景产物交叉混合总是不可避免的,因此使转化相当具有挑战性。
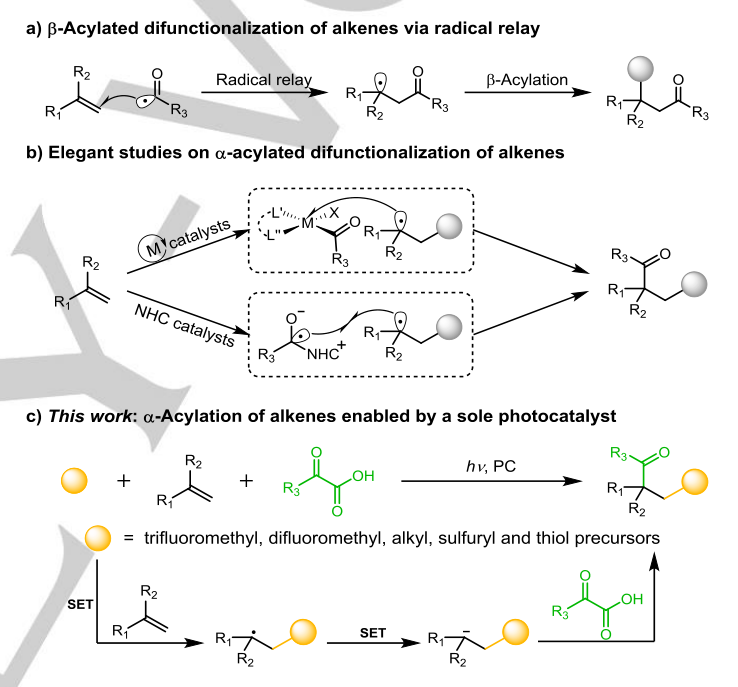
为了解决这一问题,来自中国科学院理化技术研究所的吴骊珠教授课题组设想通过自由基继电器实现烯烃的α酰化双官能化可以由一个单独的光催化剂(PC)实现。不同于过渡金属催化和NHC催化烯烃的α-酰化反应,光氧化还原催化剂作为一种重要的工具,可能与自由基前体以不同的动力学方式相互作用。
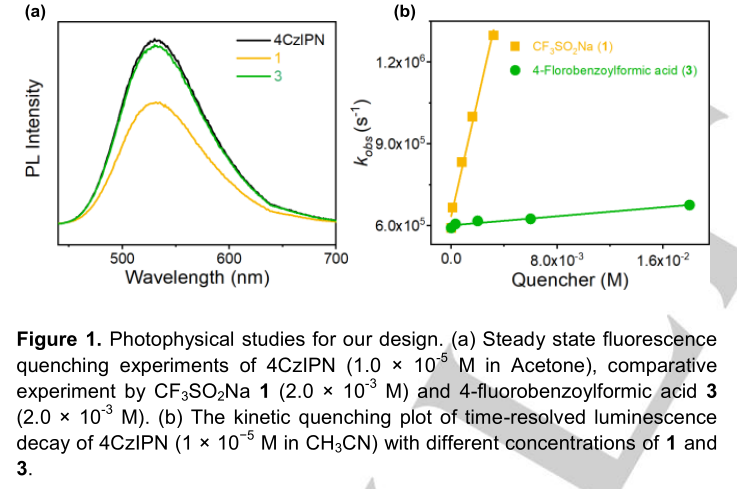
作者的研究是从光氧化还原催化三组分体系开始的,用于烯烃的三氟甲酰化反应。选择Langlois试剂1(CF3SO2Na,三氟甲基自由基前体)、1,1-二苯乙二胺和α-酮酸-4-氟苯甲酰甲酸3(酰化试剂)来测定4CzIPN与光催化剂4PraIPN的相互作用。由于激发态的4CzIPN*在E1/2(PC*/PC·-) = +1.35V vs SCE时的氧化电位能氧化CF3SO2Na 1 (E1/2ox = + 1.05V vs SCE)和4-氟苯甲酰甲酸3 (E1/2ox = + 1.08 V vs SCE)(图S1),电子从1或3到激发态4CzIPN*的电子转移过程在热力学上是可行的。然而,用于动力学实验的稳态和时间分辨技术显示了它们的不同。如图1a所示,CF3SO2Na 1比4-氟苯甲酰甲酸3更能猝灭激发的4CzIPN*。由时间分辨发光衰变(图S4)测得CF3SO2Na 1和4氟苯甲酰甲酸3激发的4CzIPN*的猝灭速率分别为2.1×108 M−1s−1和4.2×106 M−1s−1(图1b)。重要的是,与4-氟苯甲酰甲酸3相比,CF3SO2Na 1对4CzIPN*的猝灭速度大约快50倍。这意味着93%的4CzIPN*被CF3SO2Na 1截留,而4-氟苯甲酰甲酸3只截留2%(图S5)。这一动力学差异与作者的假设一致,激发的PC*优先氧化有利的前体CF3SO2Na1生成CF3·,CF3·与芳基烯的高位最高占据分子轨道的反应速度比亲核酰基快得多。在反应动力学过程中,以70%的产率得到了目标的三氟甲酰化产物4,在Ar气氛中,在2mol%4CzIPN,0.1mmolCF3SO2Na 1,0.3mmol 1,1-二苯乙基2,0.3 mmol 4-氟苯甲酰甲酸和2 mL CH3CN的存在下,用24h的蓝色LED照射(表1,条目1)。UV-Vis吸收光谱表明,光催化剂4CzIPN在可见光区域有很强的吸收,而CF3SO2Na 1、1,1-二苯乙基2和4-氟苯甲酰甲酸3则不是这样。自由基时钟实验表明,三氟甲基和异丙基与1-(2-苯基环丙基)-乙烯基苯级联生成1,7-二官能团化合物5和6,表明环丙烷环上的自由基继电器反应开始生成苯基自由基。
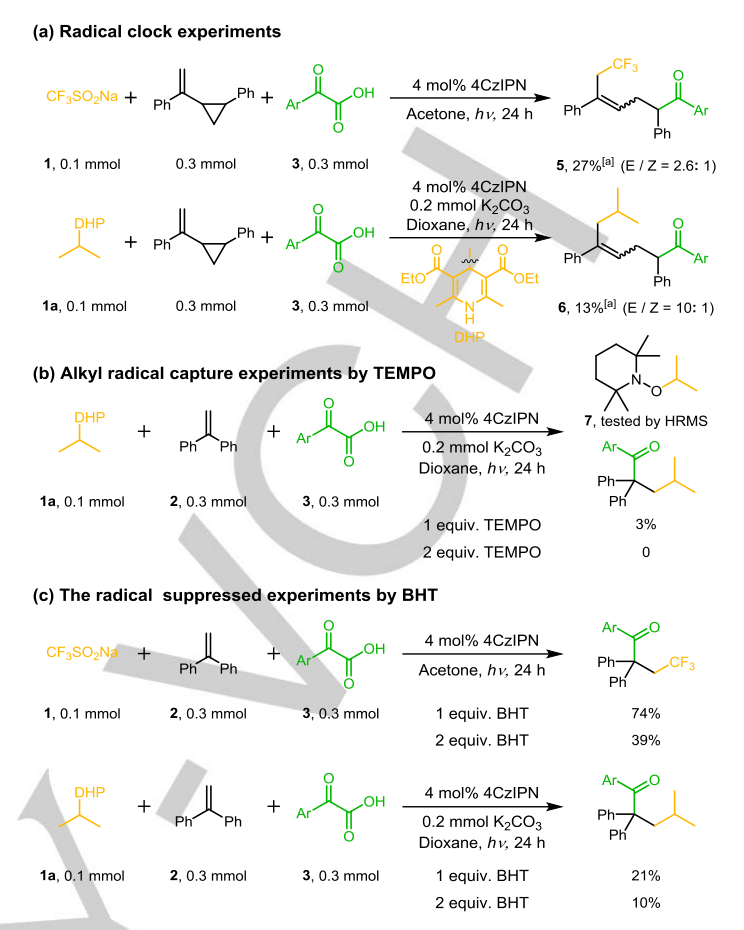
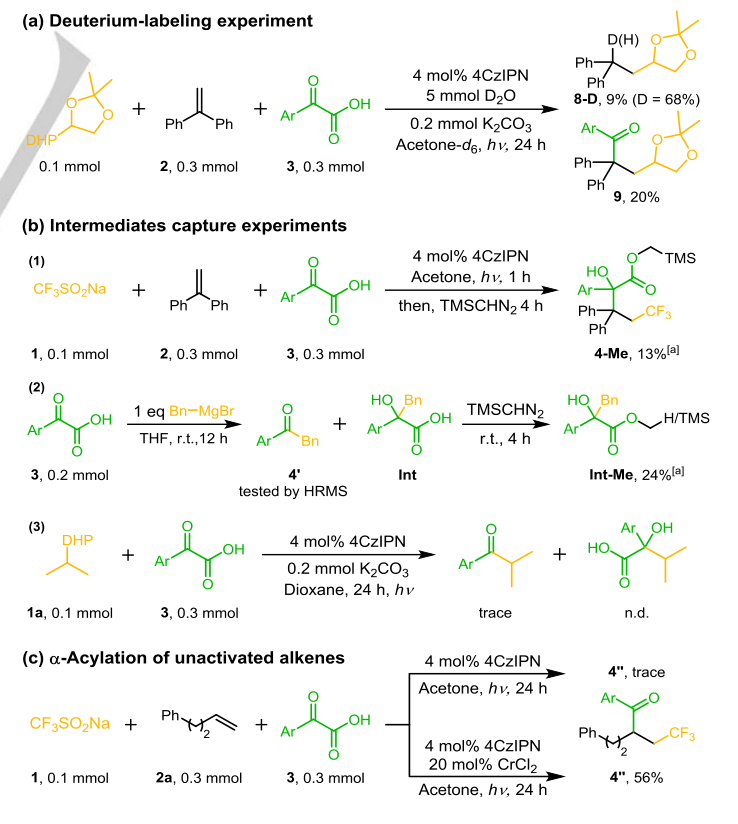
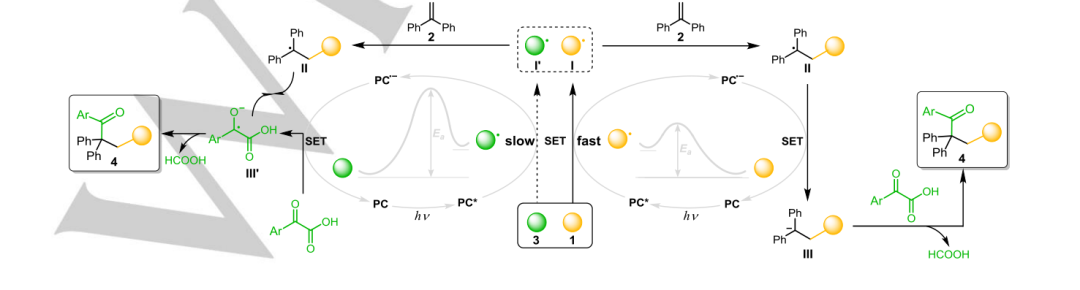
当2,2,6,6-四甲基哌啶-1-氧基(TEMPO)加入到双官能化体系中时,异丙基被TEMPO(7)捕获,而起始原料的转化率显著降低(图2b)。另外两组用丁基羟基甲苯(BHT)进行的自由基抑制实验与自由基过程一致(图2c)。在没有3的情况下,氚标记实验中,5 mmol H2O或D2O以97%的产率生成质子化产物8,以68%的产率生成8-D(D=72%)(图S21,方程式(1)、(2))。在α-酰化反应中加入5 mmol D2O可得到9%的质子化产物8-D (D=68%),而烷基酰化产物9则降至20%(图3a)。此外,在照射1h后,加入TMSCHN2观察到亚甲基化中间体4-Me的形成(图3b,等式1)。用苄基溴化镁搅拌α-酮酸3得到脱羧烷基化产物4’和中间体Int-Me的甲基化产物Int-Me,支持烷基阴离子对α-酮酸的亲核攻击(图3b,方程2)。在没有烯烃的情况下,痕量的烷基和酮基自由基偶联产物与我们的推测一致(图3b,方程3)。由于不稳定的烷基很难转化为亲核烷基阴离子,因此只检测到未活化的烯烃的微量三氟甲基酰化产物4’(图3c),进一步暗示了普通的自由基-自由基偶联途径。利用CrCl2捕获生成亲核CrIII-烷基阴离子中间体的烷基自由基的能力,获得了56%的4’。所有这些结果都有力地支持了在光催化氧化还原中性体系中,通过优先生成的自由基加成到烯烃的β位上,进而生成碳阴离子来攻击α-酮酸的自由基传递过程。
受到这一结果的鼓舞,[Ir(dtbbpy)(ppy)2]PF6、Ir[dF(CF3)ppy2(dtbpy)]PF6和Ir[dF(CF3)ppy2(5,5’-dCF3bpy)]PF6的光催化剂的变化显示,类似的氧化还原电势PC给出了类似的结果(条目2-4)。将4CzIPN增加到4 mol%时,产率较高,为94%(条目5)。丙酮被发现是实现这一独特转化的最佳溶剂(条目6,97%)。对照实验证实了可见光催化的性质,因为在没有PC或光的情况下没有反应发生(条目7、8)。显然,CF3SO2Na 1与激发的PC*(方案2)有压倒性的主导动力学过程,这使得从CF3SO2Na 1到PC*的SET能够产生PC·-和CF3·I。三氟甲基 I与烯烃2的自由基加成生成烷基II,它被还原的PC·-立即还原成PC和亲核的烷基阴离子III。在这种情况下,α-酮酸形成酰基I的速度太慢,无法与CF3·自由基I竞争。
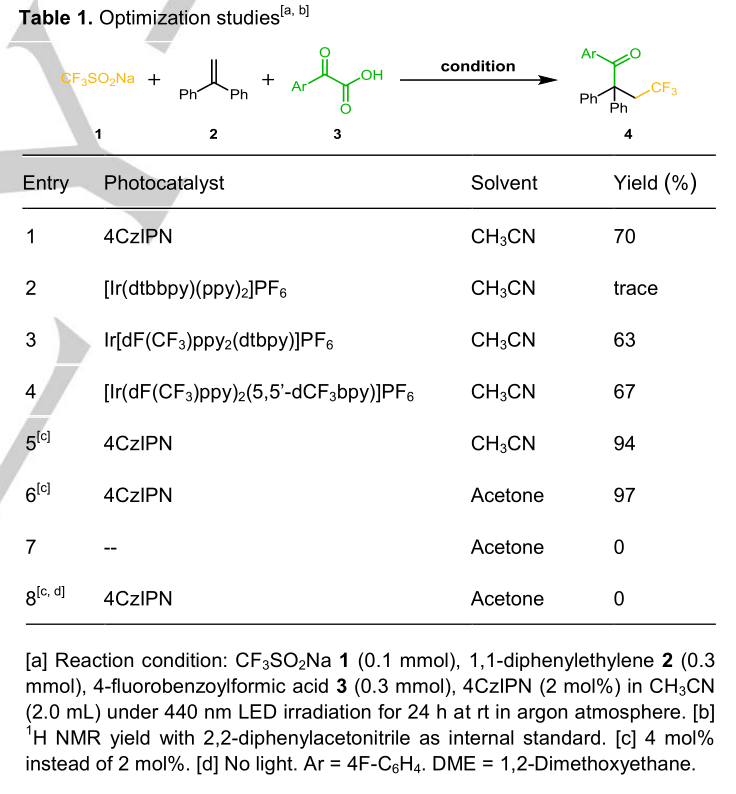
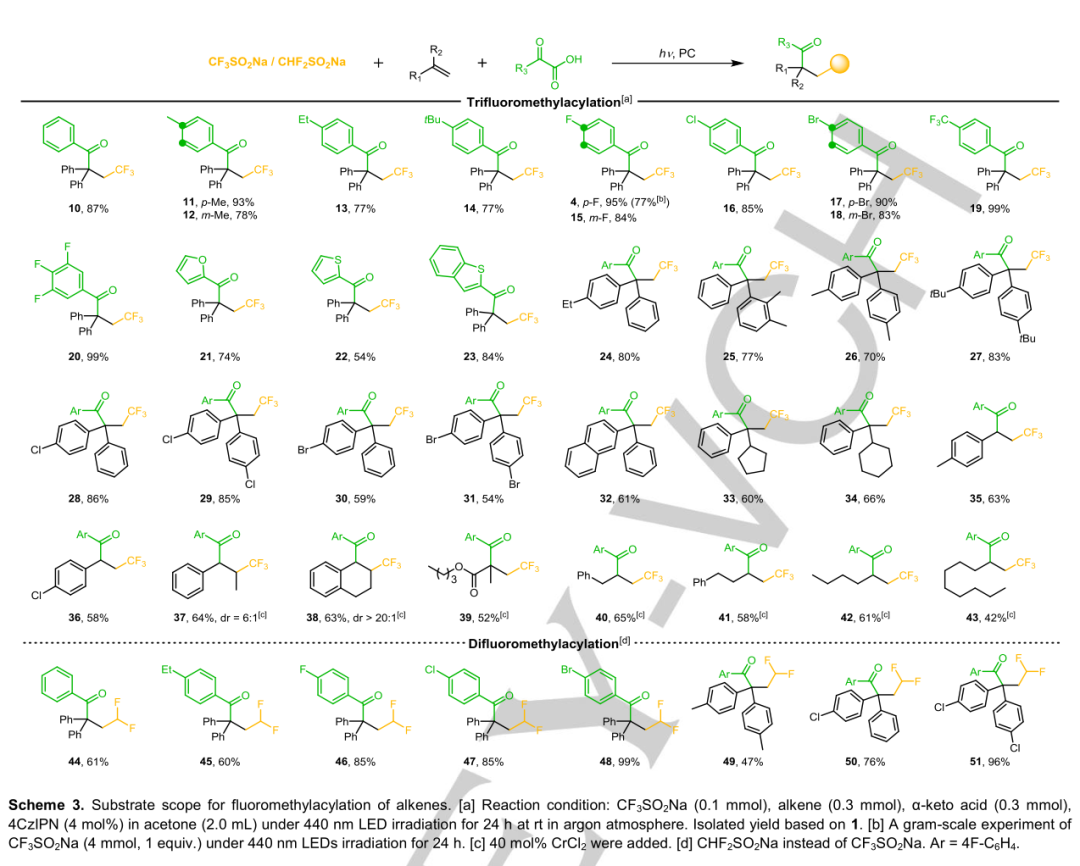
考察了这一独特的烯烃三氟甲基酰化反应的共性。如方案3所示,CF3SO2Na和不同的α-酮酸对烯烃的去功能化表现出很好的反应性,结果如下:(A)在优化的条件下(10-14,77%-95%),α-酮酸的芳基被烷基取代,可以得到三氟甲基酰化产物。(B)在芳基底物上引入卤素(4-F,3-F,4-氯,4-溴,3-溴)的反应活性相对较高(4,15-18,83%-95%)。
值得注意的是,模型反应的底物获得了95%的产率(4)。杂环也适用于该反应;具有烷基取代基的1,1-二苯基乙烯均能转化,产率为70%-83%(24-27);含氯和溴原子的卤代1,1-二苯基乙烯(28-31)得到了三氟甲基酰化产物,产率为54%-86%;芳基上含有α取代基的苯乙烯(包括2-萘基(32)、环戊基(33)、环己基(34))和对甲基(35)、对氯(36)取代基的苯乙烯均相容(58%~66%)。此外,借助催化量的CrCl2,可以实现内部、缺电子和中性烯烃的α-酰化。内烯烃β-甲基苯乙烯(37)、1,2-二氢萘(38)和缺电子丙烯酸酯(39)对该催化体系具有较好的催化活性(52%~64%)。烯丙基苯(40)、4-苯基-1-丁烯(41)、1-己烯(42)和1-癸烯(43)以42%~65%的产率转化为相应的三氟甲基酰化产物。为了证明通过光催化烯烃的α酰化反应的可能性,进行了克规模的CF3SO2Na(4 mmo1,1当量.)。以77%的产率(1.14克)实现,展示了其合成潜力。(I)除了CF3SO2Na外,令人兴奋的结果是CHF2SO2Na也适用于该方法,将二氟甲基锚定在烯烃的β位上。不仅乙基(45)和卤素原子(46-48)取代的苯甲酰甲酸(44)及其对映体可以很好地转化为二氟甲酰化产物(60%-99%),而且具有甲基(49)和氯(50,51)取代基的1,1-二苯乙烯也可以47%-96%的产率得到相应的产物。
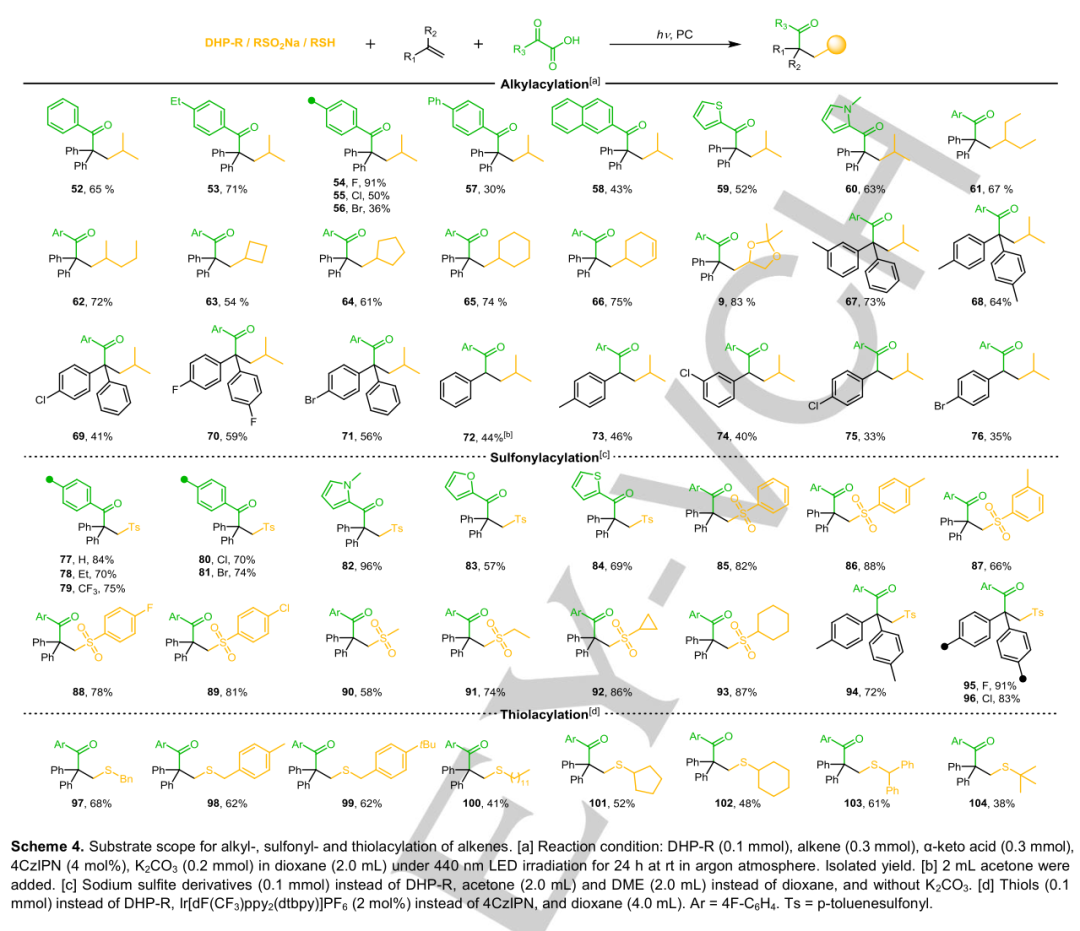
各种α-酮酸、烷基二氢吡啶衍生物和烯烃在该反应中也是有效的(方案4),比如苯基上富含各种官能团的α-酮酸,各种烷基链,甲基(67,68)、卤素(69-71)取代基的1,1-二苯乙烯和取代基(73-76)的苯乙烯(72)是有效的底物,不同空间效应的α-酮酸,杂环酮酸,与磺酰基相连的官能团,1,1-二苯基烯烃上苯基的官能团。此外,稠密官能化硫醇的范围受反应条件的影响,具有伯碳、仲碳和叔碳中心的硫醇是硫代酰化反应的有效底物,位阻越大,产率越低。
综上所述,作者首次成功地开发了单一光催化剂驱动的烯烃α-酰化反应。在没有过渡金属催化剂和NHC催化剂的情况下,各种烯烃可以通过氟甲基、烷基、磺酰基和硫代丙烯基化双官能化直接转化为精油酮,选择性高,产率高,即使对未活化的烯烃也是如此。成功的关键是α-酮酸对PC*的动力学惰性,从而导致动力学有利的自由基前体优先使烯烃的β位置官能化。同时,α-酮酸在氧化还原-中性催化体系中作为亲电剂被原位烷基阴离子攻击而催化α酰化反应,对酰基自由基的形成非常缓慢。该方法不仅为烯烃的α酰化反应提供了一个简洁的设计原理,而且也为烯烃的化学和区域选择性去功能化提供了一个手段。
DOI: 10.1002/anie.202208831





