【Angew.】川大冯小明/刘小华/曹伟地课题组:首例可见光/手性Lewis酸协同催化的不对称aza-Reformatsky反应
论文信息:
第一作者:江明一
通讯作者:冯小明,刘小华,曹伟地
通讯单位:四川大学化学学院

(来源:Angew.)
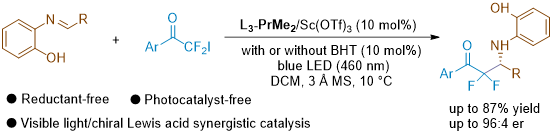
(来源:Angew.)
近日,四川大学冯小明教授团队在前期工作的基础上(J. Am. Chem. Soc. 2022, 144, 22140; Angew. Chem. Int. Ed. 2022, 61, e202203374; CCS Chem. 2023, 5, 2101; J. Am. Chem. Soc. 2024, 146, 23457; Nat. Commun. 2024, 15, 10866; CCS Chem. 2025, 7, 573),利用手性双氮氧/钪(III)配合物催化剂(冯催化剂)辅助光催化策略,发展了一种全新的不对称aza-Reformatsky反应模式,在不加还原剂的情况下,首次实现了光催化亚胺与α,α-二氟-α-碘代酮的不对称自由基偶联。
(Aza)-Reformatsky反应是一类经典的有机人名反应,其反应机制涉及α-卤代羰基化合物与醛、酮或亚胺在化学计量还原剂(通常为单质锌或烷基锌)作用下的偶联过程。不对称(aza)-Reformatsky反应为手性β-羟基/氨基羰基化合物的合成提供了重要途径。然而,传统方法中化学计量还原剂的使用导致副反应多,反应条件苛刻,且会产生大量金属废弃物(图1),制约了该反应的广泛应用。因此,开发新型催化体系,避免使用还原剂将显著提升反应的原子经济性和环境友好性,为相关化合物的绿色合成开辟新途径。
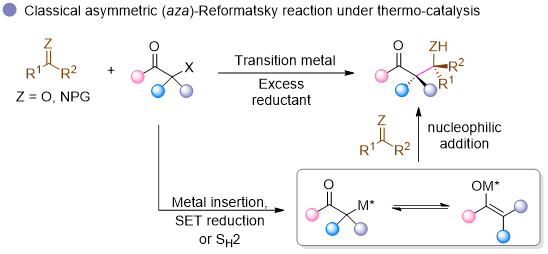
图1. Reformatsky反应及其局限性(来源:Angew.)
近年来,光催化技术在有机合成领域取得了突破性进展,为解决传统热催化难以实现的化学转化提供了新思路。研究表明,亚胺在激发态下表现出与基态显著不同的反应特性,如氧化还原能力。基于此,作者团队提出了一种创新性的研究设想:利用光催化策略提升亚胺的氧化能力,使其能够与卤代烃直接发生偶联反应,从而在不外加还原剂的条件下实现氧化还原中性的aza-Reformatsky反应。然而,由于亚胺激发态存在Z-E构型互变导致能量耗散,其激发态寿命普遍较短,这使得激发态亚胺参与的光催化反应研究比较困难,通常需要借助光催化剂来提升反应活性。基于作者团队课题组在不对称光催化领域的长期积累,利用手性双氮氧/钪(III)配合物催化剂(冯催化剂)活化亚胺和控制立体选择性,在无外加光催化剂的条件下,成功实现了激发态亚胺与偕二氟碘代苯乙酮类底物的不对称aza-Reformatsky反应。这一突破性进展不仅克服了传统过渡金属催化方法对还原剂的依赖(图2),更为绿色、高效的不对称合成提供了新方法。
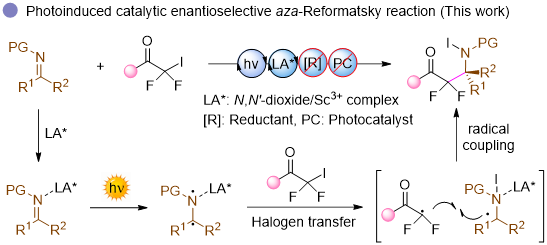
图2. 可见光/手性Lewis酸协同催化不对称氧化还原中性Reformatsky反应(来源:Angew.)
在研究之初,作者团队选择肉桂醛衍生的亚胺1a与α,α-二氟-α-碘代苯乙酮2a作为模型底物对反应条件进行优化(表1)。经过筛选,发现以脯氨酸衍生的手性双氮氧配体L3-PrMe2、三氟甲磺酸钪Sc(OTf)3作为路易斯酸催化剂、二氯甲烷作为反应溶剂,并在460 nm蓝光照射下反应24小时,能够以47%收率和92:8 er获得目标产物3a。为提高产物收率,作者团队针对亚胺在光照条件下易分解的问题进行了深入优化。通过降低光的功率和反应温度以及添加自由基抑制剂2,6-二叔丁基-4-甲基苯酚(BHT),在延长反应时间至48小时的情况下,将产物收率提升至59%,同时将er值提高至95:5。值得注意的是,BHT的引入不仅有效抑制了亚胺的光分解,还显著降低了区域选择性副产物3a'的生成。
表1.反应条件筛选a
(来源:Angew.)
表2.底物扩展表
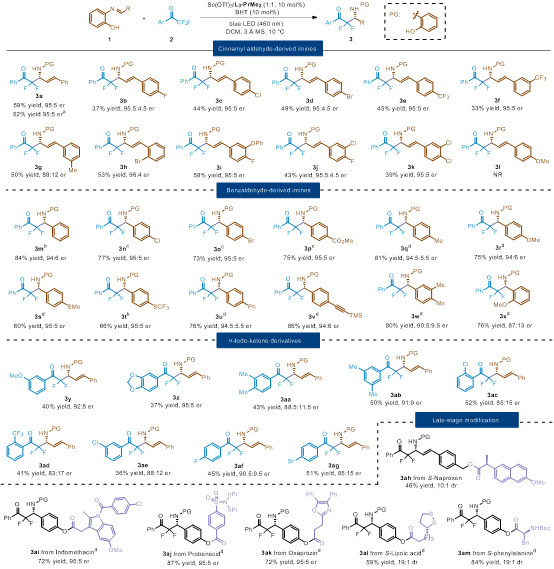
Substrate scope. Unless otherwise noted, all reactions were performed with 1 (0.10 mmol), 2 (0.10 mmol), L3-PrMe2/Sc(OTf)3 (1:1, 10 mol%), BHT (10 mol%) and 3 Å MS (20.0 mg) in DCM (1.0 mL) at 10 °C under 5 W blue LED (460 nm) illumination for 48 h. The er values were determined by HPLC analysis on a chiral stationary phase. The dr values were determined by 1H NMR spectra. (a) 4 mmol scale. (b) Performed without BHT under 7 W blue LED (460 nm) illumination for 96 h. (c) Performed with 1 (0.12 mmol) and without BHT for 96 h. (d) Performed with 1 (0.12 mmol) and without BHT under 4 W blue LED (460 nm) illumination for 96 h.(来源:Angew.)
在确立最优反应条件后,作者团队对底物的适用范围进行了考察(表2)。研究结果表明,对于肉桂醛衍生的亚胺类底物,尽管原料存在一定程度的光分解导致产物收率处于中等水平(3a-3k,33%-59%),但展现出优异的对映选择性(88:12-96:4 er)。值得注意的是,对甲氧基取代的肉桂醛衍生物作为底物时,未能获得目标产物3l,可能是由于其激发态还原电势不足以氧化卤代烃。苯甲醛衍生的亚胺在该催化体系中同样表现出良好的适用性。通过优化反应条件,在不添加BHT的情况下,以84%收率和94:6 er获得了产物3m。各类取代苯甲醛衍生的亚胺也能顺利参与反应,以优异的收率(60%-86%)和对映选择性(87:13-95:5 er)生成相应产物(3m-3x)。α-碘代羰基化合物同样可以转化为目标产物(3y-3ag,36%-52%收率,83:17-95:5 er)。该催化体系对多种药物分子及其衍生物展现出良好的兼容性,包括S-萘普生(3ah)、吲哚美辛(3ai)、丙磺舒(3aj)、奥沙普嗪(3ak)、S-硫辛酸(3al)以及S-苯丙氨酸(3am)等生物活性分子,充分证明了该方法在药物合成中的潜在应用价值。
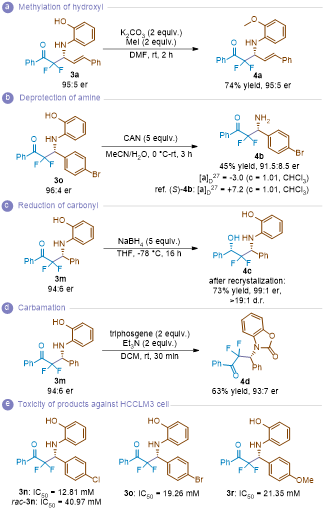
图3. 产物衍生化及生物活性测试(来源:Angew.)
为进一步探究产物的应用价值,作者团队对目标产物进行了衍生化研究和生物活性评估(图3)。首先,产物3a在碘甲烷条件下可选择性实现酚羟基的甲基化,高效转化为茴香胺衍生物4a;通过脱除产物3o的胺基保护基,成功获得伯胺4b,并利用旋光值对比确定了其绝对构型为R构型;在硼氢化钠还原条件下,3m能以高非对映选择性转化为β-氨基醇4c;此外,3m经三光气处理可顺利生成氨基甲酸酯衍生物4d。值得注意的是,细胞实验结果表明,产物3n、3o和3r对人肝癌细胞表现出显著的细胞毒性,表明这些化合物可能具有作为抗癌先导化合物的潜力。
为深入阐明反应机理,开展了一系列机理研究实验(图4)。紫外-可见吸收光谱分析表明,手性Lewis酸的引入显著促进了底物的红移。通过循环伏安法和荧光发射光谱研究,发现底物1a的激发态还原电势显著提升(E0red*= +1.24 V vs. Ag/AgCl in CH3CN),足以与底物2a(E0ox = +1.14V vs. Ag/AgCl in CH3CN)发生单电子转移过程。自由基捕获实验证实了反应过程中存在α-羰基碳自由基中间体,而1H和19F NMR实验则成功检测到氮碘中间体的形成。此外,通过测定量子产率(Φ = 0.00337)并结合核磁共振实验结果,排除了链增长机制和EDA复合物参与反应的可能性,为反应机理的阐明提供了有力证据。
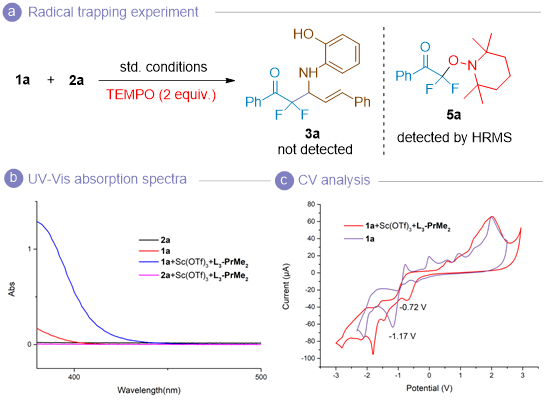
图4. 机理实验(来源:Angew.)
基于以上实验结果,提出了可能的反应机理(图5)。首先亚胺底物1与手性Lewis酸催化剂配位生成配合物Int I,该中间体在光照下到达激发态,并与底物2发生单电子转移/碘转移,生成中间体Int II,随后经历自由基偶联得到中间体Int III,催化剂解离后生成中间体Int IV。Int IV在柱层析过程中水解得到产物3。
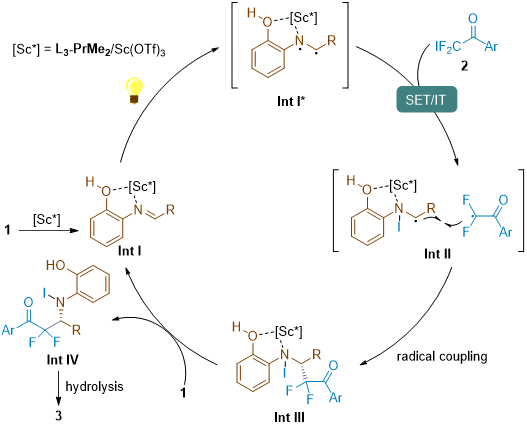
图5. 可能的反应机理(来源:Angew.)
综上所述,冯小明教授团队发展了首例光催化不对称aza-Reformatsky反应,避免了还原剂的使用,高对映选择性地合成了一系列含氟烯丙胺和苯乙胺产物。通过机理研究,提出了全新的反应机理,为设计新型不对称催化反应提供了新思路。作者团队相信利用该可见光/手性Lewis酸协同催化策略,未来能够实现更多经典反应的不对称转化。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





