【OL】南农邓红平教授课题组:可见光诱导的非活化烯烃的三组分烷基-芳基化反应
由于其独特结构性质,多取代的环丁烷结构广泛存在于一些具有生物活性的天然产物和药物活性分子中,如Nigramide R、Ivosidenib等。因此,多取代环丁烷的高效合成研究引起了化学家的广泛关注。其中,自由基介导的双环[1.1.0]丁烷的官能团化反应是一类合成多取代环丁烷化合物的高效方法。已报道的该类方法通常集中于双环[1.1.0]丁烷桥碳-碳σ键的官能团化,且反应产物也局限于1,3-多取代的环丁烷衍生物,而关于双环[1.1.0]丁烷C2位C(sp3)−H键的官能团化则一直是个挑战,报道的例子也非常有限。近日,南京农业大学邓红平教授课题组利用可见光诱导钴催化的策略,选择性地实现了双环[1.1.0]丁烷C2位C(sp3)−H键的磷酰化反应,以优秀的区域选择性及非对映选择性地高效合成一系列环丁烯衍生的磷氧化合物。相关研究成果发表在Organic Letters 。
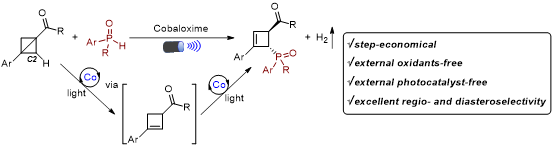
图1. 可见光诱导的钴催化双环[1.1.0]丁烷C2位C(sp3)−H键的磷酰化反应(来源:Organic Letters)
作者以苯基、酯基双取代的双环[1.1.0]丁烷和二苯基磷氧为原料对反应条件进行了优化,发现以10 mol% Co(dmgH)2PyCl为光催化剂和过渡金属催化剂,吡啶为碱,二氯甲烷为溶剂,在蓝色LED室温照射24小时为最佳反应下,选择性地实现双环[1.1.0]丁烷C2位C(sp3)−H键的磷酰化,以68%的收率生成环丁烯衍生的磷氧化合物,氢气为唯一副产物。在最优的反应条件下,作者考察了双环[1.1.0]丁烷的底物普适性,发现该方法适用于各类酯基、酰胺基和酰基取代的双环[1.1.0]丁烷,以中等到良好的收率及优秀的非对映选择性地生成其相应的环丁烯衍生的磷氧化合物;对于双环[1.1.0]丁烷的苯基上含有各种推电子取代基或卤素的反应底物,该反应也能顺利进行。
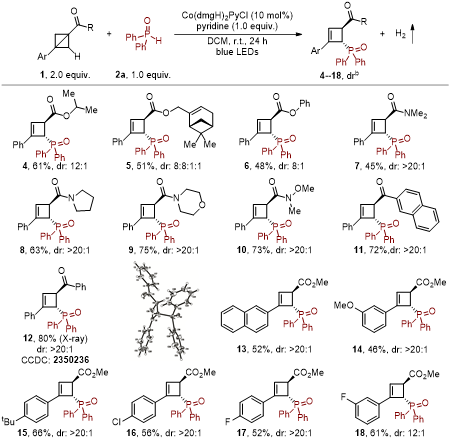
图2. 双环[1.1.0]丁烷的普适性(来源:Organic Letters)
在最佳反应条件下,当二芳基磷氧化合物含有各种推电子取代基或卤素时,双环[1.1.0]丁烷C2位C(sp3)−H键的磷酰化反应也能顺利发生;同时,该催化体系也适用于二噻吩磷氧、硫代二芳基磷氧和苯基甲基磷氧。
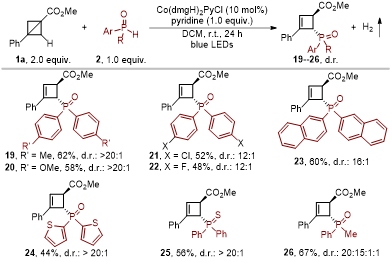
图3. 磷氧化合物的普适性(来源:Organic Letters)
接着,通过一系列简单地转化,该环丁烯衍生的磷氧化合物很容易地转化为相应的羧酸衍生物、共轭二烯衍生物、环丁烯及环丁烷衍生的叔膦化合物。
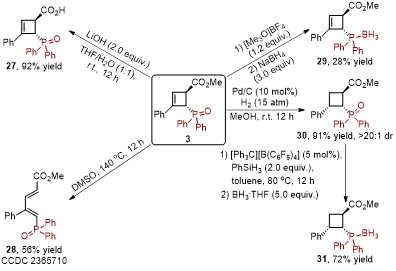
图4. 反应产物的应用转化(来源:Organic Letters)
接着,作者利用一系列控制实验(氢气检测实验、开关灯实验、紫外-可见光吸收实验、荧光淬灭实验、自由基捕获实验及循环伏安法测反应物的氧化电势)对反应的机理进行了详细地研究;同时,课题组利用DFT计算化学的手段,对反应过程中生成的可能中间体、反应的区域选择性及非对映选择性进行了探索解释。
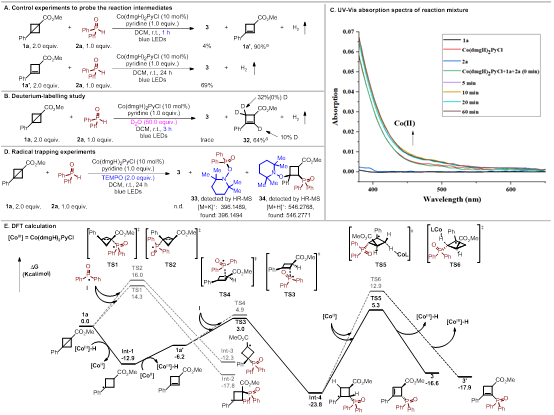
图5. 详细的机理研究(来源:Organic Letters)
基于以上的实验结果,作者提出了反应的可能机理。双环[1.1.0]丁烷1a在CoIII-H类似物的催化条件下,转化为相应的环丁烯衍生物1a′,控制实验表明化合物1a′是该反应的重要中间体。激发态的CoIII催化剂在碱的协助下单电子氧化二苯基磷氧生成相应的CoII中间体和二苯基磷氧自由基II,接着二苯基磷氧自由基II与环丁烯1a′发生加成反应生成苄基自由基中间体III,该中间体III与CoII通过氢原子转移过程生成最终的目标产物3和中间体CoIII-H,中间体CoIII-H在质子的作用下释放出氢气,再生CoIII催化剂并完成催化循环。
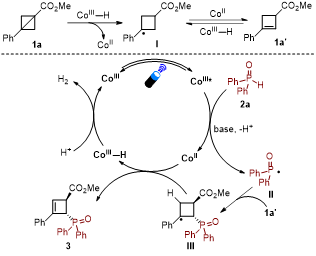
图6. 反应的可能机理(来源:Organic Letters)
综上,作者发展了一种新型的可见光诱导钴催化双环[1.1.0]丁烷C2位C(sp3)−H键的磷酰化的方法学,高选择性地合成一系列环丁烯衍生的磷氧化合物,该反应条件温和,且无需外加光催化剂及氧化剂,且该方法成功应用于合成一系列功能化的含磷化合物。
文章的第一作者为南京农业大学博士研究生陈鹏飞,刘芳教授和邓红平教授为文章的共同通讯作者。研究工作得到了国家自然科学基金(21901121)和南京农业大学科研启动经费的资助。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





