光氧化还原/镍双催化烯烃的远近程氢氨基烷基化
本文研究了活化和非活化烯烃经双光氧化/镍催化的温和、选择性的氢氨基烷基化反应。这种双重催化策略能够独家获得α-选择性产品,这是对先前报道的提供β-选择性产品的活性烯烃的光催化氢氨基烷基化的补充。Ni–H中间体向羰基的链行走允许未活化烯烃在遥远的sp3 C–H位点进行氢氨基烷基化。该方法可耐受胺和烯烃的广泛底物范围,并从现成的起始材料提供增值β-氨基酸衍生物的简化合成。
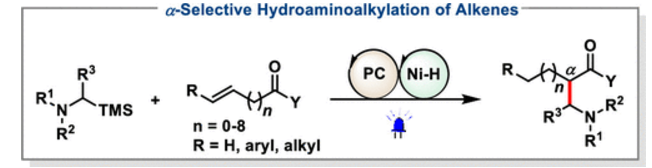
烯烃的催化分子间氢氨基烷基化(HAA)为烷基胺的合成提供了强有力的分离,烷基胺是天然产物、药物和农用化学品中普遍存在的结构基序。在迄今为止报道的各种方法中,涉及胺的α-C-H键活化的过渡金属催化烯烃HAA是获得烷基胺的最直接和原子经济的途径之一。其他方法包括也已公开的烯烃氢甲酰化/还原胺化的两步序列、Brönsted酸介导的烯烃HAA和硼烷Lewis酸催化的烯烃HAA。
除了上述离子方法外,通过Giese加α-氨基自由基对烯烃进行光催化HAA,由于条件温和和高官能团耐受性,最近已成为一种很有吸引力的制备烷基胺的方法。然而,由于α-氨基自由基的亲核特性,大多数反应仅限于缺乏电子的烯烃,如丙烯酸酯或乙烯基吡啶(方案1a)。尽管已记录了苯乙烯的孤立实例,但电子无偏烯烃的光催化HAA尚未报道。此外,极性匹配效应导致α-氨基自由基在烯烃的β-位置相对于吸电子基团(EWG)发生反应。因此,在烯烃的HAA中实现α-选择性以提供支链胺仍然是一个固有的挑战。Cambeiro小组是一个显著的例外,他观察到肉桂酸衍生物的光催化HAA具有较高的α-选择性。此外,由于烯烃的较少极化和更多空间位阻性质,内部烯烃的HAA也未得到充分开发。因此,迫切需要开发新的催化HAA策略,以实现α-选择性并适应未活化烯烃和空间拥挤烯烃。
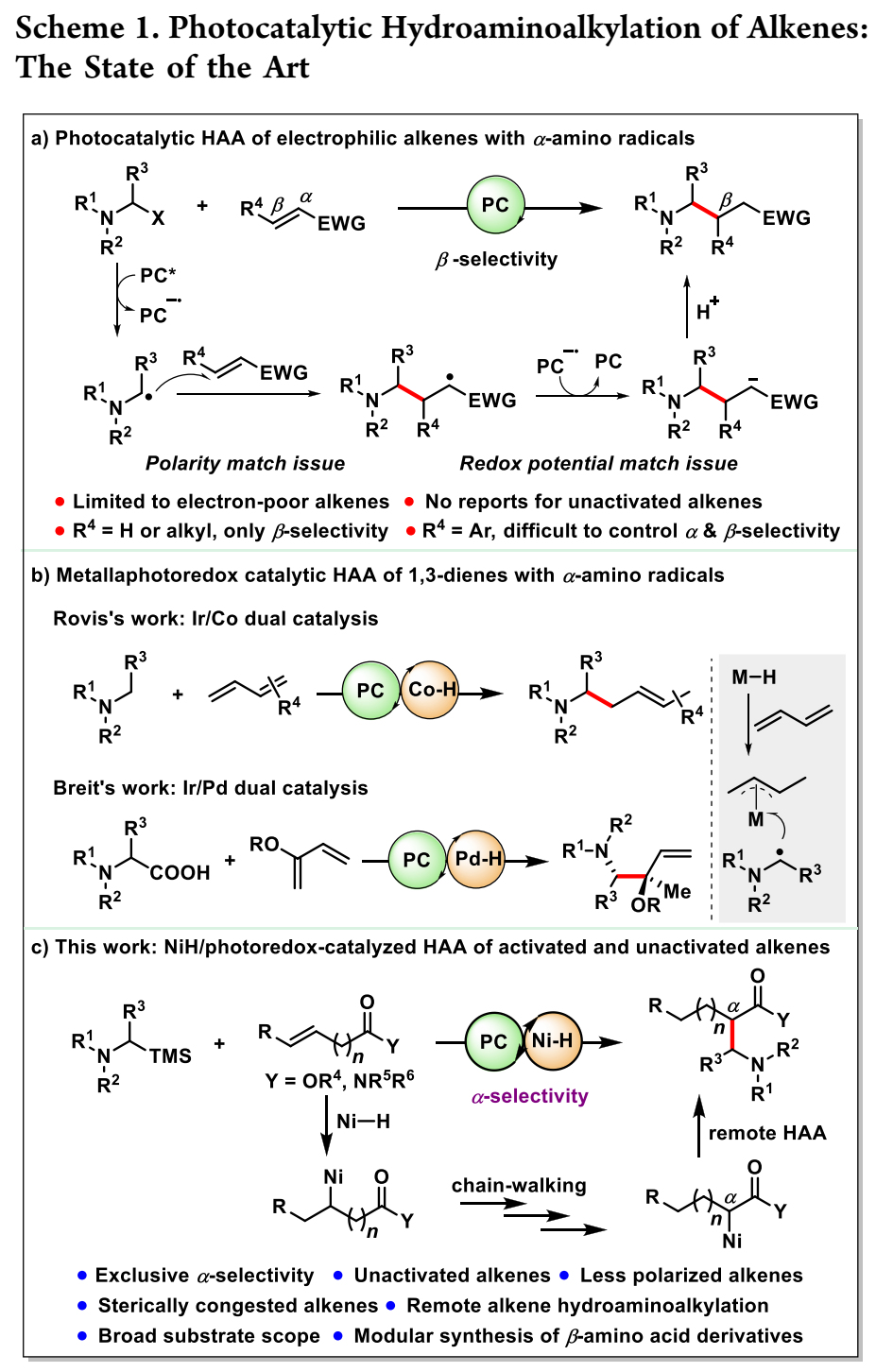
最近,Rovis和Breit证明,将光催化与钴或钯催化结合可以实现共轭二烯的1,4-或1,2-区域选择性HAA(方案1b)。该反应涉及α-氨基自由基与π-烯丙基金属中间体的偶联,该中间体由MH(M=Pd,Co)迁移插入1,3-二烯而产生。随着对双镍/光氧化催化的持续兴趣,作者怀疑是否可以通过NiH/光氧化双催化使烯烃的α-选择性HAA提供支链胺产物。此外,通过利用NiH“链式行走”事件,可以实现偏远sp3 C–H位点非活化烯烃的迁移HAA。如果成功,这种双NiH/光氧化催化将为现有的烯烃HAA策略提供一种补充方法,因为它不受极性匹配效应的支配,因此可能导致具有新的区域选择性的更广泛的烯烃范围。在此,本文报告了作者最近对此目标的研究(方案1c)。
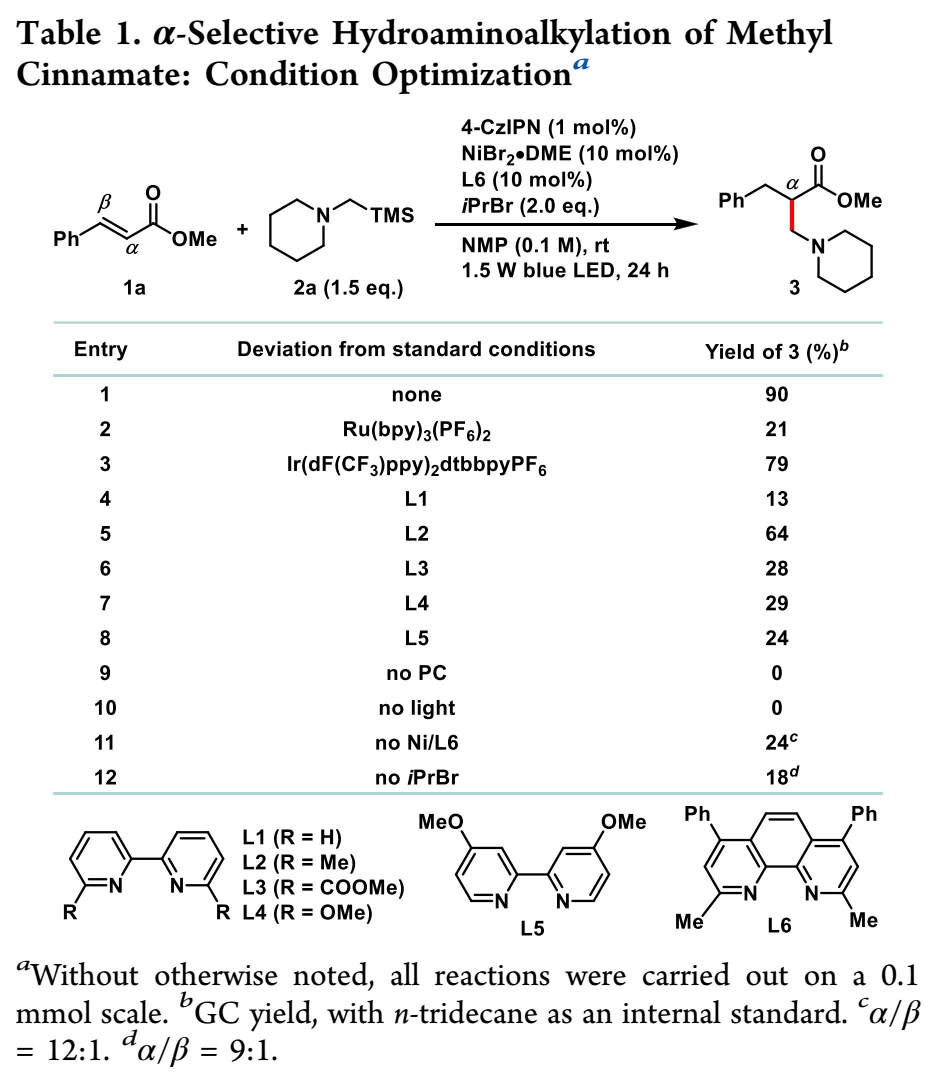
作者以肉桂酸酯作为模型底物开始了研究。需要注意的是,控制肉桂酸酯中添加α-氨基自由基的区域选择性具有挑战性,因为生成的苄基和α-羰基自由基都是稳定的。由于α-硅胺的氧化电位相对较低,易于制备,且与无碱条件相容,因此被选为α-氨基自由基前体。对光催化剂、镍源、配体和溶剂的详细调查(更多详情见表S1-S5)表明,当使用4-CzIPN(其清晰结构见表S4)和NiBr2·DME/L6作为催化剂组合(表1,条目1)时,产物3可以90%的GC收率获得,且具有唯一的α-选择性。建议iPrBr的作用是提供氢化物源(如方案7所述)。Ru或Ir基光催化剂的反应性较低(条目2和条目3)。配体的选择对反应性有重大影响:用替代联吡啶配体(L1–L5)取代L6会导致产率降低(条目4–8)。控制实验表明,需要光催化剂和光照射(条目9和条目10)。如果没有Ni或iPrBr,由于苄基自由基(E1/2(·CH2Ph/–CH2Ph)=−1.43 V vs SCE)和4-CzIPN的简化状态(E1/2(PC/PC•)=−1.21 V vs SCE),α/β-区域选择性较差(条目11和条目12)。
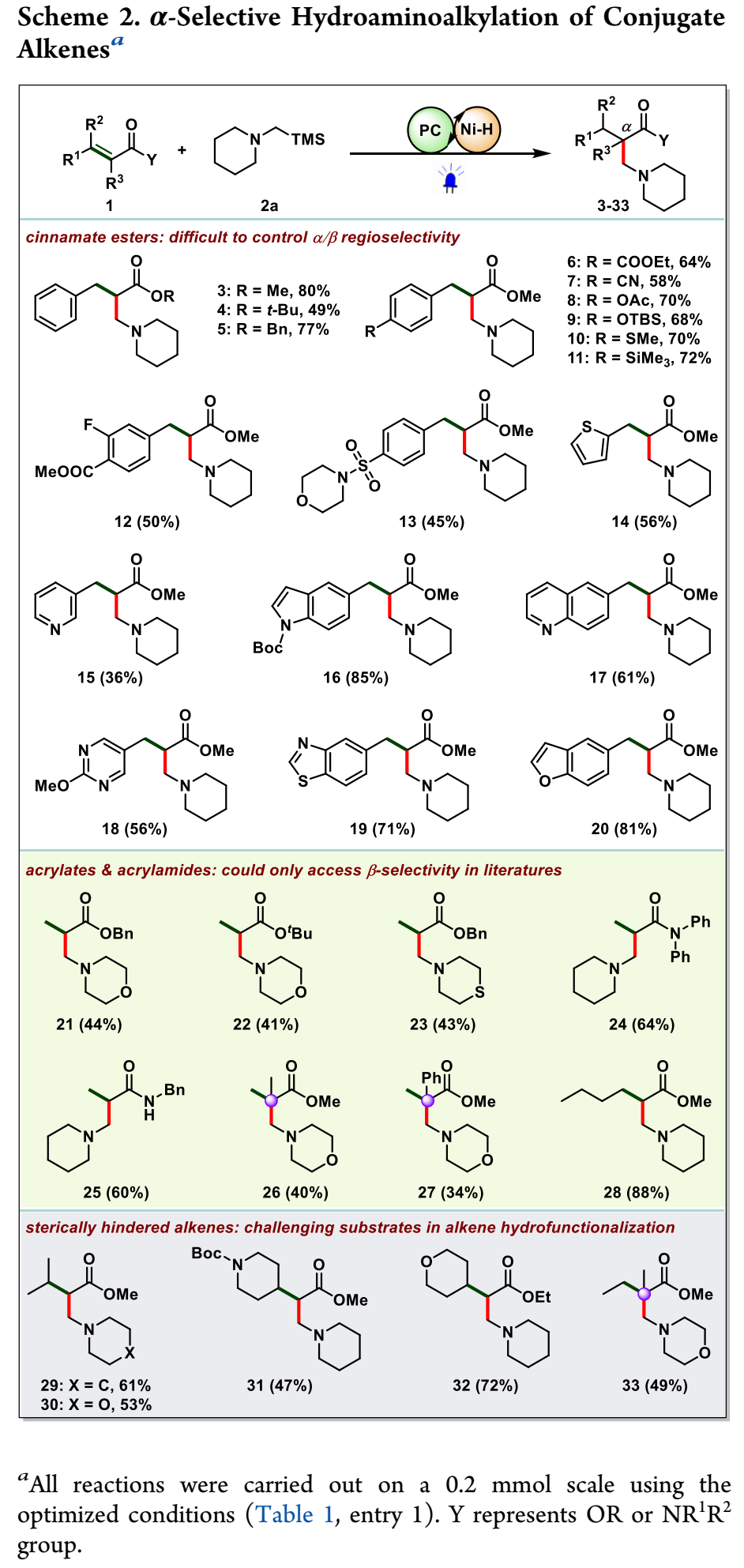
有了优化的条件,作者开始研究关于烯烃的HAA反应的范围(方案2)。肉桂酸酯,无论是甲基、苄基还是叔丁酯,都能以良好的产率反应。该反应显示出很好的官能团相容性。多种官能团,如COOEt、CN、OAc、OTBS、SMe、TMS、F和磺酰胺均耐受良好。此外,一系列医药上普遍存在的杂芳基,包括噻吩、吡啶、吲哚、喹诺酮类、嘧啶、苯并[d]噻唑和苯并呋喃均顺利并入。
特别值得注意的是,由于文献中的极性匹配效应,非取代或烷基取代的丙烯酸酯和丙烯酰胺的基团HAA只能提供β-选择性。然而,该催化系统产生了独特的α-选择性(21–28)。此外,α-取代丙烯酸酯的HAA提供了与羰基相邻的四元碳中心的支链产物(26,27,33)。特别是,空间位阻烯烃,例如β、β-和α、β-二取代烯烃(29–33),在过渡金属催化或光氧化催化的HAA过程中尚未成功地进行。然而,这些具有挑战性的底物在该反应中显示出良好的反应活性,进一步证明了这种双催化协议的合成鲁棒性。
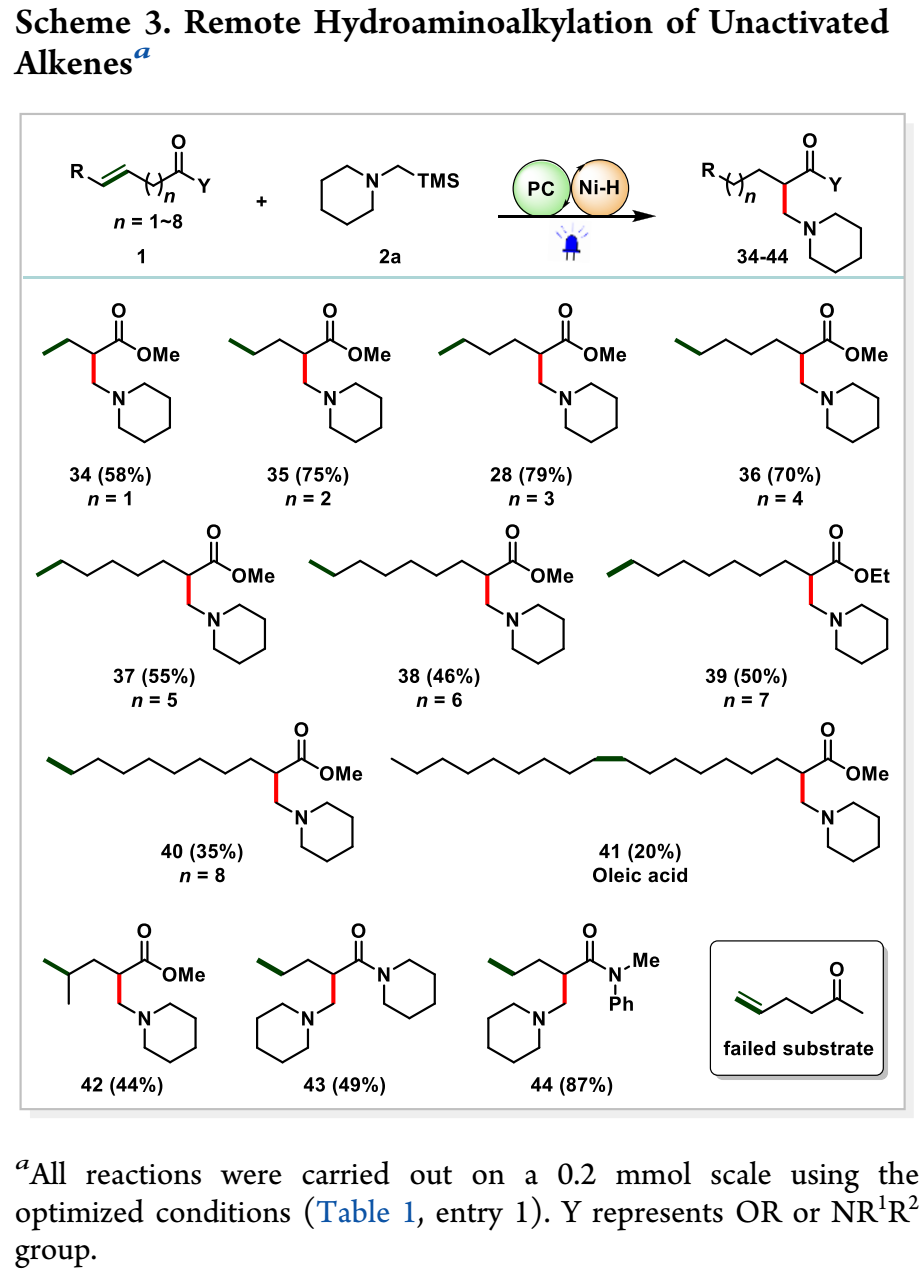
在上述成功的鼓舞下,作者进一步扩展到具有远端羰基的非活化烯烃(方案3)。据预测,由于生成的α-羰基镍物种的热力学偏好,Ni–H中间体的链行走将导致α-官能化。正如预期的那样,HAA功能化发生在羰基的远端非活化sp3 C–H位点α。值得注意的是,NiH物种可以跨越多达8个碳(28、34–40)。具有内部双键的天然油酸也可能发生反应,尽管产率较低(41)。内部甲基取代底物以中等产率反应(42)。含有远端酰胺的烯烃也可以引导远端HAA。环状和非环状酰胺都具有良好的反应活性和位置选择性,以良好的产率提供β-氨基酰胺产品(43,44)。不幸的是,含有末端酮的烯烃未能生产出任何理想的产品。
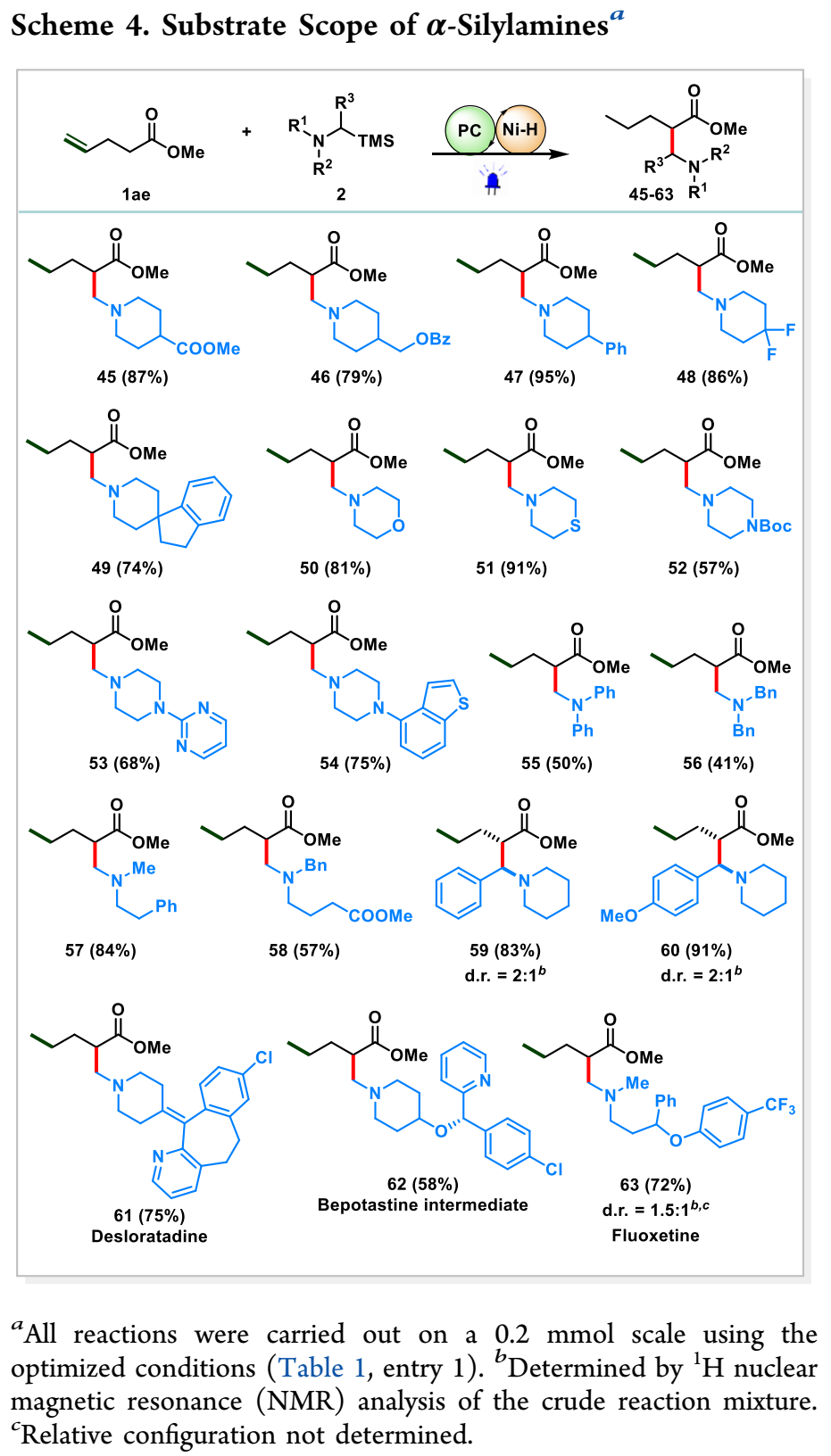
此外,检查了α-硅胺的范围(方案4)。首先评估了一系列环胺,它们是制药行业中最常见的脂肪胺。含有酯、OBz、双核二氟官能团的哌啶反应平稳(45-48)。值得注意的是,2,3-二氢螺环[茚-1,4′-哌啶]是七种跨膜G蛋白偶联受体配体的特权结构,可以引入目标分子(49)。吗啉、硫吗啉和哌嗪(第二大药用相关胺)被顺利合并(50-54)。无环叔胺也是可行的底物(55–58)。α-芳基取代的α-硅烷胺生成非对映体比为2:1(59,60)的产物,两种非对映体都可以通过硅胶层析分离,主要非对映异构体的相对立体化学测定如图所示。此外,观察到该方案对地氯雷他定(61)、苯钾碱中间体(62)和氟西汀(63)衍生的一系列复合胺具有良好的反应性。该催化平台提供了结构多样和高附加值β-氨基酸衍生物的简化合成。
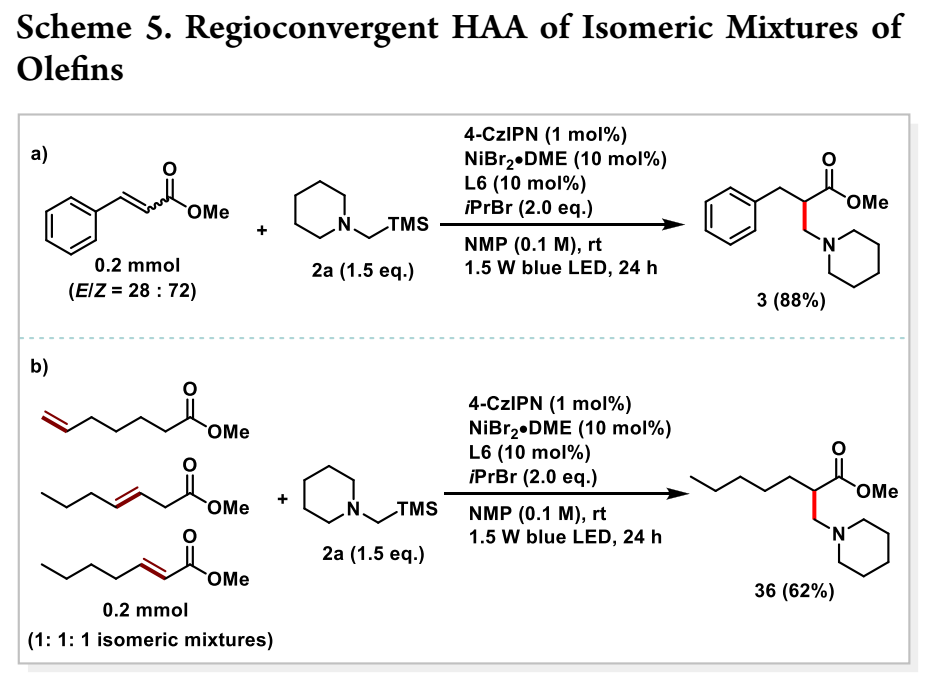
为了进一步说明该反应的合成潜力,将Z-和E-肉桂酸甲酯的混合物直接进行反应,其以高收率和良好的位置选择性有效转化为产物3(方案5a)。此外,烯烃异构混合物转化为单一区域异构产品的区域收敛HAA突出了该程序的合成价值(方案5b)。
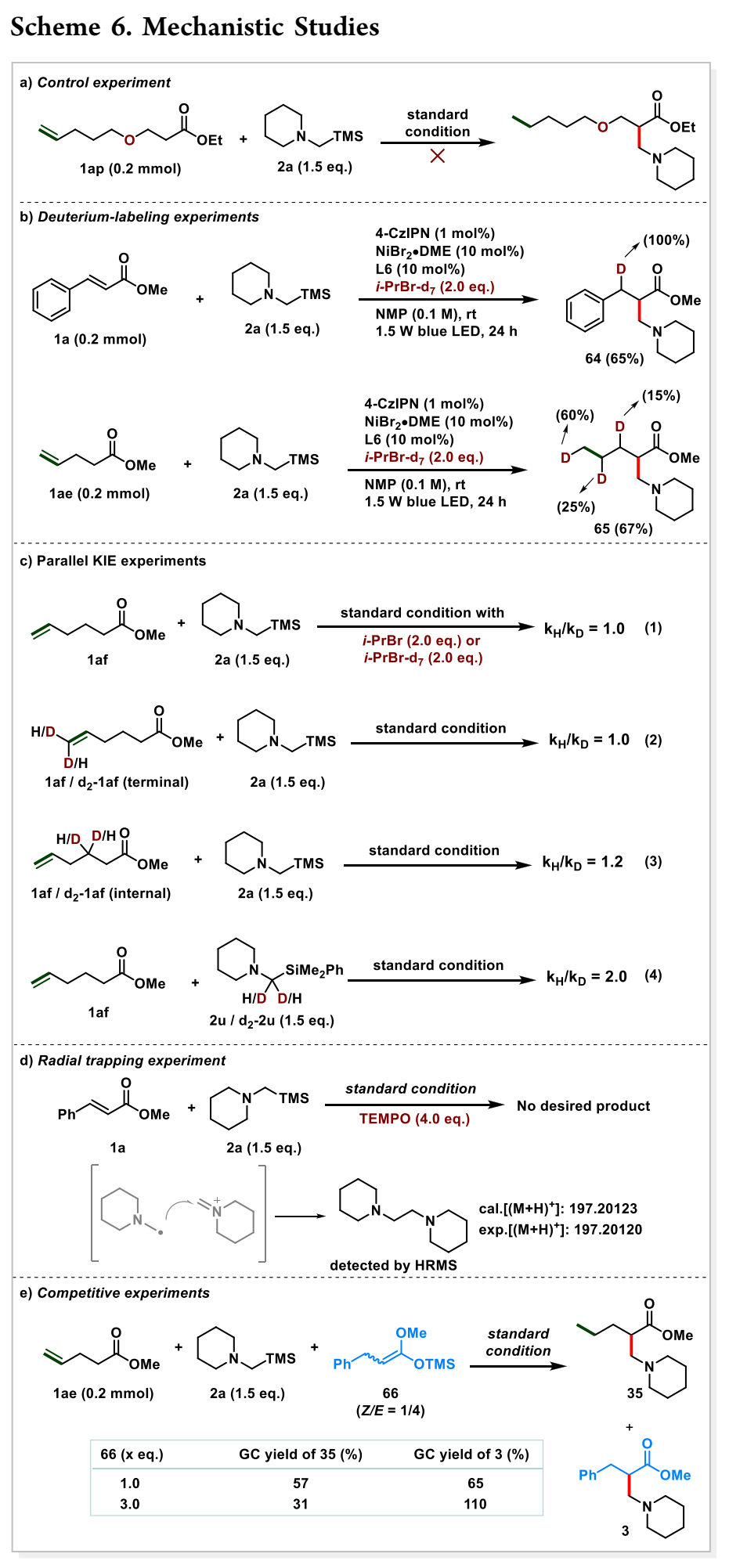
为了深入了解该机制,对含有氧原子间隔物的衬底1ap进行了对照实验。由于缺乏β-氢,向α-羰基位置的链行走被阻断;仅观察到烯烃异构化和还原氢化(方案6a)。进行了氘标记实验,以了解NiH的行为(方案6b)。在与肉桂酸甲酯的反应中,在苄基位置观察到100%的氘掺入。这表明NiH迁移插入烯烃以形成α-羰基镍物种具有唯一的区域选择性,因此排除了Giese加成途径(表1,条目11和12)。相反,戊-4-烯酸甲酯1ae导致氘沿着碳链标记,表明可逆的β-H消除/迁移插入序列。作者进一步用氘化底物进行了动力学同位素效应(KIE)实验。缺乏动力学同位素效应(KIE)表明β-H消除和迁移插入步骤不涉及速率确定步骤(RDS)(方案6c,1-3)。然而,使用2u和d2-2u进行的KIE实验导致观察到较大的二次KIE为2.0(方案6c-4),这表明α-硅胺氧化/脱硅形成α-氨基径向或亚氨基离子中间体(更可能)可能是RDS。进行了自由基捕获实验,以更深入地了解其机制(方案6d)。当添加4.0当量的(2,2,6,6-四甲基哌啶-1-基)氧基(TEMPO)时,反应被完全抑制,表明可能存在自由基途径。此外,通过高分辨率质谱(HRMS)检测到二胺产物,该产物可能是由α-氨基自由基与亚胺离子中间体的自由基加成形成的。此外,合成了硅烯酮缩醛68,并将其置于标准条件下(方案6e)。除了预期产物35外,在65%的GC产率中还检测到竞争性Mannich型产物3,当外源硅烯酮缩醛的量增加时,3的产率增加。这表明硅烯酮缩醛可能是最终键形成过程中的中间体之一。
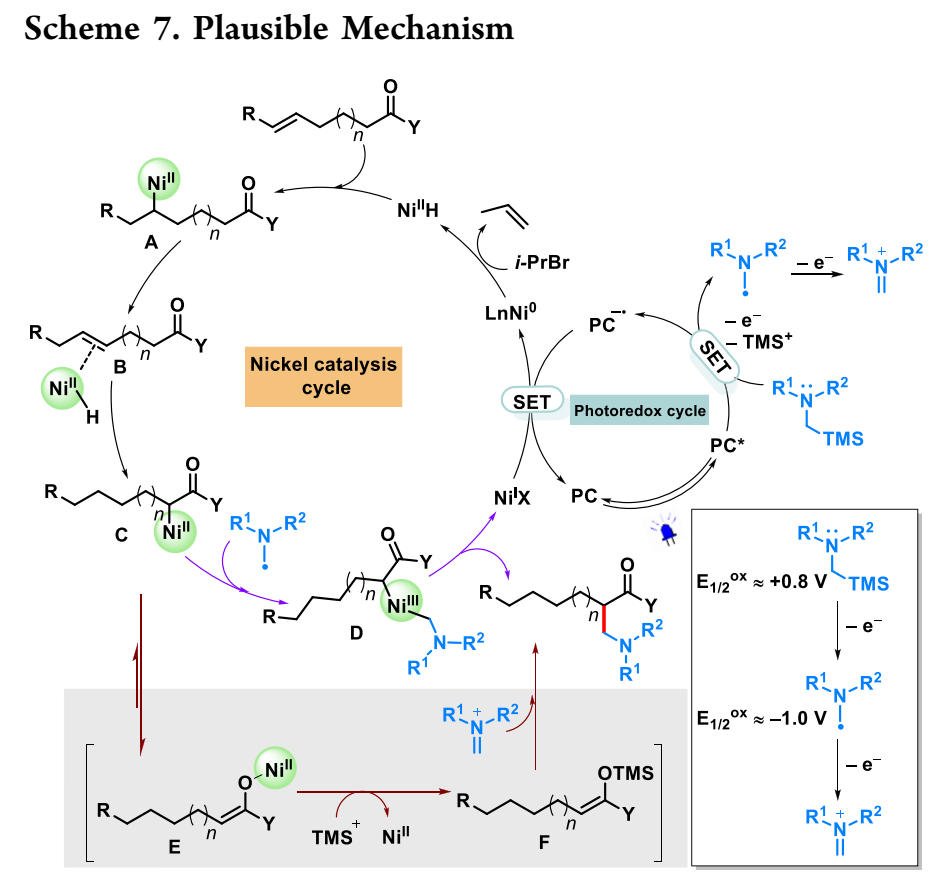
基于上述机理研究,作者提出了NiH/光氧化二元催化HAA反应的两条催化途径(方案7)。将Ni0氧化添加到iPrBr中,然后消除β-氢化物,生成NiIIH物种。当n=0时,NiIIH迁移插入烯烃中,只提供稳定的α-羰基NiII。当n时≠ o、 反复的β-氢化物消除/迁移插入序列最终导致α-羰基NiII(C)。Asα-硅胺具有较低的氧化电位(E1/2ox=+0.4∼ +0.8 V),它们可以被光催化剂的激发态(E1/2PC*/PC-=+1.35 V vs SCE)氧化,形成α-氨基自由基,可被α-羰基NiII截留,形成NiIII物种(D)。然后发生还原消除,以提供(远程)HAA产品和Ni(I)。最后,PC还原态(E1/2PC/PC-=−1.21 V vs SCE)和Ni(I)[Ered(NiI/Ni0)=−1.17 V vs SCE]再生Ni0和光催化剂。然而,鉴于α-氨基自由基比起始胺更容易氧化,也可能有另一种途径。具体而言,α-羰基NiII(C)有通过Ni/Si转化形成更稳定的NiII烯醇化物(E)或其硅烯酮缩醛形式(F)的趋势。亚胺离子和硅烯酮缩醛之间的Mannich型反应也可以得到所需的产物。该循环由PC和NiII还原状态之间的两个SET事件完成。
总之,本文报道了一种高效的活化和非活化烯烃的HAA,通过双光氧化/镍催化具有唯一的α-选择性。这种方法可以方便地获得有价值的β-氨基酸衍生物,并且具有胺和烯烃的广泛底物范围。该实验室目前正在进行进一步的研究,以加深对不对称变体的机制和发展的理解。
Remote and Proximal Hydroaminoalkylation of Alkenes Enabled by Photoredox/Nickel Dual Catalysis
Songlin Zheng, Wenlong Wang, and Weiming Yuan* (华中科技大学)
DOI: 10.1021/jacs.2c08039





