北京化工大学许家喜课题组Org. Lett.:光促进串联反应构建3-螺环-2-磺酰亚胺吲哚啉骨架
稠合和螺环多环吲哚啉衍生物,特别是3-螺环吲哚啉-2-酮,因其独特的三维结构和更好的生物利用度和代谢稳定性,是许多重要的合成和天然药物以及具有显著生物学意义的天然生物碱。3-螺环吲哚啉-2-酮C3位螺环的结构特征和大小在很大程度上决定了该类化合物的生物活性。因此,开发高效便捷的不同3-螺环吲哚啉-2-酮骨架的合成方法对于新药的研发和生产具有重要意义。
近日,北京化工大学许家喜课题组报道了一种3-重氮-2-磺酰亚胺吲哚啉和N-甲氧基甲基-N-[(三甲基硅基)甲基]苄胺的光促串联反应,能够在温和条件下一步构建两种结构不同且可分离的3-螺环-2-磺酰亚胺吲哚啉骨架,并进一步转化为3-螺环吲哚啉-2-酮衍生物。在该反应中,不仅将市售的N-甲氧基甲基-N-[(三甲基硅基)甲基]苄胺作为非稳定亚胺叶立德前体,而且作为单原子和双原子合成子,从而丰富了这类物质的反应类型。该反应具有原料易得、反应条件温和、总收率高、易于进一步转化为相应的3-螺吲哚啉-2-酮等特点。相关成果在线发表于Org. Lett.
1′-烷基螺[吲哚啉-3,3′-吡咯烷]-2-酮在各种3-螺环吲哚啉骨架中具有独特的生物抑制活性(DOI: 10.1038/srep32213)。该类特征结构广泛存在于生物碱和小分子抑制剂中。在60多年的历史中,色胺通常被用作构建这种骨架的起始材料。它们通常通过与醛的Pictet-Spengler反应、生成的哌啶环上的N-烷基化和进一步的氧化缩环转化为螺[吲哚啉-3,3′-吡咯烷]-2-酮。然而,该策略涉及步骤较多,且通常需要使用有毒氧化剂(图1a)(DOI: 10.1016/S0957-4166(00)86273-4)。亚胺叶立德和3-亚烷基吲哚啉-2-酮的[2+3]偶极环加成反应或3-螺环丙烷吲哚啉-2-酮和亚胺的环化反应是构建螺[吲哚啉-3,3′-吡咯烷]-2-酮的另一种有效方法。由于这两种合成策略都需要反应底物带有特殊取代基来稳定其结构并提高其反应性,因此它们不易构建只有N′-烷基取代的目标骨架(图1b)(DOI: 10.1039/D0QO01085E)。近年来,Moshkin及其同事对非稳定亚胺叶立德的环化反应进行了深入研究。他们报道了两种使用非稳定亚胺叶立德一步法合成螺[吲哚啉-3,3′-吡咯烷]-2-酮的方法(图1c)。然而,这两种方法都需要高温,导致实际应用有限。多组分串联反应是有机合成的有效策略,且已被用于合成螺吲哚啉-2-酮类化合物。该文使用廉价易得的原料以及温和的条件,通过光促串联环化反应实现了两种3-螺环-2-磺酰亚胺吲哚啉的便捷合成(图1d)。
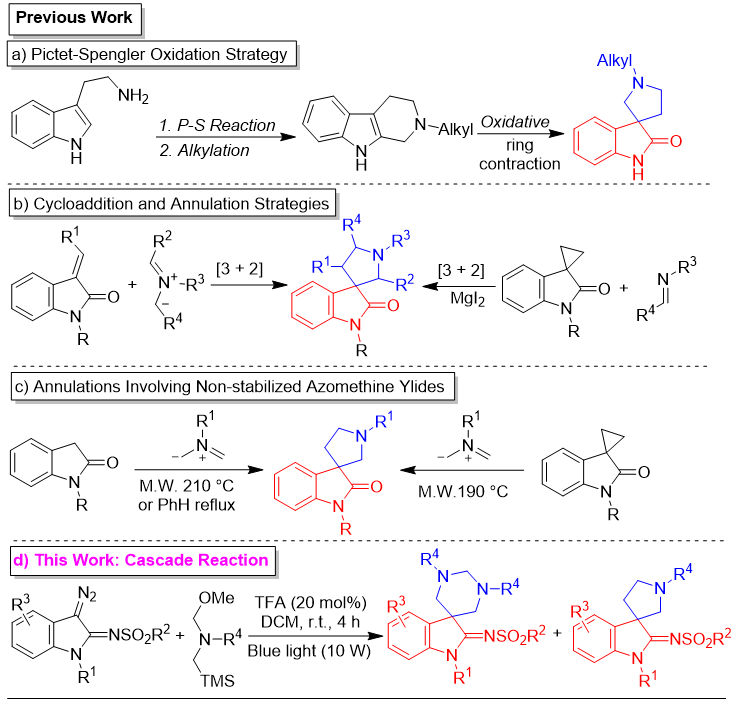
图1. 1'-烷基螺[吲哚-3,3'-吡咯烷]-2-酮的构建策略(来源:Org. Lett.)
作者以3-重氮-1-甲基-2-对甲苯磺酰胺亚胺吲哚啉(1a)与N-甲氧基甲基-N-[(三甲基硅基)甲基]苄胺(2a)作为原料对反应条件进行了优化,反应在最优条件下以99%的总产率和1:2.4的比率得到目标产物N-(1',3'-二苄基-1-甲基-1',3',4',6'-四氢-2'H-螺[吲哚啉-3,5'-嘧啶]-2-亚基)-4-甲基苯磺酰胺(3aa)和N-(1'-苄基-1-甲基螺[吲哚啉-3,3'-吡咯烷]-2-亚基)-4-甲基苯磺酰胺(4aa)。为了考察该合成方法的底物适用范围,尝试了一系列含有不同取代基的3-重氮吲哚啉-2-亚胺1与N-甲氧基甲基-N-[(三甲基硅基)甲基]苄胺2(图2)。首先考察了3-重氮吲哚啉-2-亚胺的适用范围。吲哚啉氮上带有烷基,苄基或烯丙基时,均能以优秀的总产率得到目标产物;当连有炔丙基时,反应体系杂乱;只连有氢原子时,总产率和产物选择性有所下降。更换磺酰基上的基团(R2),对反应影响不明显。吲哚啉4号位带有甲氧基时,由于位阻较大,不利于生成中间体A(见后文),反应不能发生。将甲氧基换成半径较小的氟原子时,只以54%的产率得到4oa,没有3oa生成。吲哚啉5、6号位带有取代基时,反应均能以中等至优秀的总产率(65%-99%)得到目标产物,两产物比例最优可达1:4。也对不同N-甲氧基甲基-N-[(三甲基硅基)甲基]苄胺进行了考察。苄基苯环上带有氟原子和三氟甲基时,均以优秀的总产率和稍低的选择性得到了对应目标产物。实验结果表明,该反应具有广泛的适用性。
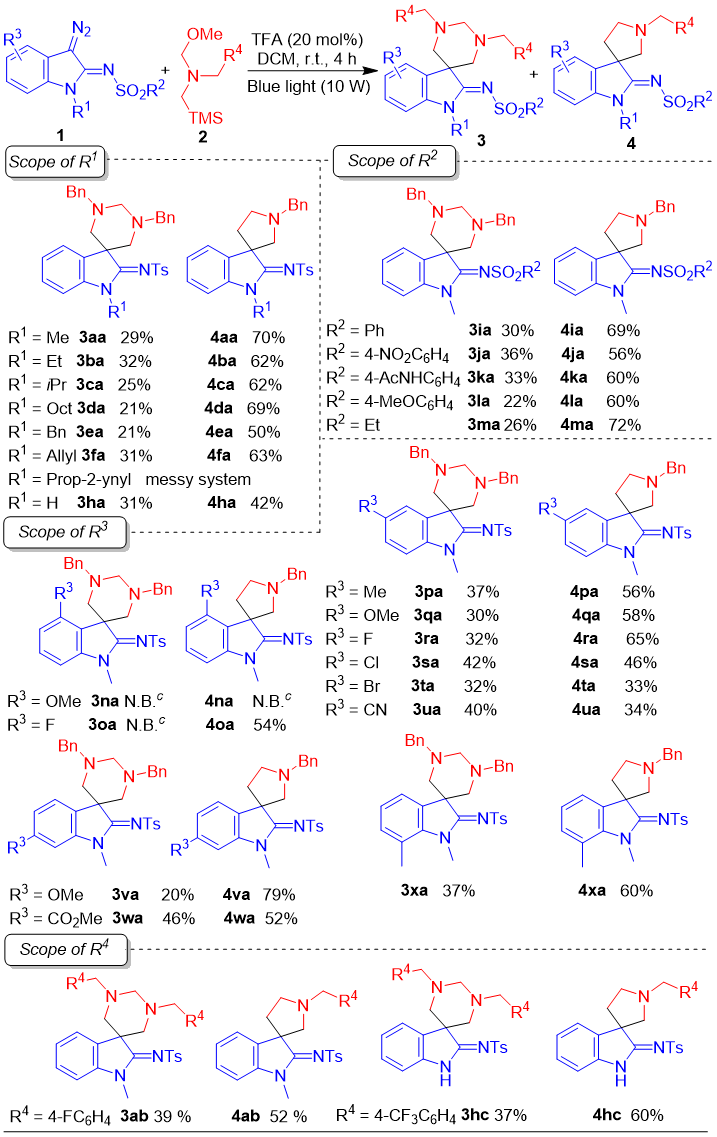
图2. 反应底物适用范围研究(来源:Org. Lett.)
随后,为说明反应的实用性,尝试了克级反应,同样取得了良好的总产率(图3a)。由于3-螺环吲哚啉-2-酮是重要的生物和药物制剂,尝试了在碱性环境下将亚胺水解至相应的酮,成功实现了产物向对应的3-螺环吲哚啉-2-酮的当量转化(图3b)。基于这个方法,以良好的总收率合成了遏制恶性疟原虫Dd2体外生长的抑制剂和六磷酸肌醇激酶1小分子抑制剂(图3c)。为进一步简化这一合成3-螺环吲哚啉-2-酮的方法,尝试并以优秀的总产率成功实现了一锅串联合成(图3d)。
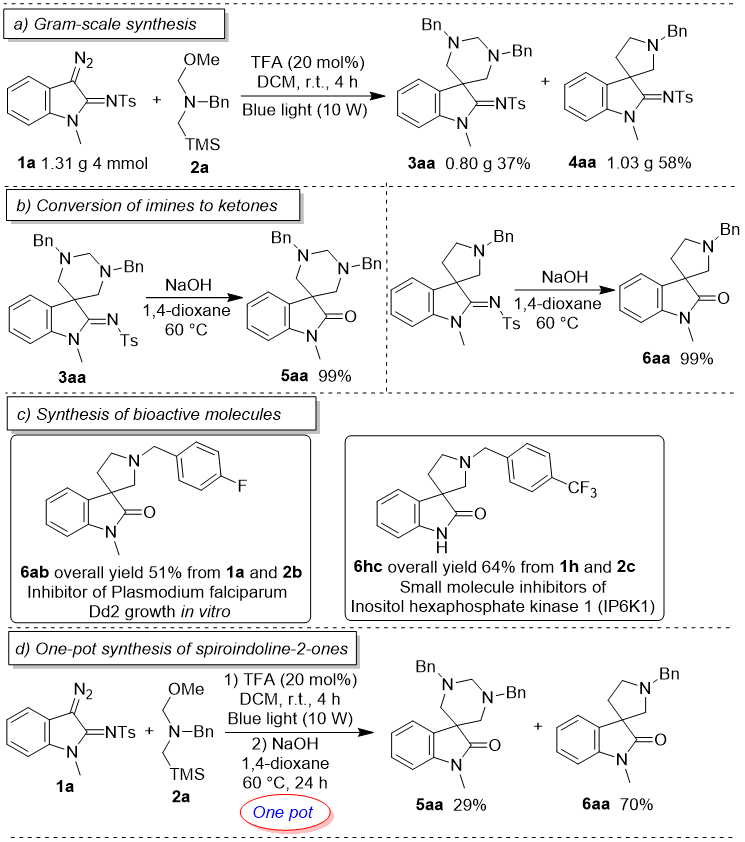
图3. 克级反应与衍生化反应(来源:Org. Lett.)
N-甲氧基甲基-N-[(三甲基硅基)甲基]苄胺(2a)通常用作非稳定亚胺叶立德的前体,通过TFA或氟离子引发,脱去一分子TMSOMe后与其他不饱和键或偶极子进行[3+n]环化(DOI: 10.1021/jo00378a013)。然而,在本反应中,该类物质以单原子、双原子和三原子合成子的形式参与环的构建,这在以前鲜有报道。为了解反应机理,进行了一系列控制实验。同位素实验明确了反应历程中各原子的去向(图4a-c);向反应体系中加入多聚甲醛,体系中原位生成的亚胺叶立德被淬灭,此时3aa的生成受影响不大,而4aa不再生成,说明4aa的生成离不开亚胺叶立德的参与,而3aa的生成源于1a和2a的直接反应(图4d);为了测试由3-重氮吲哚啉-2-酮直接合成3-螺环吲哚啉-2-酮类衍生物的方法,尝试了3-重氮-1-甲基吲哚-2-酮(7)和2a的反应,没有观察到目标产物生成,说明磺酰亚胺结构在串联反应中起着重要作用(图4e);降低2a的用量,缩短反应时间并将体系置于黑暗环境中进行反应,产率大幅下降,此时通过GC-MS和LC-HRMS在体系中检测到了中间体J,H,I和K(见后文)的生成(图4f)。

图4. 控制实验(来源:Org. Lett.)
最后,根据控制实验结果推测反应机理如下(图5):以1a和2a的反应为例。重氮1a对质子化的2aH发生亲核取代,脱去一分子甲醇形成中间体A,它的胺基进一步与第二个质子化的2aH进行另一次亲核取代,得到中间体B,中间体B在体系中被亲核试剂(:Nu-,如CF3CO2-、MeOH等)亲核进攻,生成中间体C。中间体C很容易发生σ键复分解或分子内亲核取代,部分转化为中间体C'(约三分之一)。中间体C和C'都会脱去氮气,并经分子内关环形成中间体E和E',它们进一步与反应混合物中的亲核试剂发生亲核取代,脱去TMSCH2Nu生成最终产物3aa。如果使用氘代的2a-d2,将产生3aa-d4,其4′-、2′-和6′-位分别有100%、66%和33%的氘代率。
重氮1a亲核进攻亚胺正离子F形成中间体A',中间体A'进一步被反应体系中的亲核试剂(:Nu-)进攻,脱去TMSNu产生中间体H。中间体H脱氮气形成两性离子中间体I,该中间体I发生裂解,脱去N-苄基亚胺(J)得到中间体K。中间体K进一步与亚胺叶立德G进行[2+3]环加成反应,得到最终产物4aa。在控制实验中观察到了中间体J(在GC-MS中)、H、I和K(在LC-HRMS中)。如果使用2a-d2,产生的N-苄基亚胺(J)将与氘代亚胺正离子F-d2发生交换反应,形成未氘代的F,F与1a反应得到未氘代的中间体H,并进一步反应得到未氘代的中间体K,这导致产物4aa-d4 4'-位的氘代率降低。未氘代的F会进一步产生未氘代的甲亚胺叶立德G,导致产物4aa-d4的2'-和5'-位置的氘代率降低。这就是4aa-d4在4′-、2′-和5′-位置分别会有66%(或80%)、33%(或40%)和33%(或40%)氘代的原因。
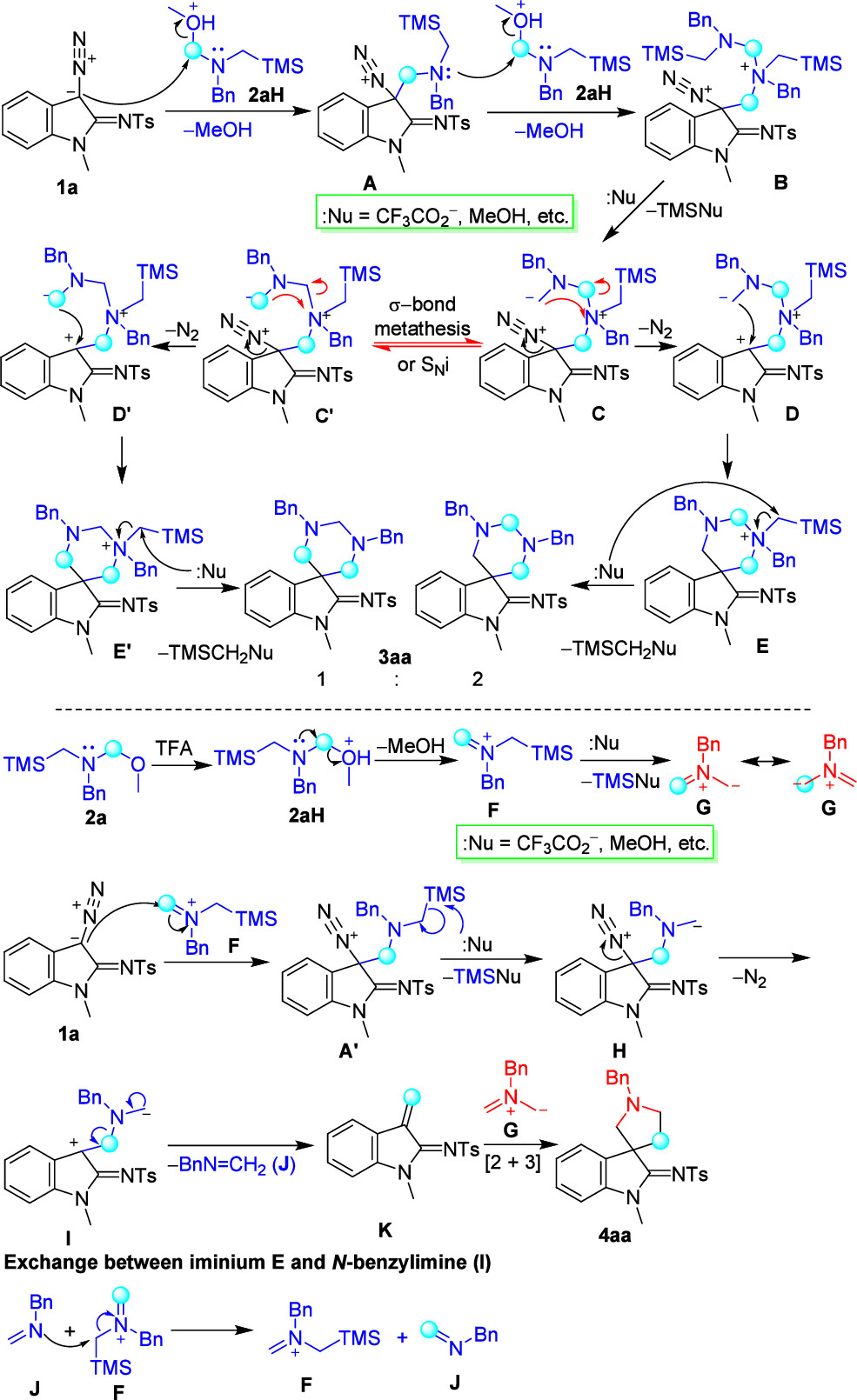
图5. 反应机理(来源:Org. Lett.)
综上,作者开发了一种通过3-重氮-2-磺酰亚胺吲哚啉和N-甲氧基甲基-N-[(三甲基硅基)甲基]苄胺的串联反应同时合成两类3-螺环-2-磺酰亚胺吲哚啉衍生物的新方法。该方法具有原料易得、反应条件温和、总收率高、易于进一步转化为相应的3-螺环吲哚啉-2-酮的特点。值得注意的是,这种方法独特地使用了市售的N-甲氧基甲基-N-[(三甲基硅基)甲基]苄胺,不仅作为非稳定的甲亚胺叶立德前体,而且作为单原子和双原子合成子,从而丰富了这些物质的反应类型。此外,基于一系列氘代实验和控制实验的混合物HRMS分析,提出了合理的反应机理,阐明了N-甲氧基甲基-N-[(三甲基硅基)甲基]苄胺的多样化应用潜力。
研究工作实验部分由第一作者博士生魏宇梁完成。研究工作得到了国家自然科学基金(21772010)的资助。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





