摘要:近日,湘潭大学化学学院黄华文教授课题组在温和条件下发展了一种N-芳基亚磺酰基丙烯酰胺与溴二氟乙酰胺的光氧化还原自由基Truce-Smiles重排反应策略,以中等到良好的收率合成了一系列芳基二氟戊二酰胺。
由于有机氟化合物独特的物理化学性质,其在医药、材料和合成化学中发挥着重要作用。因此,在化合物中加入氟单元成为有机合成领域的焦点。特别是溴代氟乙酸酯类化合物已被证明是二氟烷基自由基的强大前体,并被广泛应用于各种催化体系的有机氟化物的构建,包括过渡金属催化、光氧化还原催化、电化学和机械化学等。近日,湘潭大学化学学院黄华文教授课题组在温和条件下发展了一种N-芳基亚磺酰基丙烯酰胺与溴二氟乙酰胺的光氧化还原自由基Truce-Smiles重排反应策略,以中等到良好的收率合成了一系列芳基二氟戊二酰胺;并且用手性亚胺进行不对称合成,得到了具有一定对映选择性的季碳中心芳基二氟戊二酰胺化合物。相关成果在以Photoredox Radical Truce–Smiles Rearrangement of N-Sulfinyl Acrylamides with Bromodifluoroacetamides为题在线发表于Organic Letters。
自由基介导的N-磺酰基丙烯酰胺Truce−Smiles重排反应(TSR)通过芳基迁移为烯烃的双官能化提供了一个通用的平台。该策略允许合成2-吲哚酮和α-芳酰胺,其化学选择性通常取决于N取代基的性质(图1a)。最近,扬州大学的杨文超团队报道了一种电子供体控制的N-烷基磺酰基丙烯酰胺和Br−RF之间的发散性转化反应,合成了一系列含氟氧化吲哚和酰胺化合物。2021年,Nevado课题组巧妙地设计了一种可见光诱导的手性N-亚砜酰丙烯酰胺的光氧化还原Truce−Smiles重排(TSR),这项工作提出了一种高效方法,当与磺酰氯和其他几种自由基前体与手性N-亚砜酰丙烯酰胺反应时,可以将手性从硫中心转移到季碳(图1b)。Wu课题组采用三组份二氧化硫插入有机吖啶的方法,进一步推进了这一重排(图1c)。在目前的研究中,本文正在进行的可持续光化学合成项目中,本文的目标是报道一种光化学体系,该体系通过Truce−Smiles重排反应,用N−芳基亚砜酰基丙烯酰胺与溴代二氟乙酰胺实现双官能偶联形成二氟戊二酰胺(图1d)。

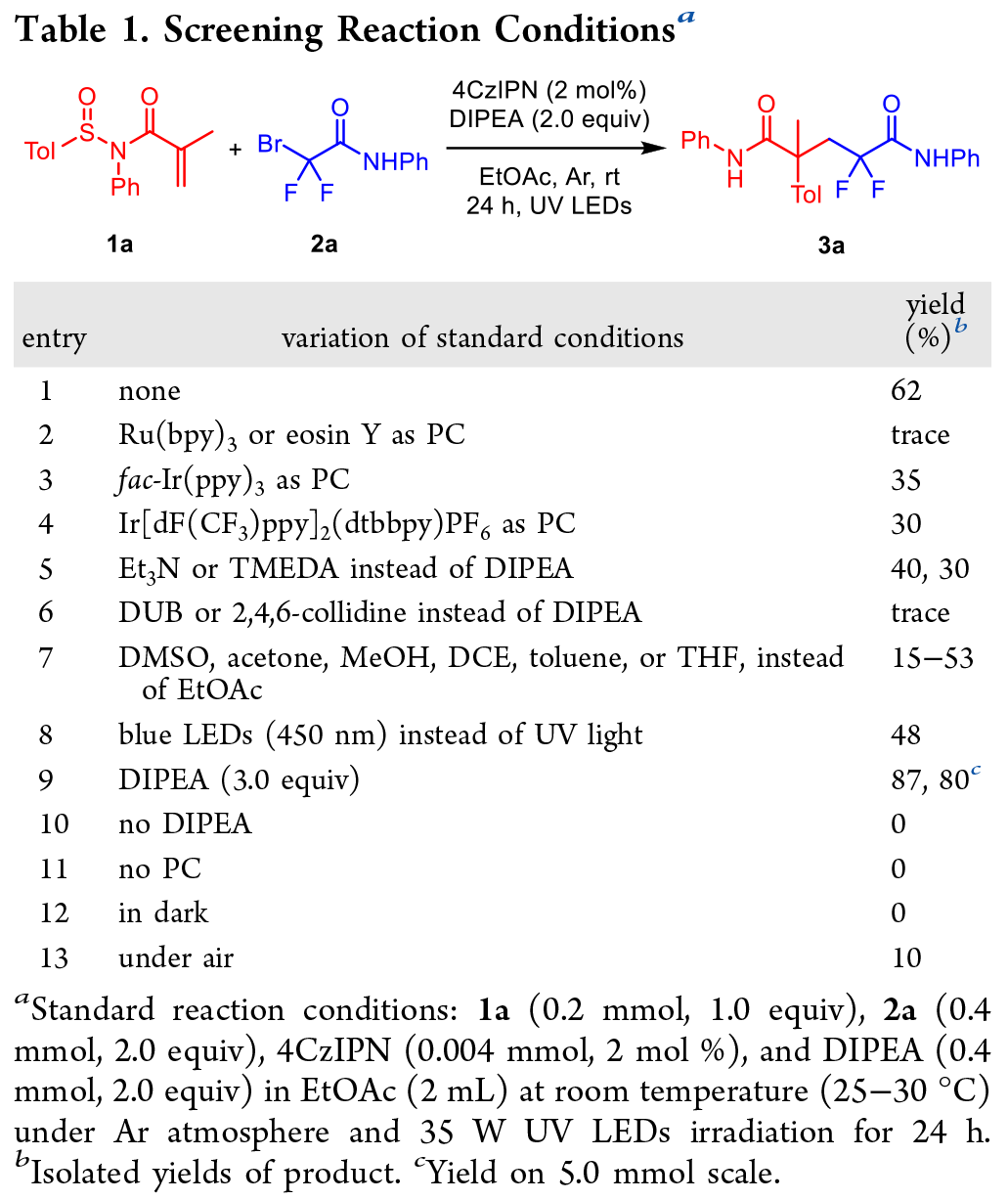
图1 丙烯酰胺的 Radical Truce-Smiles 重排反应 (RTSR)(来源:Org. Lett.)首先,作者选择了外消旋N-苯基-N-亚砜基丙烯酰胺1a和N-苯基溴代氟乙酰胺2a作为模型反应底物,以评估Truce−Smiles重排反应的可行性(表1)。通过一系列的条件优化,我们最终得出模板反应条件为:在紫外光(365 nm)下,以4CzIPN为光催化剂,以3.0当量的N,N-二异丙基乙胺(DIPEA)为还原剂,在EtOAc中进行反应,以87%的收率制得所需的二氟戊酰胺产物3a。对照实验表明,胺添加剂是必不可少的(条目10),它可能既是酸受体又是电子供体;光催化剂和光照射都是必不可少的(条目11和12),并且在空气气氛中进行反应显著降低了转化率(条目13)。最后,发现最佳反应条件可以进行克级反应扩展,可在80%的收率下生成所需产物3a(条目9)。表1 模型反应的条件筛选(来源:Org. Lett.)
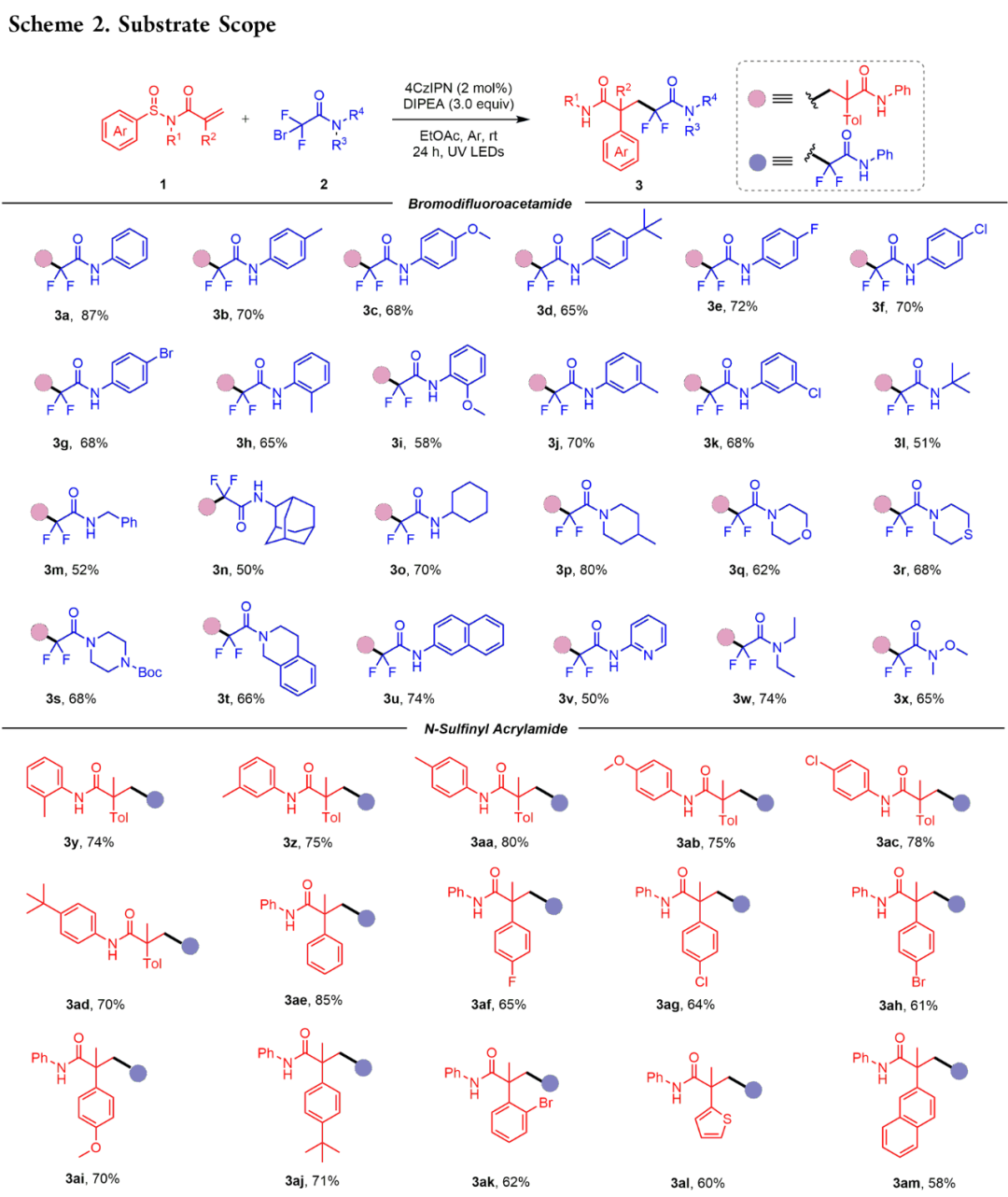
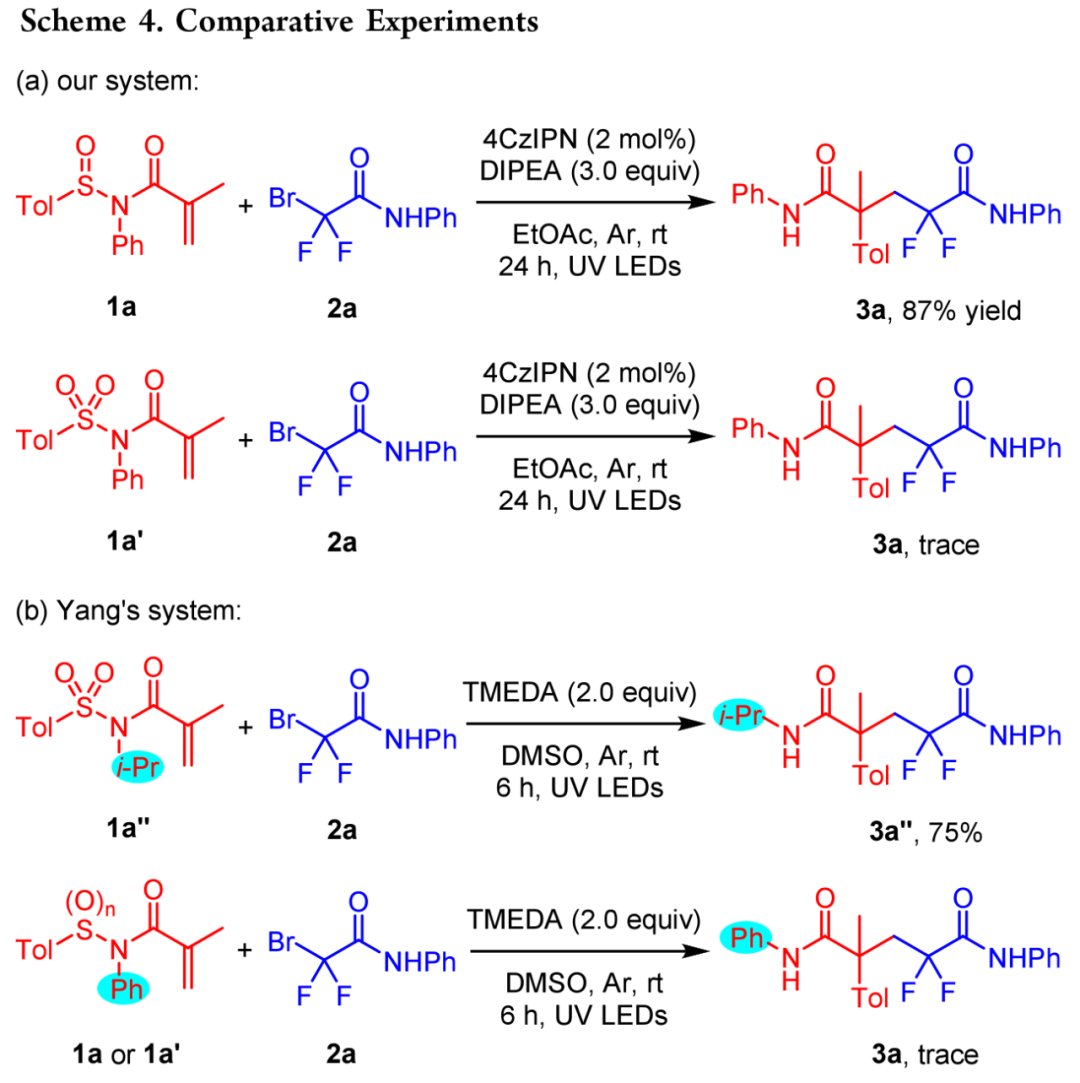
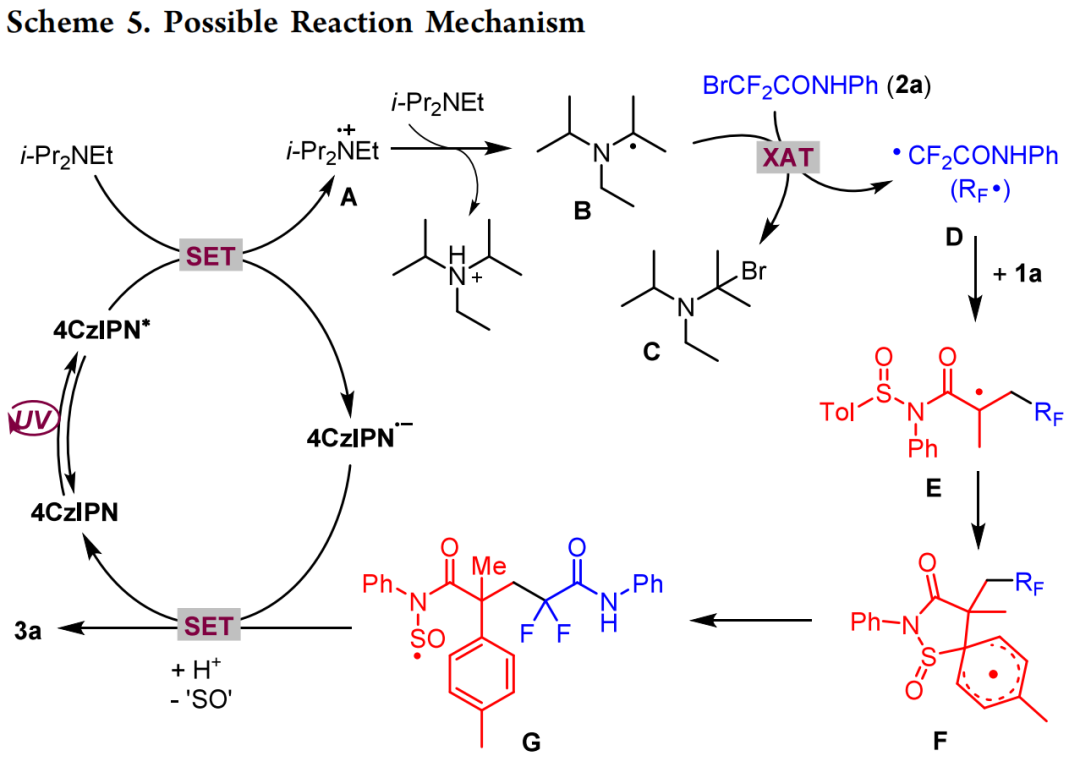
在确定了最佳反应条件后,作者接下来评估了可见光诱导光氧化还原催化体系(图2)的通用性。一系列苯环上带有不同官能团的N−芳基溴代二氟乙酰胺在该体系下与1a进行反应,得到相应的二氟戊二酰胺产物,产率中等至较高(3b - 3k)。烷基、甲氧基和卤代(氟、氯、溴)等官能团,无论位于邻位、间位还是对位,都具有良好的耐受性。含有 t-Bu (3l)、苄基 (3m)、金刚烷基 (3n)和环己基 (3o)的N-烷基溴二氟乙酰胺也能以中等产量生成所需的产物。环胺衍生的溴二氟乙酰胺,包括具有哌啶基(3p)、吗啉基(3q)、硫代吗啉基(3r)、哌嗪基(3s)和四氢异喹啉基(3t)分子的溴二氟乙酰胺,都是合适的底物,一般都能以良好的产率获得所需的产物。2-萘胺和 2-氨基吡啶等自由基前体生成的产物3u和3v,收率分别为74%和50%。2-溴-N,N-二乙基-2,2-二氟乙酰胺与1a结合生成产物3w,收率为74%,而N-甲氧基乙酰胺的收率则降低到65%(3x)。接下来,一系列外消旋 N-芳基-N-芳基亚磺酰基丙烯酰胺被用作自由基受体,两个苯环可被各种官能团取代,最终得到的产品一般收率较高(3y-3ak)。值得注意的是,带有4-溴(3ah)或2-溴(3ak)取代基的迁移基团苯基具有相似的反应活性。此外,噻吩基(3al)和萘基(3am)也能顺利迁移到季碳中心,这证明了这种温和催化体系的高效性。使用亚磺酰基丙烯酰胺进行 Truce-Smiles重排的最大优势之一是可以从手性亚磺酰基底物开始进行不对称合成。因此,本文合成了S-构型的1a与各种溴二氟乙酰胺进行偶联反应。结果表明,在模板反应条件下,产物一般具有适度的对映选择性(图 3)。本文还探索了通过改变溶剂或降低反应温度来改变反应条件;然而实验结果表明,该反应的对映选择性似乎完全取决于自由基前体的理化性质。图3 手性亚砜酰丙烯酰胺的偶联(来源:Org. Lett.)为了突出N-芳基亚磺酰基丙烯酰胺在 Truce-Smiles 自由基重排中的独特反应性,作者使用具有相同取代基的N-芳基磺酰基丙烯酰胺进行了对比实验。虽然亚磺酰基底物以87% 的产率生成了3a,但在当前体系中,磺酰基丙烯酰胺(1a')没有生成任何产物(图 4a)。此外,在杨文超团队最近的研究中,N-i-Pr 磺酰丙烯酰胺被用作底物,并在TMEDA介导下的无光催化剂体系中显示出良好的反应活性。然而,当N-苯基亚砜或磺酰基丙烯酰胺在上述相同的条件下反应时,只观察到微量的产物(图4b)。这些结果突出了本文的催化体系对亚砜酰胺参与的Truce-Smiles自由基重排的独特反应性。作者猜测,光催化剂的加入可以显著地促进二氟烷基自由基的形成,然后进行随后的转化。进行了一系列探索性实验以阐明反应机理。最初,在标准反应条件下,当加入自由基捕获剂TEMPO后,几乎完全抑制了该反应,但未检测到TEMPO-捕获产物。当加入BHT时,目标产物3a的收率仅为20%,而通过GC-MS检测到自由基捕获的产物的收率为8%。当使用DPE时,通过GC-MS检测了DPE的两种捕获产物。这些发现表明该反应可能通过自由基机制进行。随后,进行了开/关实验,结果表明,持续的光照射是这种转变的必要条件,从而排除了自由基链过程的可能性。Stern - Volmer图结果表明,受激发的4CzIPN光催化剂被DIPEA猝灭,但底物1a和2a的猝灭作用很小。根据上述机理研究和之前的报导,本文提出了紫外光介导转化的可能反应机理(图 5)。首先,光催化剂4CzIPN吸收光子形成激发态4CzIPN*。随后,DIPEA作为电子给体促进催化剂4CzIPN*的还原猝灭生成自由基离子中间体A,4CzIPN*被还原为自由基阴离子(4CzIPN•−)。接着,A被DIPEA去质子化形成氨基烷基自由基B。中间体B很容易捕获来自2a的溴原子,产生关键的二氟乙酰胺自由基(D)和溴代DIPEA (C),后者分解成i-PrNHEt和丙酮。随后,D立即与1a结合形成自由基中间体E。中间产物E经过分子内5-元环化,然后C−S键均裂生成中间产物G。随后,中间体G被还原性光催化剂通过单电子转移(SET)还原,随后质子化形成目标产物3a,光催化剂4CzIPN再生。释放的SO可能通过歧化反应生成SO2和S2O。总之,本文开发了一种在温和的光氧化催化下,N-芳基-N-亚磺酰基丙烯酰胺与溴二氟乙酰胺的光诱导芳基烷基化反应。这种转化是通过自由基加成引发的Truce-Smiles重排发生的,以中等到良好的收率产生了多种不同的α-芳基二氟戊二酰胺。用手性亚氨基磺酰胺进行不对称合成,可得到具有适度对映体选择性的以碳为中心的戊二酰胺产物。该方法具有操作简便、效率高、对官能团耐受性好和反应条件温和等特点。本论文实验由湘潭大学化学学院博士研究生田林为本文第一作者,论文通讯作者为湘潭大学黄华文教授和姬小趁副教授。研究工作得到了国家自然科学基金(22071211)和湖南省自然科学基金(2022JJ20037,2020JJ3032)的支持。