摘要:德国波鸿鲁尔大学Mario P. Wiesenfeldt课题组,报道了一种新颖的有机光催化还原反应,可以将缺电子苯环选择性还原成环己烯。
导读
最近,德国波鸿鲁尔大学Mario P. Wiesenfeldt课题组,报道了一种新颖的有机光催化还原反应,可以将缺电子苯环选择性还原成环己烯。反应适用于众多缺电子苯环,耐受33种最常见药物分子官能团和杂芳基中的20种。反应以二氢苯并咪唑苯硫酚盐作为有机供体,通过和缺电子苯预结合生成光激发电子供体−受体(EDA)配合物,诱导苯环温和还原成氧化还原惰性1,4-环己二烯,然后在二氢苯并咪唑亚甲硫醌催化下温和异构化成易被还原1,3-环己二烯,最后还原成环己烯。相关研究成果发表在近期的《美国化学会志》上(J. Am. Chem. Soc. )。
成果
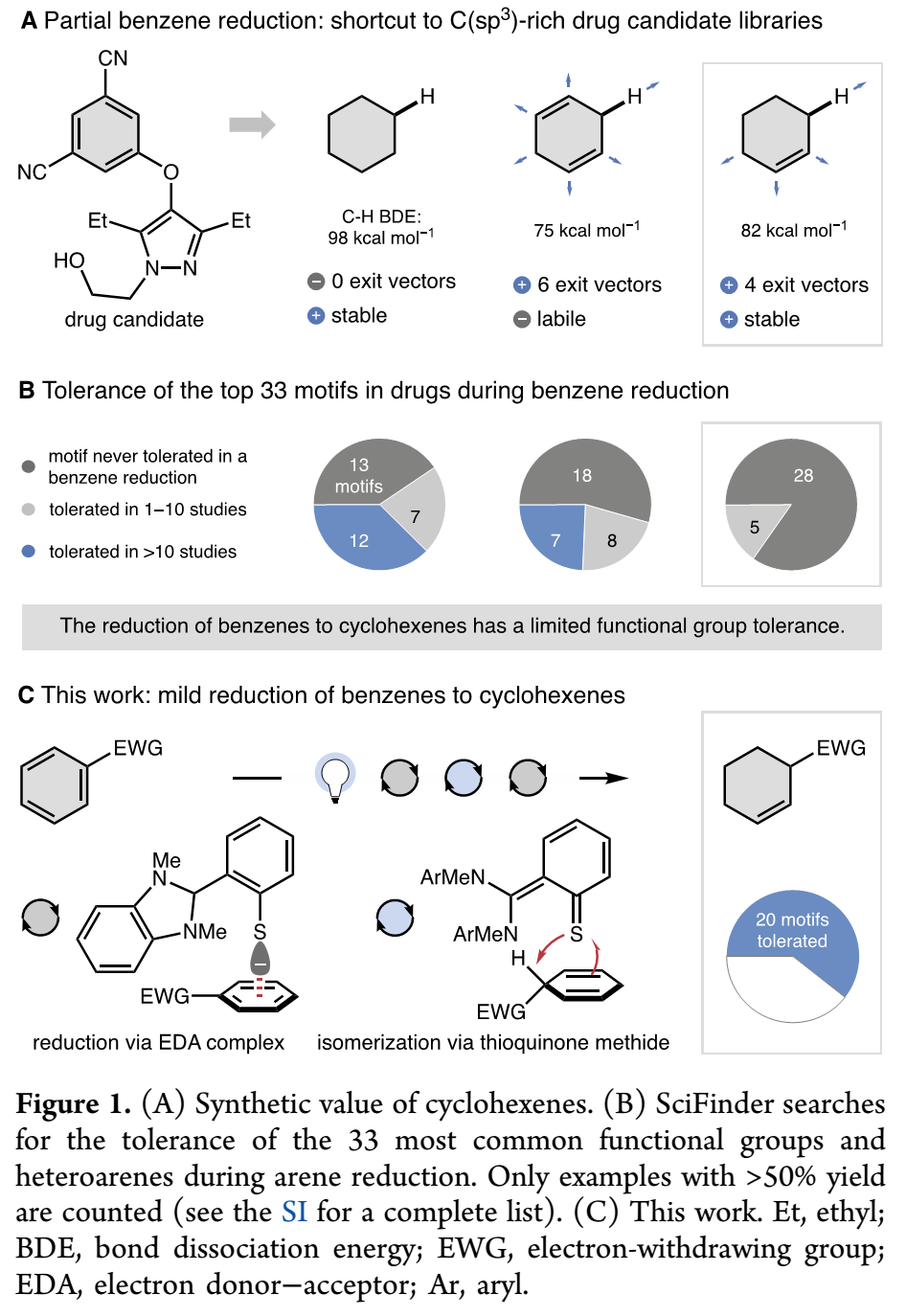
药物化学家认为过度依赖苯环是药物设计中的一个挑战,它限制了药物靶点数量,并导致出现不良药代动力学特征。去芳构化反应可以将芳烃便捷的转化成稀缺富C(sp3)化合物,能减弱这一情况影响。药物候选物或复杂前体上的苯环后期还原方法,能够简化富C(sp3)衍生物的合成,极具研究价值。这一策略如果和部分还原结合,就可以通过烯烃和烯丙位C-H键模块化构建富C(sp3)化合物库,将更具研究价值(Figure 1A)。虽然环己二烯拥有的6个活性C-H键使其可以发生最多官能团化,但许多案例表明环己二烯不稳定,存在的弱C-H键易导致再芳构化发生。相比之下,环己烯拥有4个稍微更强的烯丙位C-H键,能够在后期衍生化和稳定性方面取得平衡。然而,通过Scifinder检索发现,已报道苯部分还原成环己烯方法具有很差的官能团耐受性,很难应用于药物设计(Figure 1B)。为此,Mario P. Wiesenfeldt课题组发展出如Figure 1C所示有机光催化还原反应,可以将缺电子苯环选择性还原成环己烯,且耐受33种最常见药物分子官能团和杂芳基中的20种(>60%)。(Figure 1,图片来源:J. Am. Chem. Soc.)
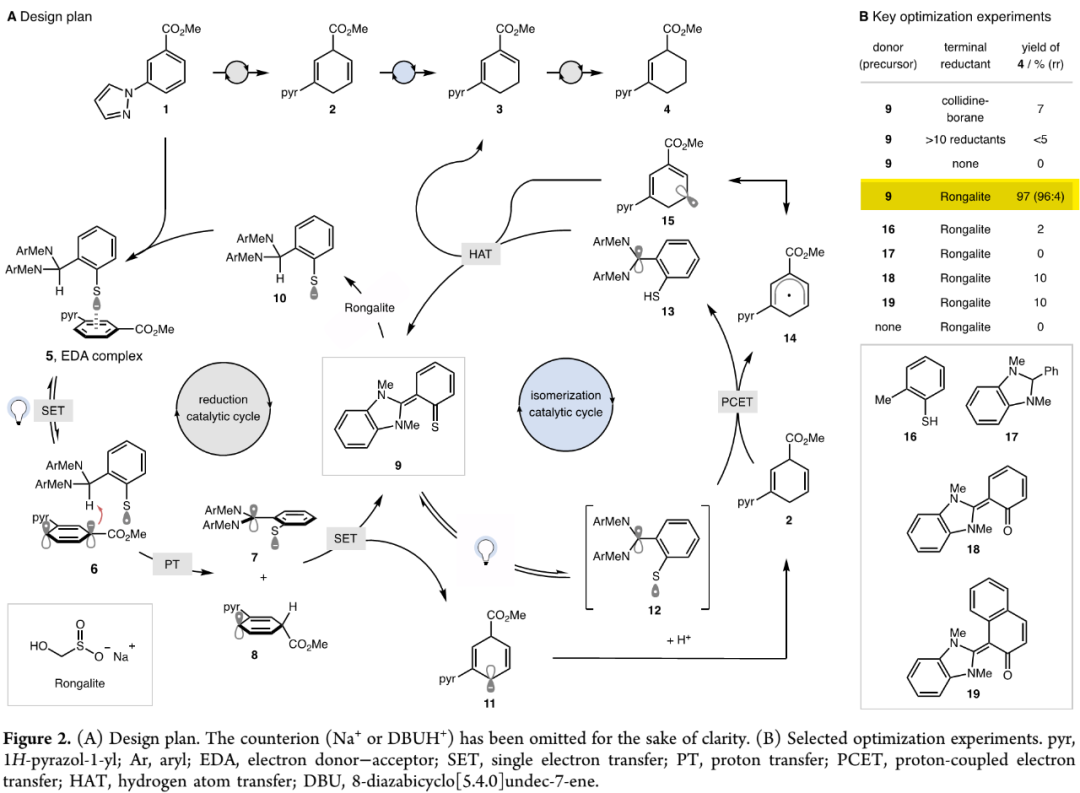
作者设想出如Figure 2A所示还原催化循环/异构催化循环的双催化循环设计:缺电子苯先和有机供体二氢苯并咪唑苯硫酚盐10(dihydrobenzimidazole thiophenolate)形成EDA配合物5;5在光激发下发生单电子转移(SET)生成自由基离子对6,6发生质子迁移(PT)生成高稳定性自由基7和环己二烯自由基8;ɑ-氮原子和强供电子硫所提供的阳离子稳定性使7具有强还原能力,能够将8还原成负离子11并得到二氢苯并咪唑亚甲硫醌9(dihydrobenzimidazole thioquinone methide),11会质子化生成1,4-环己二烯2;9具有两性离子和亚甲基硫醌(thioquinone methide)特征,可以被终端还原剂还原成有机供体10;9也可以在光激发下生成12,使其有能力夺取1,4-环己二烯2中的烯丙位C-H键(BDE=75 kcal/mol),经质子耦合电子转移(PCET)和氢原子转移(HAT)过程,催化异构化成更稳定1,3-环己二烯3(BDE=79 kcal/mol);缺电子1,3-环己二烯3易于被还原成环己烯4,完成整个循环。
基于这一设计,作者以缺电子苯甲酸甲酯1为模板底物,开展反应条件筛选研究。通过对有机供体、终端还原剂、碱、溶剂、浓度、光源和试剂当量等参数进行细致优化(详见SI中Table S2-S12),得出如Figure 2中entry 9所示最优反应条件:15 mol%有机供体9、5当量Rongalite(甲醛次硫酸氢钠)作终端还原剂、0.75当量DBU作碱、0.4 M DMSO溶液、在450 nm LEDs光照下反应24小时,反应能以97%的高产率和96:4的区域选择性(r.r.)得到对应环己烯产物4。其中,有机供体9含有活性供体10中的苯硫酚盐和二氢苯并咪唑(DHBI)基团,与作者设想一致。(Figure 2,图片来源:J. Am. Chem. Soc.)
底物拓展和应用研究(Figure 3、4):
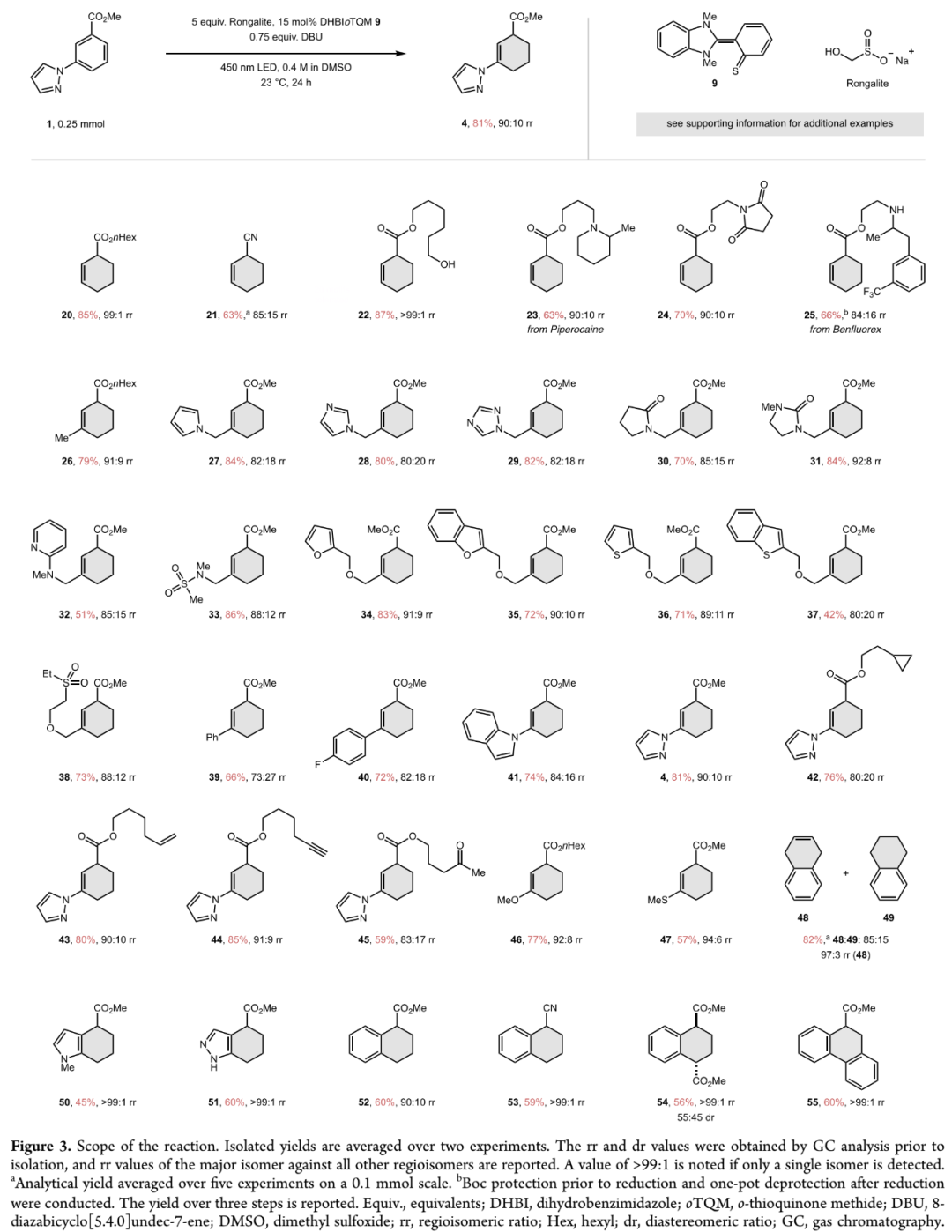
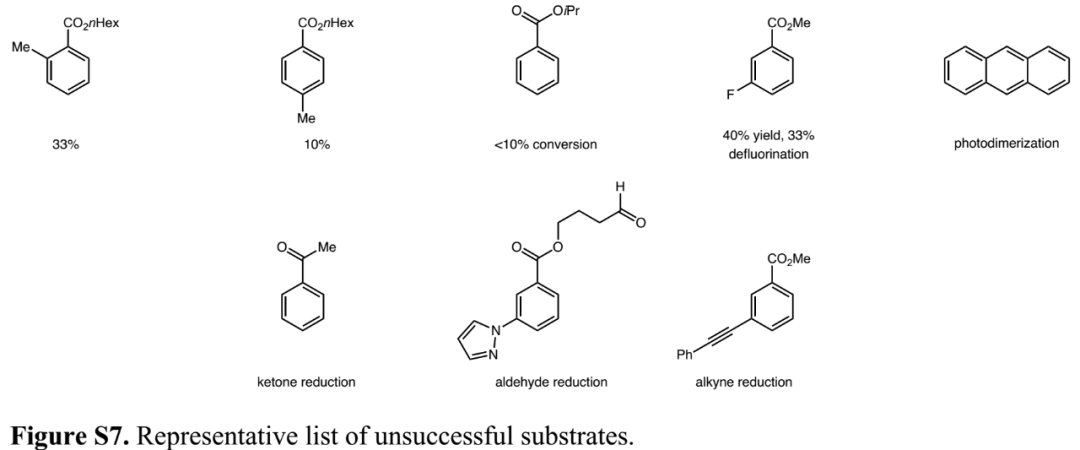
基于优化出的反应条件,作者接着开展底物拓展研究。如Figure 3所示,各种苯甲酸酯和苯甲腈、活性药物分子哌罗卡因和苯氟雷司、萘、吲哚、吲唑、菲等苯环化合物,都可以在优化出的反应条件下,发生有机光催化还原反应,以可观产率和区域选择性得到对应环己烯产物20-55。反应兼容醇羟基、吲唑等含活泼氢基团,咪唑、三唑、氨基吡啶、吡唑、硫醚等路易斯碱基团,腈基、砜、炔等易被还原基团。反应主要选择性发生在更缺电子苯环上,不含活性基团萘也能发生选择性还原得到产物48。含邻、对位取代基苯和苯甲酸异丙酯反应产率很低,可能是空间位阻影响了EDA配合物生成或质子迁移速率降低影响,氟代苯甲酸酯会发生脱氟副反应,蒽会发生光促异构化,部分含醛、酮羰基或炔基苯会发生羰基或炔基还原副反应(Figure S7 in SI)。鉴于经典D-A反应只能构建3-环己烯基羧酸酯,能构建2-环己烯基羧酸酯的逆电子需求D-A反应研究较少,此选择性还原方法为2-环己烯基羧酸酯的合成提供了一种更好方法。(Figure 3,图片来源:J. Am. Chem. Soc.)
(Figure S7 in SI,图片来源:J. Am. Chem. Soc.)
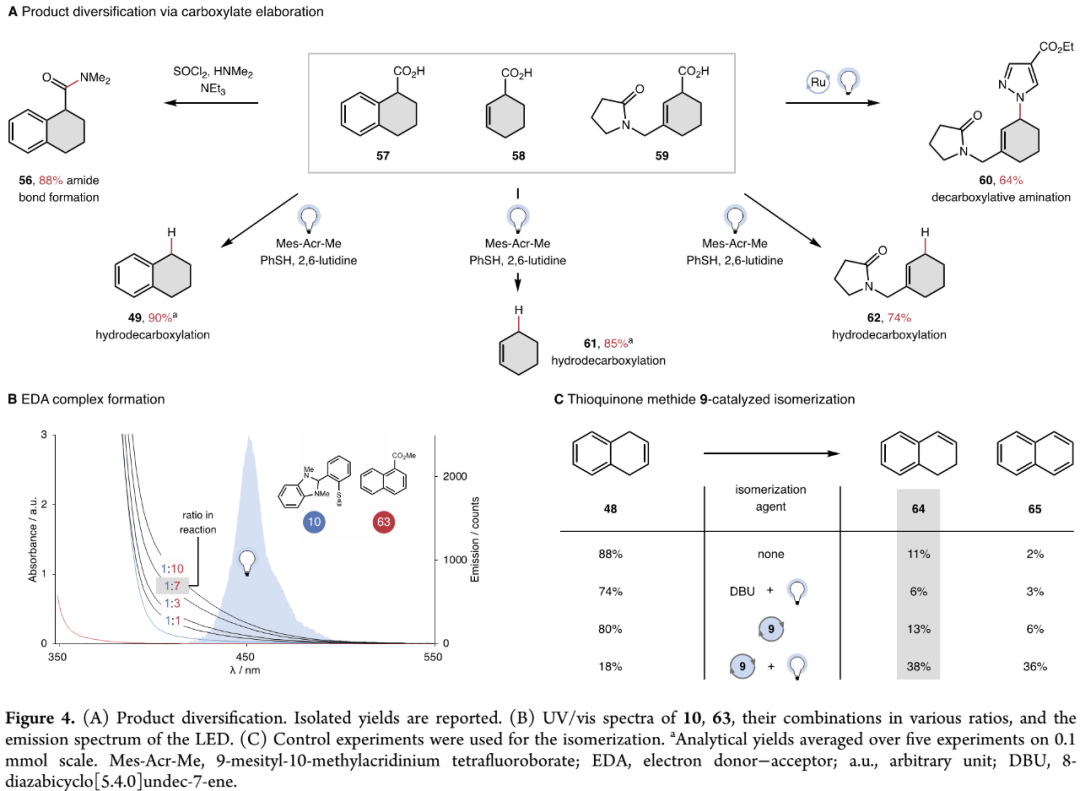
作者继续开展后期衍生化和机理研究。如Figure 4A所示,产物经酯水解所得羧酸57、58、59,可以经酰胺化、加氢脱羧、脱羧氨基化反应,高效转化成产物56、49、60、61、62。Figure 4B的紫外-可见光谱研究证实,有机供体10和底物63在反应中生成了EDA配合物。SI中Figure S8-S12的紫外-可见光谱研究进一步表明,苯硫酚盐是供体片段而不是二氢苯并咪唑(DHBI)。Figure 4C的异构化控制实验发现,二氢苯并咪唑亚甲硫醌9和光源是异构化发生的必需条件,碱DBU并不必需,因而排除碱介导异构化的可能性。对于异构化机理,已报道文献认为氢负离子转移(Hydride Transfer)、氢原子转移(HAT)、氧化/消除、质子耦合电子转移(PCET)都有可能,但鉴于极性不匹配氢负离子和从ɑ-酯基C-H键夺取氢原子,作者更倾向于经PCET机理生成环己二烯自由基,因此Figure 2A提出的双催化循环具有合理性。(Figure 4,图片来源:J. Am. Chem. Soc.)
总结
通过发展出的有机光催化还原反应,Mario P. Wiesenfeldt课题组成功实现缺电子苯环至环己烯的选择性还原。相比环己烯的D-A反应合成方法,该反应能得到正交区域异构体,并兼容多种敏感基团,也可以结合酯水解、脱羧等反应得到各种高价值衍生物。
论文信息
Organophotocatalytic Reduction of Benzenes to Cyclohexenes
Kirti Devi, Asad Shehzad, and Mario P. Wiesenfeldt *