大分子烯烃的光催化氧化官能化
氧化异官能化反应是烯烃和杂原子亲核试剂转化为复杂饱和杂环的最有吸引力的方法之一。然而,最先进的过渡金属催化氧化异官能团化的方法通常仅限于无阻碍的烯烃,不同的亲核伙伴通常需要相当不同的反应条件。在这里,作者证明了Cu(II)介导的自由基−极性交叉允许大体积的三取代和四取代烯烃与多种亲核配对进行高效和非常温和的光催化氧化异官能化反应。此外,作者还证明了这种转化的广泛范围来自于光催化烯烃的活化,从而补充了现有的过渡金属催化的氧化异官能化方法。更广泛地说,这些结果进一步表明,Cu(II)盐是光氧化还原应用的理想终端氧化剂,光催化底物活化和Cu(II)介导的自由基氧化相结合可以解决催化氧化化学中的长期挑战。
氧化烯烃功能化是快速合成饱和杂环的有效方法,常见于许多重要的天然产物、医药和农用化学品中。这些反应具有合成吸引力的原因有很多。此外,与氧化还原中性的烯烃加氢功能化反应相比,氧化烯烃异官能化保留了烯烃官能化功能,这对进一步的合成研究很有价值。最先进的方法是Pd(II)催化的过程,可以通过两条机械上不同的路径中的任何一条进行(方案1):同核配位涉及烯烃在Pd−杂原子键上的迁移插入,而反核配位涉及杂原子亲核剂对Pd(II)配位的烯烃的攻击。然而,这些机制的细节产生了几个值得注意的限制。首先,这两种机械流形都依赖于烯烃与Pd(II)中心的配位。因此,除了少数高度专业化的情况外,配位弱的高取代烯烃在所有情况下都是较差的反应伙伴。第二,底物结构和反应条件的相对细微变化可能会改变操作机理途径,需要重新优化具有不同金属结合倾向的杂原子亲核试剂的反应条件。因此,识别具有不同杂核性的空间受阻烯烃氧化官能化的条件仍然是一个未解决的挑战,Pd(II)催化似乎不能很好地解决这一问题。
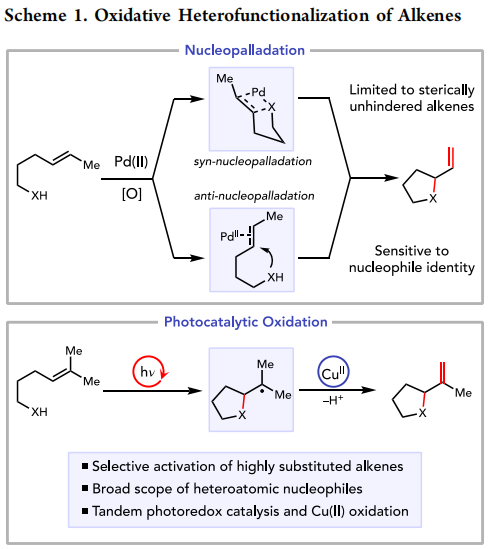
作者设想,光氧化还原催化可能会为氧化烯烃的异官能化提供一种补充策略,而不会存在这些长期存在的问题。富含电子的三取代和四取代烯烃通常是Pd(II)催化氧化异官能化的不良底物,很容易被光氧化还原催化剂活化。此外,Nicewicz和其他人已经证明,生成的烯烃自由基阳离子容易受到高度区域选择性的亲核攻击,并且由于这一步骤不涉及离散的亲核−催化剂相互作用,它们对亲核反应伙伴的身份相对不可知。因此,如果能够找到合适的终端氧化剂来拦截生成的有机中间体并促进氧化消除,这个过程可能会构成一个新的、替代的烯烃氧化异官能化平台。雷和他的同事最近证明了在烯烃与醇或唑的氧化偶联中使用双重光氧化还原/析氢系统的可行性。然而,这些反应仅限于活化的苯乙烯烯烃和结构简单的亲核试剂,因此复杂的饱和杂环基元的构建尚未实现。
廉价的Cu(II)盐是光氧化还原应用的理想终端氧化剂。许多富含电子的自由基物种被Cu(II)有效地氧化,这提供了一种手段,通过自由基−极性交叉,使典型的有机化学反应转向正式的阳离子反应。作者利用这一组合设计了一种光催化方法,用于苄基C−-H键的烷氧基化和富电子油类的光催化氧胺化。然而,为了实现氧化异官能化,自由基机制必须通过另一种氧化消除过程来终止。Kochi的开创性研究表明,通过调节反应条件,热生成的有机化合物可以转向氧化取代或氧化消除,以及Glorius和Tunge最近的研究表明,Cu(II)介导的氧化消除途径对光化学脱羧产生的自由基是有效的。
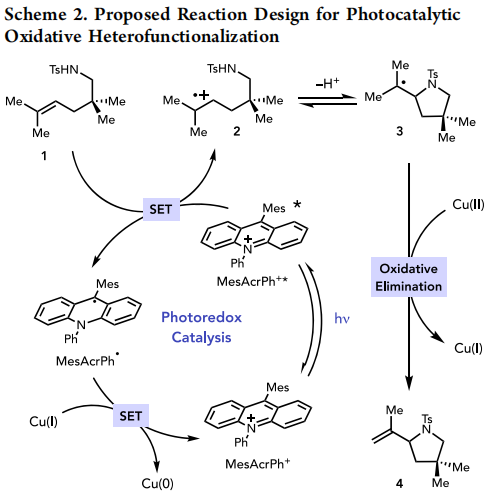
因此,作者提出了一种新的铜使能光氧化还原异官能化机理(方案2)。MesAcrPh+的光激发提供了一个高度氧化的激发态MesAcrPh+*(*E1/2red=+2.12V vs SCE)。烯烃1的快速还原猝灭将提供自由基阳离子2和MesAcrPh·。自由基阳离子2是一种很强的亲电试剂,它很容易被一个悬挂的杂原子亲核试剂捕获,生成以碳为中心的自由基3。在合适的Cu(II)氧化剂作用下,3发生自由基氧化加成反应,得到有机铜(III)中间体。成功实现这一策略的关键是优化消除步骤,使之有利于反热力学消除到4。氧化消除的交替区域化学将提供不能在这种转化的高氧化条件下存活的富含电子的烯胺。最后,反应过程中生成的Cu(I)对MesAcrPh·的氧化结束了光氧化还原催化循环,再生了基态MesAcrPh+。
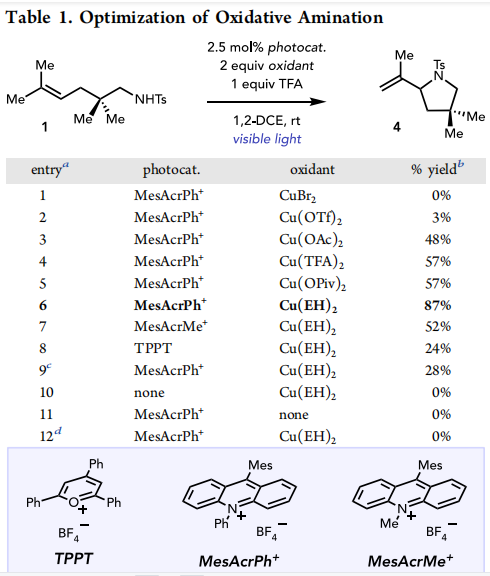
作者首先研究了在2.5mol%N-苯基吖啶四氟硼酸盐(MesAcrPh+)、1当量的三氟乙酸和各种Cu(II)末端氧化剂存在下,三取代烯烃1在辐照下的氧化环化反应(表1,条目1−6)。在大多数情况下可以观察到环化产物4的形成,但正如预期的那样,Cu(II)氧化剂的特性被证明是至关重要的。作者假设,在Cu(II)介导的氧化消除过程中,空间大的羧酸盐配体提高了烯烃生成的区域选择性。其他高氧化光催化剂以中等的产率提供了4(条目7和8),但MesAcrPh+被证明是这种转化的最佳选择。经验上,作者还观察到,添加1当量的TFA提高了氧化环化的速率和重复性(条目9)。因此,优化的条件为2.5mol%MesAcrPh+,2当量铜(II)2-己酸乙酯(Cu(EH)2),1当量1,2-二氯乙酸,两盏15W蓝色发光二极管泛光灯照射(条目6)。对照反应证实了这一过程的光催化性质:省略光催化剂、Cu(II)氧化剂或光导致不生成吡咯烷4(条目10−12)。
这种转变所表现出的一般性程度是值得注意的(表2)。种类繁多的芳基磺酰胺类化合物可进行高效的氧化环化反应。富含电子和缺电子的芳基磺酰胺类化合物反应平稳(4−8),包括空间受阻的邻位取代磺酰胺类化合物(8)。不幸的是,2-诺磺酰胺是不能容忍的(9),可能是由于硝基芳烃的氧化还原活性。烷基磺酰胺是很好的反应伙伴(10和11),其中包括空间受阻的叔丁基磺酰胺,产率为67%,产率为12。磺酰脲(13)、醇(14)和羧酸(15)的环化产物产率较高,有效地获取各种杂环支架。重要的是,在这些情况下,不需要改变催化剂系统或反应条件,尽管所检测的是不同的亲核试剂。
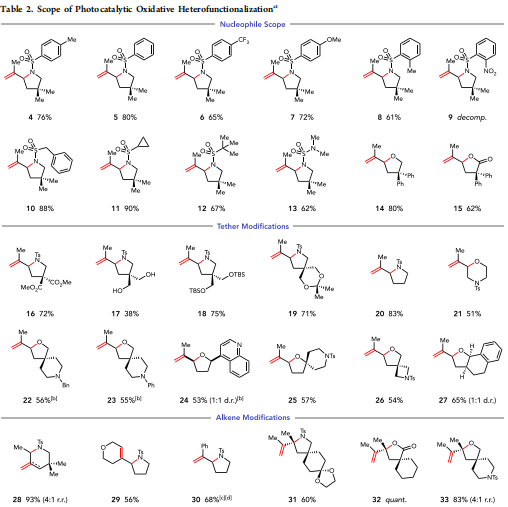
容易适应对系链基的长度和特性的修改,并且该方法的官能团公差很好。可以容忍包括酯(16)、醇(17)、硅醚(18)和缩醛(19)在内的常见有机官能团。这些反应表现出极好的化学选择性,因为在亲核游离醇(17)的存在下,仅观察到磺酰胺的环化反应。虽然提供五元环的环化反应是最有效的(20),但是六元环也很容易获得(21)。考虑到这些条件的氧化性质,作者很高兴地发现叔胺(22)和苯胺(23)的耐受性很好。可能与Cu(II)配位的Lewis碱性杂环也不会干扰所需的转化(24);然而,含有Lewis碱性官能团的底物用2当量的p-TsOH酸代替TFA反应最有效,这可能是因为碱性氮在这些条件下被质子化。这些功能也特别值得注意,因为它们是过渡金属催化剂的常见毒物,进一步证明了这种光催化体系与Pd(II)催化体系的独特互补性。空间受阻的叔亲核试剂经过环化,以57%的产率提供了稠密官能化的螺环四氢呋喃(25)。合成了Azetidine 26,产率为54%,展示了该方法在合成药物结构方面的潜在用途。还可以合成双环杂环化合物(27),展示了该方法在构建高阶分子结构中的应用。
在这个反应中,三取代烯烃是很好的底物,在所有情况下,作者都观察到在最初的成键事件中唯一的反马尔可夫尼科夫选择性。因此,环化可以以内切方式进行,与亲核捕获时生成更稳定的自由基中间体一致(28)。在本实验中,氧化消除给出了外环末端烯烃(4:1)的适度优先选择,这与Glorius观察到的脱羧烯烃的区域选择性一致。此外,氧化消除提供内环烯烃可以无问题地进行(29)。苯乙烯烯烃提供1,1-二取代苯乙烯(30)作为唯一产物。重要的是,与许多Pd(II)催化的氧化胺化方法相比,没有观察到烯烃异构化。缩短反应时间是获得高产率环化产物的关键,因为30在反应条件下经历缓慢的氧化分解。令作者高兴的是,四取代烯烃通常是Pd(II)催化的异官能团化方法中最具挑战性的底物之一,反应平稳,并且与没有离散催化剂−亲核相互作用的情况一致,杂原子亲核试剂的同一性对环化效率几乎没有影响。磺酰胺类化合物(31)、羧酸类化合物(32)和醇类化合物(33)都提供了所需杂环的好到极好的产率。
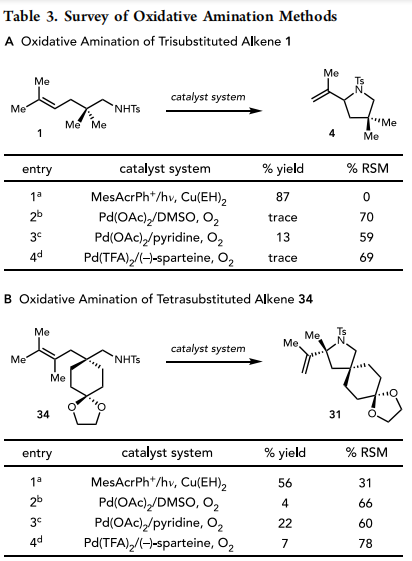
重要的是,这种新的氧化异官能化反应的范围提供了一种合成能力,这是最先进的Pd(II)催化方法所不具备的。为了证明这种互补性,作者将三取代烯烃1和四取代烯烃34置于几个已知的高活性Pd(II)基氧化胺化催化剂体系中(表3a和3b)。这些体系的氧化环化产率均不令人满意,起始烯烃显著分解。用Stahl(Pd(OAc)2/Pyridine)报道的催化剂体系的产率最高,但只有在高温下延长反应时间才能获得最高的产率(4和31的产率分别为13%和22%)。相反,作者的光催化方案可以快速有效地将1和34氧化环化成相应的杂环。
总而言之,作者已经表明,由高氧化性光催化剂和Cu(II)末端氧化剂组成的光催化体系能够使高取代烯烃与不同范围的亲核伙伴进行氧化异官能化。该反应解决了最先进的氧化烯烃杂官能化的几个长期合成限制。涉及烯烃自由基阳离子中间体生成的光活化机理避免了离散的金属−烯烃或金属−亲核相互作用,因此这种光催化方法的范围是对现有Pd(II)催化反应的补充。更广泛地说,这一反应增加了越来越多的证据,表明Cu(II)盐是光氧化还原反应的理想终端氧化剂。虽然作者以前已经证明,类似的系统能够实现光化学生成的有机中间体的氧化取代反应,但在这里,作者证明了它们的反应性可以转移到氧化消除反应上。综上所述,这些结果表明了一种强大的、潜在的通用策略,用于开发一系列利用光氧化还原激活的多功能性的新型氧化官能化反应。





