【有机】烯烃的氢胺化反应直接合成二级脂肪胺
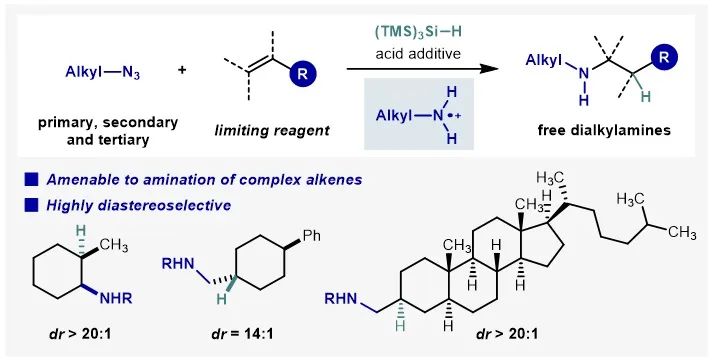
有机胺类化合物在药物化学和生命科学的发展中占有重要地位。例如,目前销售额前200的有机小分子药物中,近90%至少含有一个氮原子。因此,碳-氮键的高效构筑一直是有机合成化学的核心研究领域之一。烯烃的氢胺化反应是有机胺合成的重要方法,也是烯烃增值化转化的有效途径。虽然化学家们已经发展了多种催化体系以实现烯烃的高效氢胺化反应,但是能够直接用于合成未保护脂肪胺的方法却十分有限。近日,南开大学化学学院王飞课题组发展了一种氮自由基介导的非活化烯烃的反马氏(anti-Markovnikov)氢胺化反应直接合成二级脂肪胺(图1)。该方法首次以烷基叠氮作为氮自由基阳离子来源,能够以烯烃作为限制试剂,并且具有非常好的非对映选择性。
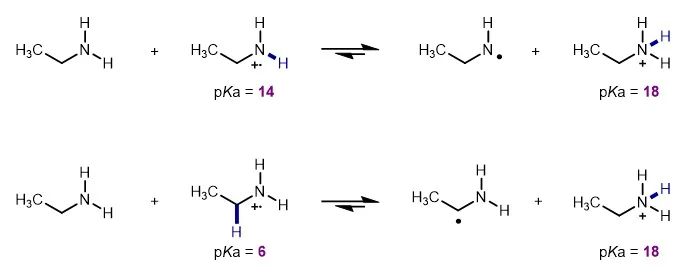
脂肪胺广泛存在于生物活性分子中,发展其高效合成的新方法将具有非常重要的意义。氮自由基介导的烯烃氢胺化反应具有反应活性高和反马氏加成(anti-Markovnikov)选择性的特点,在有机胺合成领域受到越来越多的关注。一般而言,氮自由基的亲电性越强,其对富电性和电中性烯烃加成的活性越高,因此常见的氮自由基类型主要包括缺电性基团保护的氮自由基以及氮自由基阳离子。其中,氮自由基阳离子中间体介导的烯烃氢胺化反应能够直接合成脂肪胺,避免了许多保护基操作,有利于提高合成效率。然而已知的该类反应却存在很大局限性。例如,Knowles 和Nocera课题组报道了光催化非活化烯烃的反马氏氢胺化反应直接合成二级脂肪胺,但是需要过量的烯烃底物,同时α-烯烃的反应效率较低,并且使用贵金属铱光敏剂(J. Am. Chem. Soc. 2019, 141, 16590−16594; J. Am. Chem. Soc. 2021, 143, 10232−10242)。机理研究表明,一级脂肪胺的单电子氧化产生氮自由基阳离子。由于反应条件呈碱性,这些活性中间体非常容易失去质子,转化成低活性的氮自由基或者碳自由基(图2),因此需要过量的烯烃来快速捕获氮自由基阳离子,从而促进反应发生。同时,电中性或者弱富电性烯烃与氮自由基阳离子的反应速率较低,从而导致α-烯烃的反应性差。作者认为解决问题的关键是能够在酸性条件下产生氮自由基阳离子,提高活性中间体的寿命和化学选择性。此外,由于缺乏有效的控制手段,氮自由基介导的烯烃氢胺化反应的非对映选择性通常较差,这也是该领域亟待解决的问题。
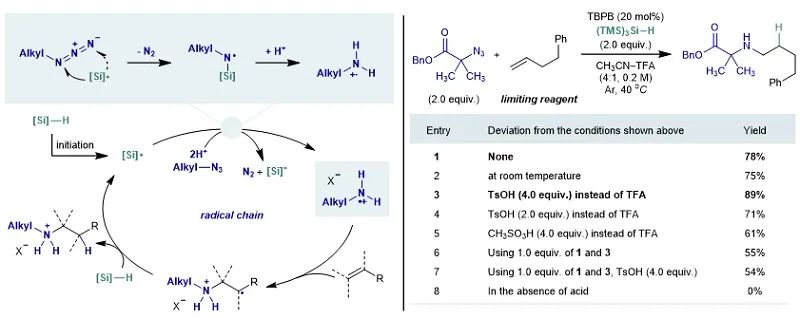
受硅烷参与叠氮还原反应的启发,作者设计了如下链式自由基反应过程(图3,左):1)自由基引发过程产生硅自由基;2)硅自由基与叠氮反应,脱除氮气之后产生氮自由基;3)氮自由基质子化产生相应的自由基阳离子;4)自由基阳离子对烯烃加成生成碳自由基;5)碳自由基与硅烷发生氢原子转移(HAT)生成产物和硅自由基。经过一系列条件筛选,作者发现以过氧苯甲酸叔丁酯为引发剂,乙腈和三氟乙酸为共溶剂,三(三甲基硅基)硅烷为还原剂,在40摄氏度下反应能够给出78%的二级脂肪胺产物(图3,右)。进一步研究表明,反应在室温下也能顺利进行。此外,采用4当量的对甲基苯磺酸能够将收率提高到89%。对照实验表明,不添加酸的情况下,反应不发生。
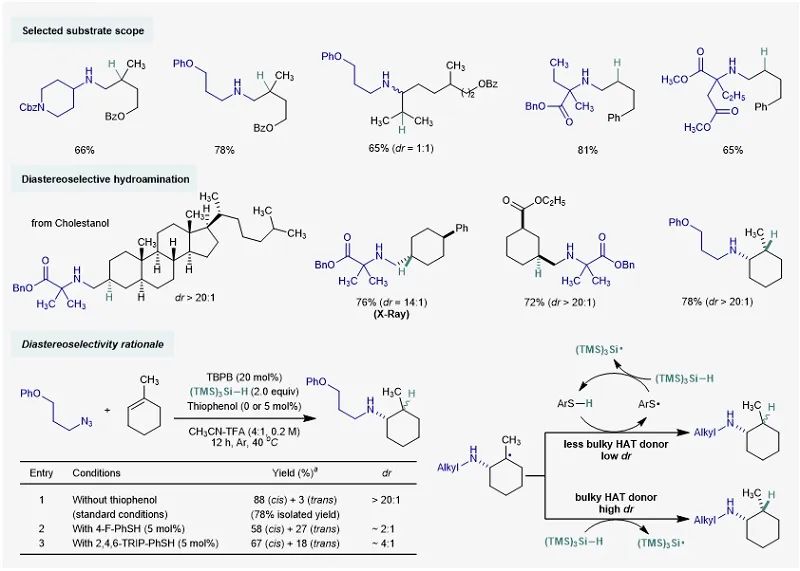
随后作者对反应的底物普适性进行了考察(图4)。该反应不仅适用于1°、2°和3°烷基叠氮,对于各种类型的烯烃同样具有较好的普适性。文献中反应活性较低的α-烯烃也能够给出良好到优秀的收率。反应能够以烯烃作为限制试剂,适用于复杂烯烃的后期氢胺化。氘代实验和对照实验表明,大位阻的硅烷是直接的氢原子供体;其在与碳自由基发生氢原子转移的过程中能够有效地识别邻位的立体效应,使反应具有非常好的非对映选择性。
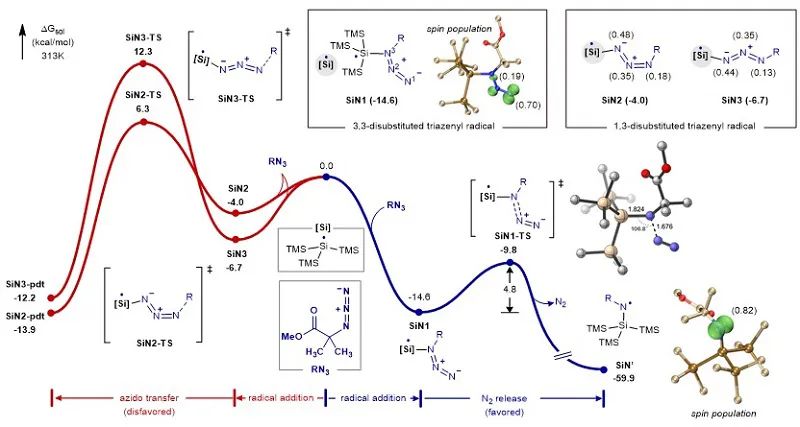
虽然硅自由基与烷基叠氮的反应在很多文献中有所提及,但是具体的反应途径仍不清楚。例如,Roberts等利用电子自旋共振技术(EPR)研究了硅自由基与烷基叠氮反应,结果表明硅自由基既可以加成到末端氮原子,也可以加成到烷基取代的氮原子(J. Chem. Soc., Perkin Trans. 1979, 2, 1353−1361)。为了对反应过程有更清楚的认识,作者进行了理论计算(图5)。结果表明,硅自由基对叠氮加成将产生三种自由基中间体:SiN1(1,1-取代)、SiN2(1,3-取代)、SiN3(1,3-取代)。其中,SiN1的能量最低,且单电子主要离域在末端氮原子中心。随后,SiN1发生不可逆氮气脱除反应产生氮自由基中间体,该步反应的能垒是4.8 kcal/mol。进一步计算结果表明,SiN2和SiN3不能直接脱除氮气,而倾向于进行C-N键的均裂,发生形式上的叠氮基团转移反应,并且反应的动力学能垒较高(图5)。
王飞课题组以烷基叠氮作为氮自由基阳离子来源,实现了非活化烯烃的反马氏(anti-Markovnikov)氢胺化反应直接合成二级脂肪胺。该方法具有优秀的底物普适性和官能团兼容性;以烯烃作为限制试剂,既适用于简单烯烃的增值化转化,又可用于复杂烯烃的后期氢胺化反应。作者采用大位阻的硅烷作为氢原子供体,解决了氮自由基介导的烯烃氢胺化反应中非对映选择性差的难题。本文中所提供的产生氮自由基阳离子的新方法有望用于其它胺化反应。这一成果近期发表于Journal of the American Chemical Society,理论计算部分由南开大学化学学院王浩博士完成,论文第一作者为南开大学21级博士研究生贾思铭。该工作得到了国家自然科学基金、南开大学、元素有机化学国家重点实验室和有机新物质创造前沿科学中心的资助。
王飞,南开大学化学学院特聘研究员,博士生导师,南开大学“百名青年学科带头人”,入选国家高层次人才计划。2011年毕业于青岛科技大学应用化学专业,获学士学位;2016年毕业于中国科学院上海有机化学研究所,获博士学位,导师为刘国生研究员;2017-2020年在美国威斯康星大学麦迪逊分校Shannon S. Stahl教授课题组进行博士后研究。于2021年加入南开大学化学学院,元素有机化学国家重点实验室开展独立工作,主要从事自由基化学和不对称催化等研究。曾获得“上海市自然科学一等奖”(第二完成人,2019年)、Reaxys PhD prize(Finalist,2017年)等奖励。迄今在Science, Nat. Syn., Acc. Res. Chem., J. Am. Chem. Soc., Angew. Chem. Int. Ed.上发表论文14篇。





