新型酰胺自由基前体:中国科学院陈以昀课题组
磺胺类广泛存在于许多生物活性分子中,包括药物分子,如瑞舒伐他汀、磺胺嘧啶和磺胺甲恶唑。近年来,发展使用预官能化的酰胺基自由基前体在温和的氧化还原条件下产生酰胺基自由基的方法越来越多,这些方法提高了官能团的兼容性,也包括与生物分子兼容的应用。在这些报道的预官能化前体中,N-氯酰胺、肟酯、O-芳氧基酰胺和吡啶鎓盐都是通过单电子还原的方式实现C(sp2)-H 酰胺化。然而,通过单电子氧化途径的酰胺化前体来实现芳烃的 C(sp2)-H 酰胺化仍较少报道。
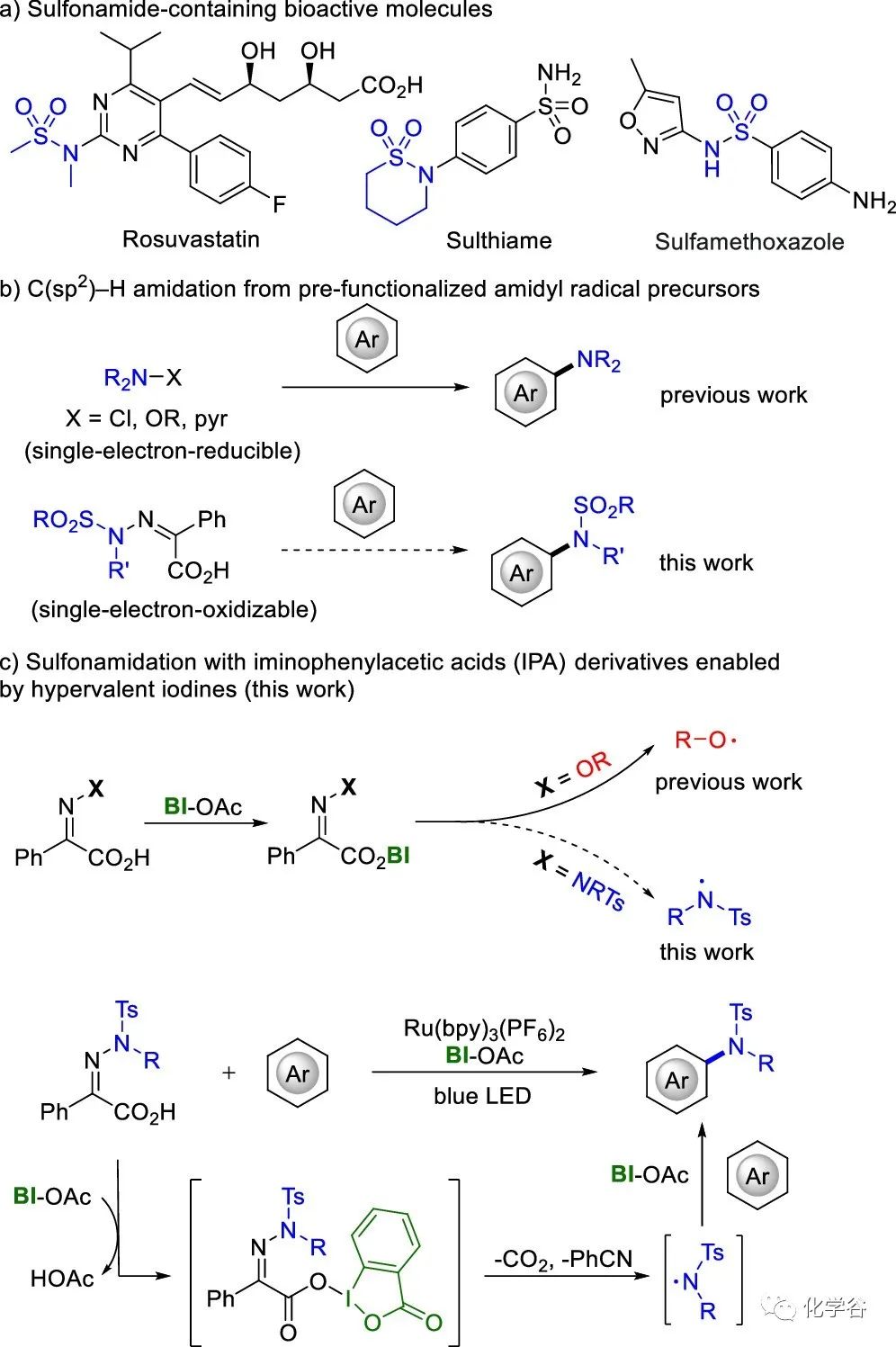
近日,上海有机所陈以昀课题组报道利用稳定的酰胺基-亚氨基苯乙酸作为酰胺自由基前体来合成磺胺基(杂)芳烃。高价碘试剂活化亚氨基苯乙酸,在温和的光催化氧化条件下容易产生磺胺自由基,底物范围广泛,杂环类底物吲哚、吡咯、咪唑并吡啶和稠合芳烃都能实现 C(sp2)-H 酰胺化,具有优异的化学选择性和区域选择性。
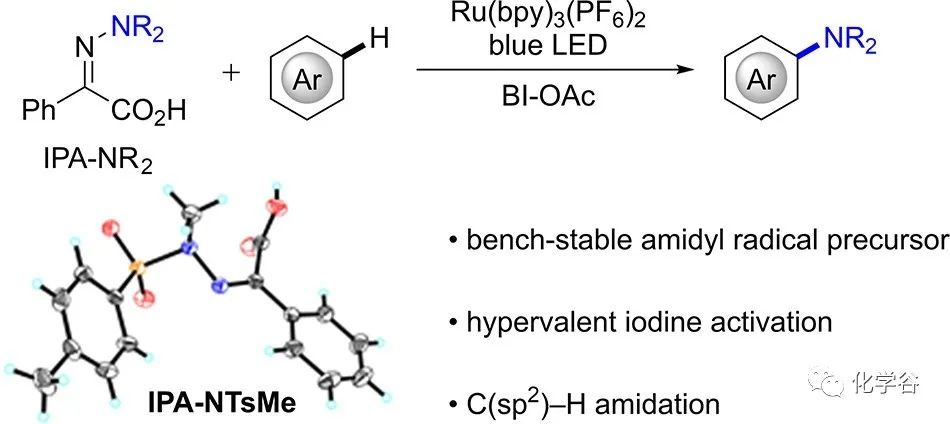
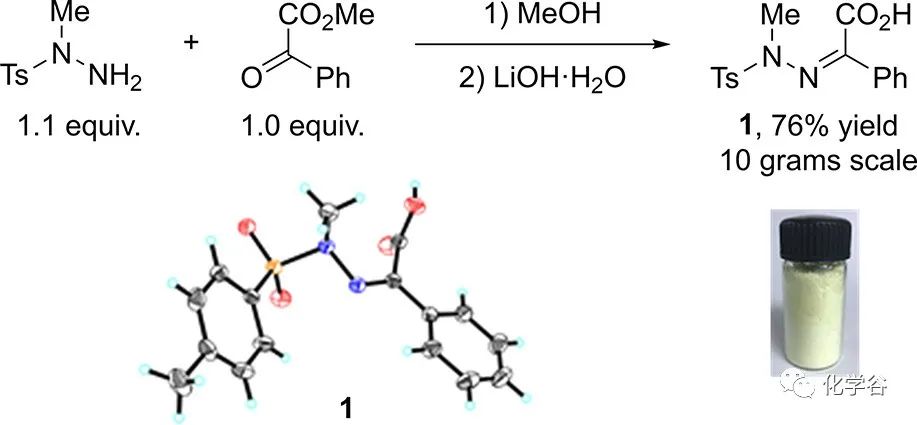
前体的制备:前体酰胺基-亚氨基苯乙酸 IPA-NTsMe 1可以在10 克规模下以 76% 的产率制备,其纯化是简单的过滤和从苯甲酰甲酸甲酯和甲苯磺酰肼的反应混合物中重结晶。IPA-NTsMe 1可以长时间存放而不会分解。
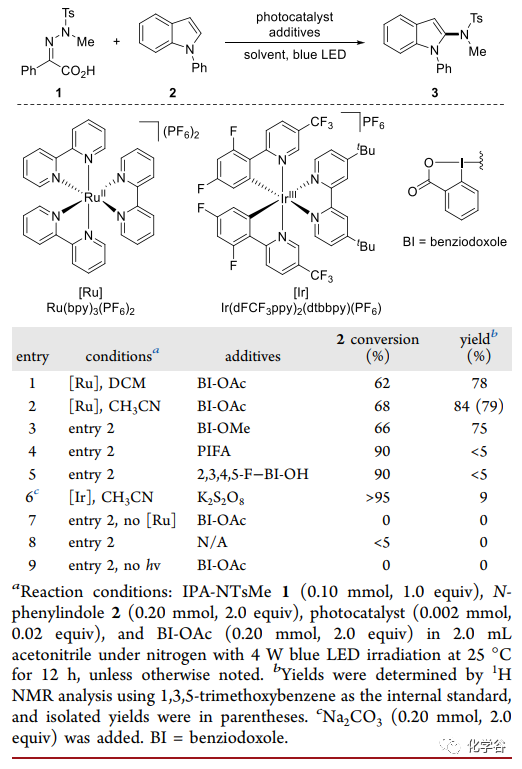
实验条件:作者N-苯基吲哚2作为自由基受体,Ru(bpy)3(PF6)2作为光催化剂(E III/II = +1.29 V vs SCE in MeCN),IPA-NTsMe 1以 78% 的收率得到所需的酰胺化产物3 ,其中乙酰氧基苯并氧唑 BI-OAc 作为添加剂,使用乙腈作为溶剂得到最佳的84% 产率3。将光催化剂改为具有更高氧化电位的 Ir(dFCF3ppy)2(dtbbpy)PF6 (E IV/III = +1.69 V) 并没有使反应更好,仅得到 9% 的3产率。对照试验显示光催化剂、BI-OAc 和光照射对于反应都是至关重要的条件。
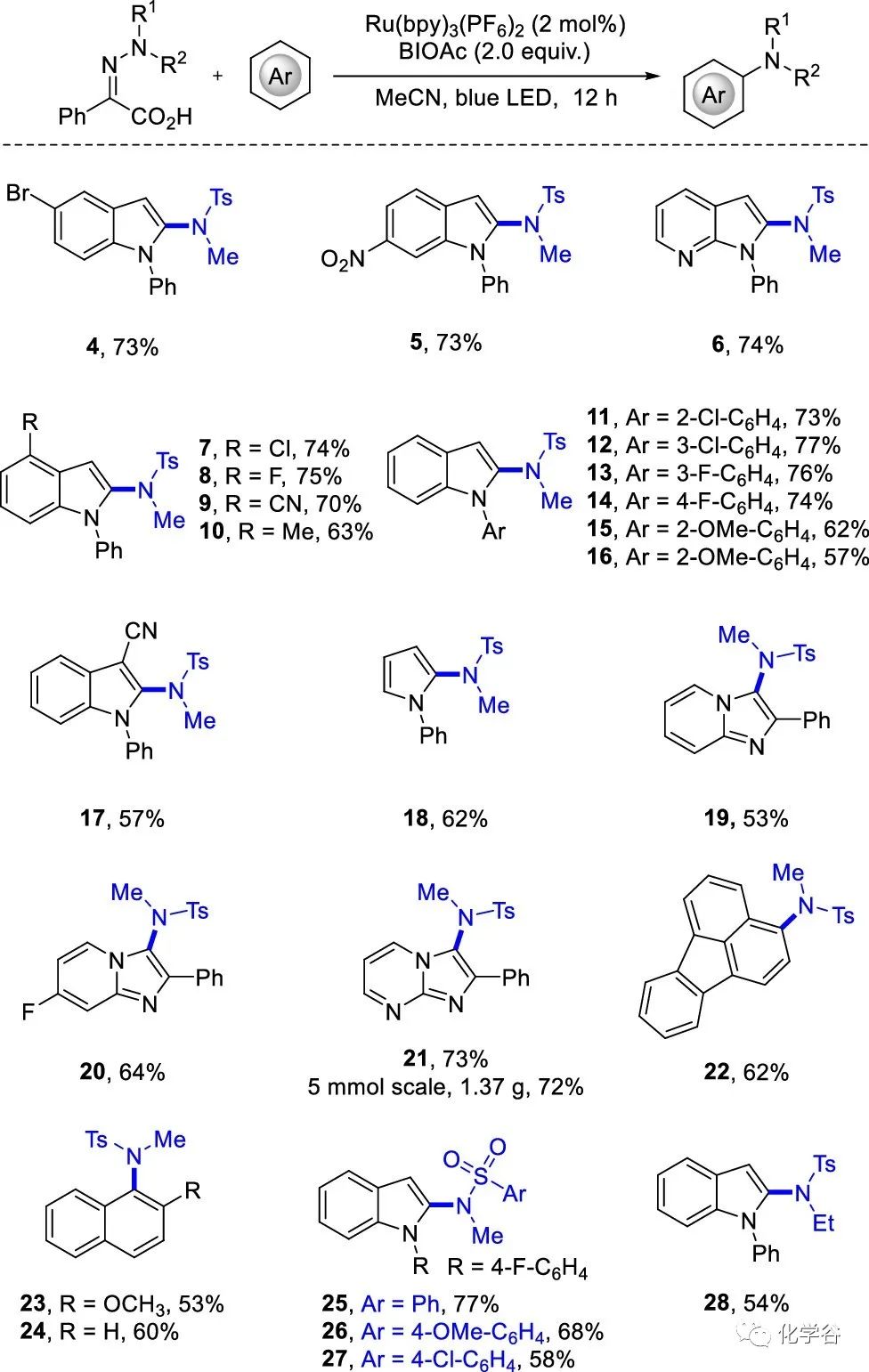
作者接下来探索杂环酰胺化的底物范围:吲哚上的富电子或缺电子基团不影响反应得到 2-磺胺取代的吲哚4-10,收率 63%-75 %,甚至硝基在反应条件下也可以耐受。缺电子的 N-芳基取代基有利于反应并得到产物11-14,产率为73 %-77%,带有N-甲氧基芳基取代基的底物得到15和16,产率为 57%-62%。3-腈取代的吲哚以 57% 的收率得到17,N-苯基吡咯在 2 位区域选择性反应生成 2-磺酰胺-吡咯18,收率为 62%。具有 2-苯基取代的咪唑并吡啶得到 3-磺酰胺-咪唑并吡啶19-21产率为 53%–73%。该反应还区域选择性地作用于富电子位置的蒽和萘,得到22-24,产率为 53%-62%。然而,由于磺胺基自由基的亲电特性,该反应不适用于简单的苯、吡啶或异喹啉。IPA 上的磺酰胺取代基具有不同的电子特性,均能以58% –77 %的收率得到25–27。
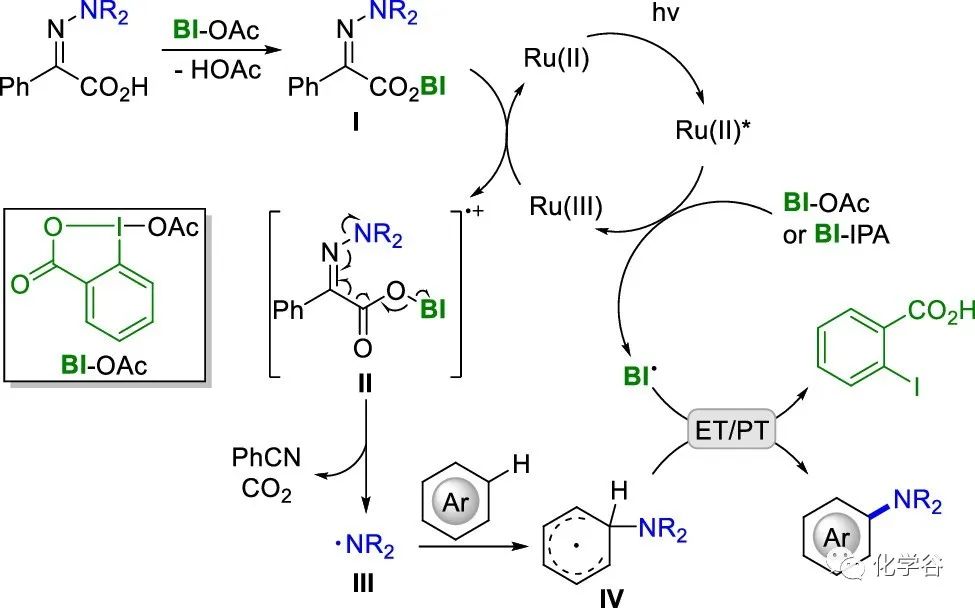
从上面的机理研究来看,光氧化还原催化是通过 BI-OAc 或 BI-IPA-NTsMe I对激发态 Ru(II)* 的氧化猝灭引发的,得到 Ru(III)。亚氨基苯乙酸与 BI-OAc 的配位形成 BI-IPA-NTsMe 复合物I,其具有显着降低的氧化电势,易于氧化。BI-IPA-NTsMe配合物I的Ru(III)氧化得到亚氨基苯基羧基阳离子II,在二氧化碳和苯腈协同消除后产生磺胺基III。然后磺酰胺基自由基与芳烃进行自由基加成,加成中间体IV被BI自由基进一步氧化得到(杂)芳烃C(sp2)-H磺酰胺加合物。