丹麦科技大学Søren Kramer课题组Angew:光/铜双重催化直接实现苄基C(sp3)–H膦酰化反应
近日,丹麦科技大学Søren Kramer课题组报道了一种光/铜双重催化非专一性烷基芳烃(non-specialized)和非官能团化亚磷酸酯(phosphites)之间的交叉脱氢偶联反应,实现了苄基C(sp3)–H键的直接官能团化,获得了一系列苄基膦酸酯衍生物。值得注意的是,C-H底物作为限制试剂(limiting reagents)。同时,该策略具有反应条件温和、底物范围广泛、官能团兼容性出色等特点。机理研究表明,反应涉及自由基的途径,而非专一性苄基C-H底物所遵循的阳离子途径。相关研究成果发表在Angew. Chem. Int. Ed.上。
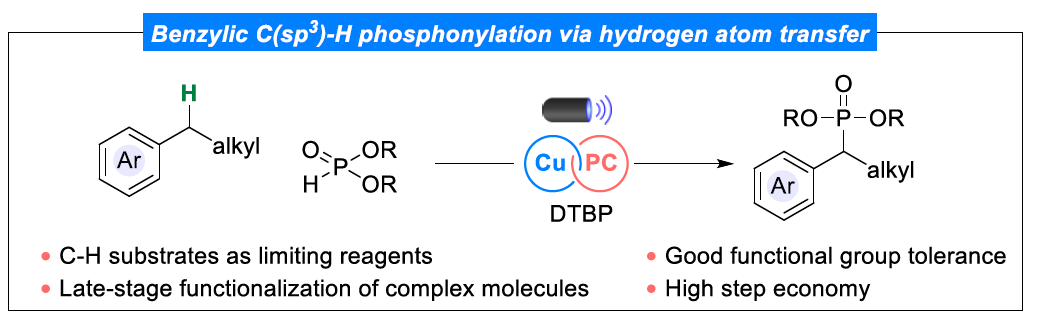
(来源:Angew. Chem. Int. Ed.)
有机膦单元广泛存在于各类药物、农用化学品和材料等中。特别是,P(V)化合物,如磷酸盐、膦酸和膦酸酯,常存在于一些生物活性分子中。最近,通过将羧酸、三氟硼酸烷基酯盐、烷基卤化物和脂肪醇等官能团转化为C(sp3)–P膦酸酯的新方法,在合成烷基膦酸酯的方面取得了巨大的进展。近年来,苄基C(sp3)–H键的直接官能团化反应,备受关注。然而,对于苄基C(sp3)–H键的直接膦酰基化反应仅限于四氢异喹啉和氧杂蒽型(xanthene-type)底物(Scheme 1a)。这些底物均能够形成高度稳定的阳离子中间体(苄基亚胺离子(benzyliminiums)或二苄基阳离子),其可以被亲核磷试剂捕获。2024年,李超忠课题组(Angew. Chem. Int. Ed. 2024, 63, e202400856.)首次报道了一种非活化的C(sp3)–H键的膦酰化反应,涉及酰胺的分子内1,5-氢原子转移(HAT)的反应机理(Scheme 1b)。到目前为止,尚未有相关烷基芳烃参与苄基C(sp3)–H键的直接膦酰基化的例子。近日,丹麦科技大学Søren Kramer课题组报道了一种光/铜双重催化烷基芳烃和非官能团化亚磷酸酯的交叉脱氢偶联反应,实现了苄基C(sp3)–H键的直接官能团化,获得了一系列苄基膦酸酯衍生物(Scheme 1c)。
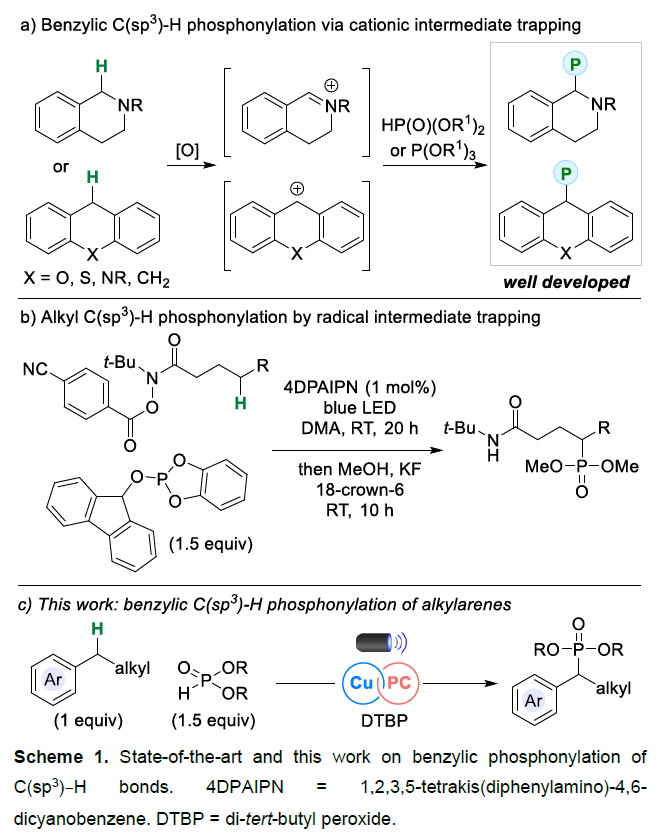
(图片来源:Angew. Chem. Int. Ed.)
首先,作者乙苯(1a)与亚磷酸二甲酯(2a)作为模型底物,对反应条件进行了大量的筛选(Table 1)。筛选结果表明,当以Cu(MeCN)4BF4作为铜催化剂, L1作为配体,Ir[dF(CF3)ppy]2(dtbbpy)PF6(Ir-F)作为光催化剂,DTBP作为氧化剂,PhCN/TFE作为混合溶剂,427 nm LED作为光源,在–15℃下反应,可以83%的收率得到产物3a。
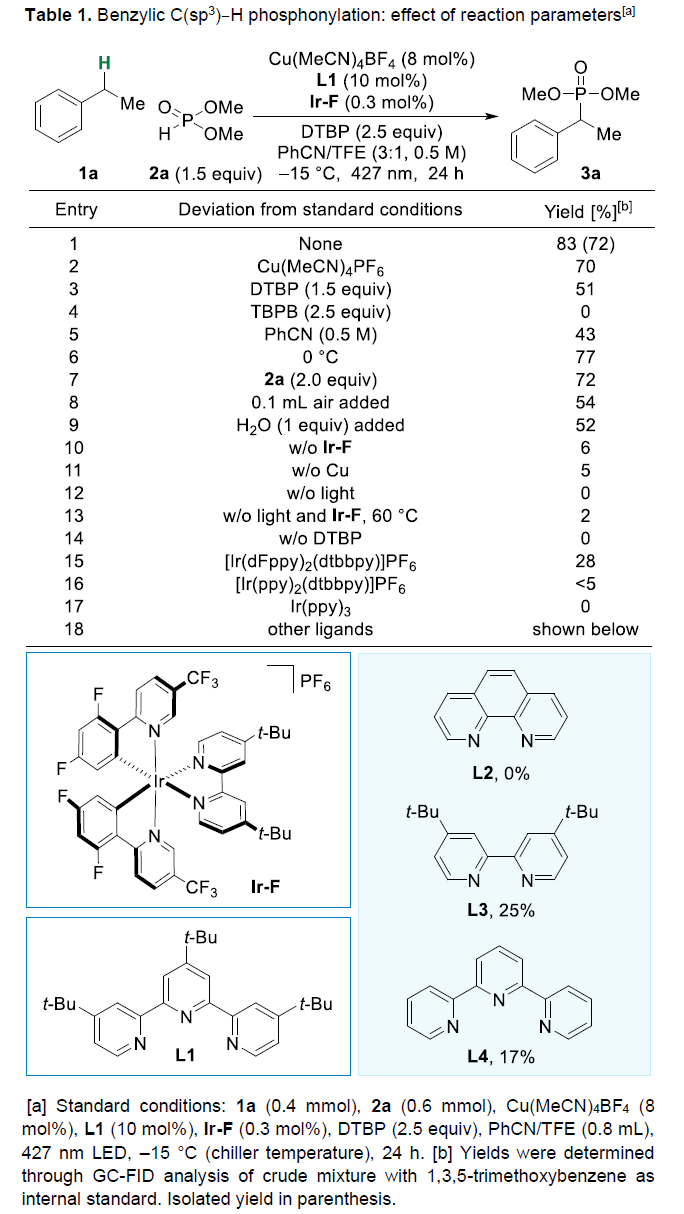
(图片来源:Angew. Chem. Int. Ed.)
在获得上述最佳反应条件后,作者对底物的范围进行了扩展(Figure 1)。首先,芳基上含有不同电性取代的乙苯,均可顺利进行反应,获得相应的产物3a-3s,收率为47-72%。值得注意的是,一系列活性的基团,如卤素、硼基、烷氧羰基、受保护的醇、羰基等,均与体系兼容。同时,对于存在两个竞争性的二级C(sp3)–H键的的底物,反应优先在酸性更强的位点进行膦酰化,如3r。对于存在竞争性的二级和一级C(sp3)–H键的的底物,反应优先在二级C(sp3)–H键位点进行膦酰化,如3s。其次,虽然一级C(sp3)–H键的反应性更慢,但可以通过增加这种廉价底物的当量,从而实现甲苯的膦酰化,如3t(收率为62%)。然而,对于具有三级苄基C(sp3)–H键的底物,如异丙苯,未能有效的进行反应。其次,具有杂芳基取代的底物,如吡啶、吡唑、嘧啶和咔唑,也能够顺利进行反应,获得相应的产物3u-3x,收率为43-53%。对于具有更长烷基链的烷基芳烃,反应也具有优异的位点选择性,获得相应的产物3y-3z和3aa-3ad,收率为46-63%。对于亚磷酸盐试剂,空间位阻对反应效率有显著影响,其中亚磷酸二乙酯可以52%的收率得到产物3ae,但亚磷酸二叔丁酯仅提供痕量的产物3af。此外,该策略还可用于一些药物分子的后期衍生化,如伊索克酸、非诺贝特酸、Nematal 105和三氯生,获得相应的产物3ag-3aj,收率为44-53%。
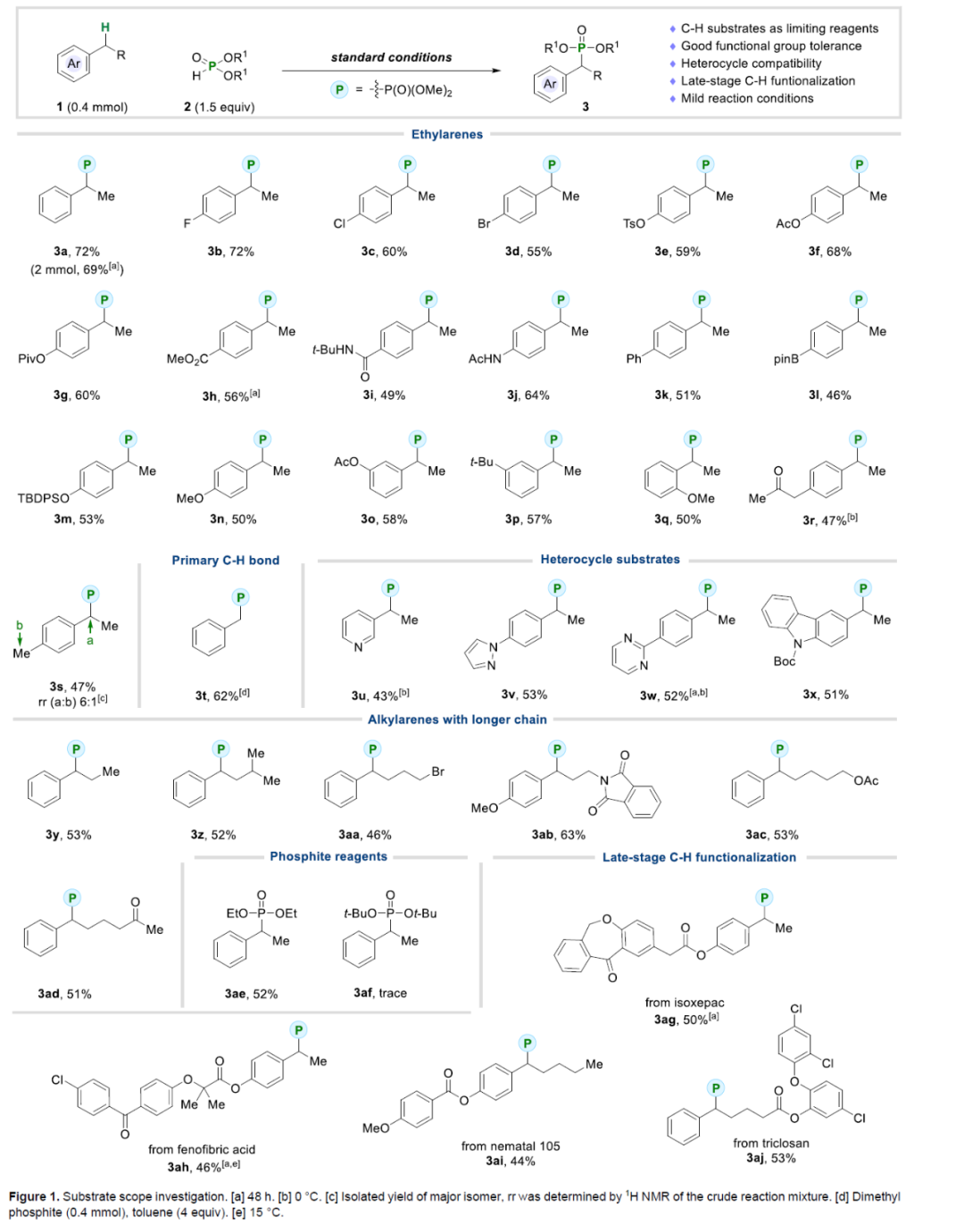
(图片来源:Angew. Chem. Int. Ed.)
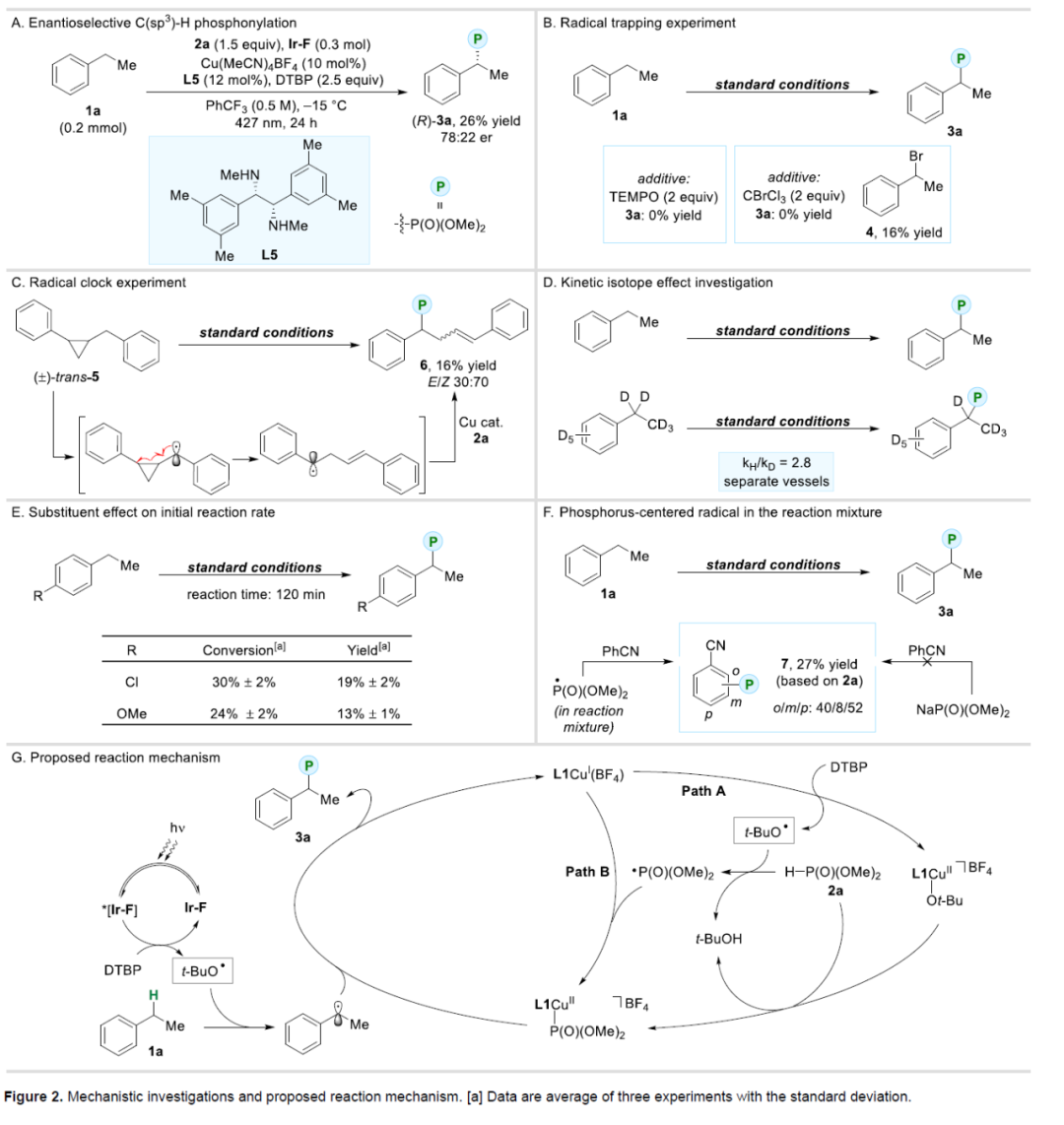
随后,作者对反应的机理进行了研究(Figure 2)。首先,采用L5作为手性配体,1a可进行对映选择性膦酰化反应,可以26%的收率得到手性膦酸酯产物(R)-3a,er为78:22。值得注意的是,该策略作为实现对映选择性直接C(sp3)–H膦酰化的第一个例子(Figure 2A)。其次,自由基捕获实验结果表明,反应涉及自由基的机理,并生成了苄基自由基(Figure 2B)。自由基钟实验结果,进一步证明了苄基自由基中间体的生成(Figure 2C)。KIE实验结果表明,苄基碳-氢键的断裂至少部分决定了速率(Figure 2D)。不同取代底物的初始反应速率研究结果表明,反应不涉及苄基阳离子中间体得形成(Figure 2E)。对照实验结果表明,通过膦酸根阴离子的亲核加成形成7的可能性不大。相反,反应条件下存在以磷为中心的自由基(Figure 2F)。
基于上述的研究以及相关文献的查阅,作者提出了一种合理的反应机理(Figure 2G)。首先,在Path A中,DTPB促进L1CuI(BF4)的氧化,生成L1CuII–Ot-Bu,其可与亚磷酸盐(2a)进行配体交换,生成L1CuII–P(O)(OMe)2。或者,在Path B中,叔丁氧基自由基和亚磷酸盐(2a)经HAT生成相应的膦中心自由基,其与L1CuI(BF4)结合后可直接生成L1CuII–P(O)(OMe)2。一旦形成L1CuII–P(O)(OMe)2,它可以被苄基自由基捕获,从而通过内球层或外球层途径生成新的C(sp3)–P键。苄基自由基和膦中心自由基都可能是由叔丁氧基自由基的HAT步骤生成。作者假设,光催化剂(Ir-F)在该反应中的作用是通过能量转移从DTBP产生额外的叔丁氧基自由基。同时,叔丁氧基自由基与乙苯1a反应,可生成苄基自由基,通过进一步的转化后,从而获得目标产物,并再生L1CuI(BF4)。此外,也不能完全排除碳和膦中心自由基之间的自由基-自由基偶联的可能性。对映选择性反应的结果表明,铜至少在一定程度上参与了C-P键的形成。
(图片来源:Angew. Chem. Int. Ed.)
总结
丹麦科技大学Søren Kramer课题组报道了一种光/铜双重催化苄基C(sp3)–H键的直接膦酰化反应。同时,该策略具有操作简单、反应条件温和、底物范围广泛、官能团兼容性出色等特点。机理研究表明,反应是通过自由基途径进行的。
论文信息
Benzylic C(sp3)–H Phosphonylation via Dual Photo and Copper Catalysis
Heng-Hui Li, Yuwen Liu, Søren Kramer
Angew. Chem. Int. Ed. 2024
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





