韩国科学技术院Sungwoo Hong课题组:光催化芳基环丙烷与吖嗪N-氧化物的1,3-氧杂芳基化反应
导读
近日,韩国科学技术院Sungwoo Hong课题组报道了一种光催化芳基环丙烷(作为双官能团化试剂)与吖嗪N-氧化物(azine N-oxides)的1,3-氧杂芳基化反应(1,3-oxyheteroarylation),合成了一系列β-吡啶基酮衍生物,具有底物范围广泛、反应条件温和、无需金属催化剂等特点。机理研究揭示了一种光诱导自由基途径,涉及芳基环丙烷和吖嗪N-氧化物的单电子氧化以及随后进行逐步开环的过程。相关研究成果发表在Chem. Sci.上。
成果
环丙烷因其具有高张力能和稳定性,几十年来一直是有机合成中的多功能组分。其中,环丙烷作为C3砌块已广泛应用于开环/1,3-双官能团化反应中,涉及传统的Lewis酸或过渡金属配位活化环丙烷的C-C键以及现在光诱导C-C键断裂的方法。近年来,化学家们开发了几种电性无差异(electronically unbiased)芳基环丙烷在可见光下通过单电子氧化进行开环反应的例子。在这种方法中,富电子的环丙基芳烃被激发的光催化剂氧化,形成芳基环丙烷自由基阳离子。这些反应性物种可以进行亲核加成反应,促进对弱的C-C键的攻击,并在环境友好的条件下实现开环和官能团化反应。然而,该策略仅限于富电子芳基环丙烷,并且官能团的耐受性有限。到目前为止,尚未有相关芳基环丙烷进行(杂)芳基化的例子(Figure 1a)。近日,韩国科学技术院Sungwoo Hong课题组报道了一种光催化芳基环丙烷(作为双官能团化试剂)与吖嗪N-氧化物的1,3-氧杂芳基化反应,合成了一系列β-杂芳基酮衍生物。其中,该反应利用芳基环丙烷和吖嗪N-氧化物进行光诱导单电子氧化的能力,产生各自的自由基阳离子(Figure 1b)。
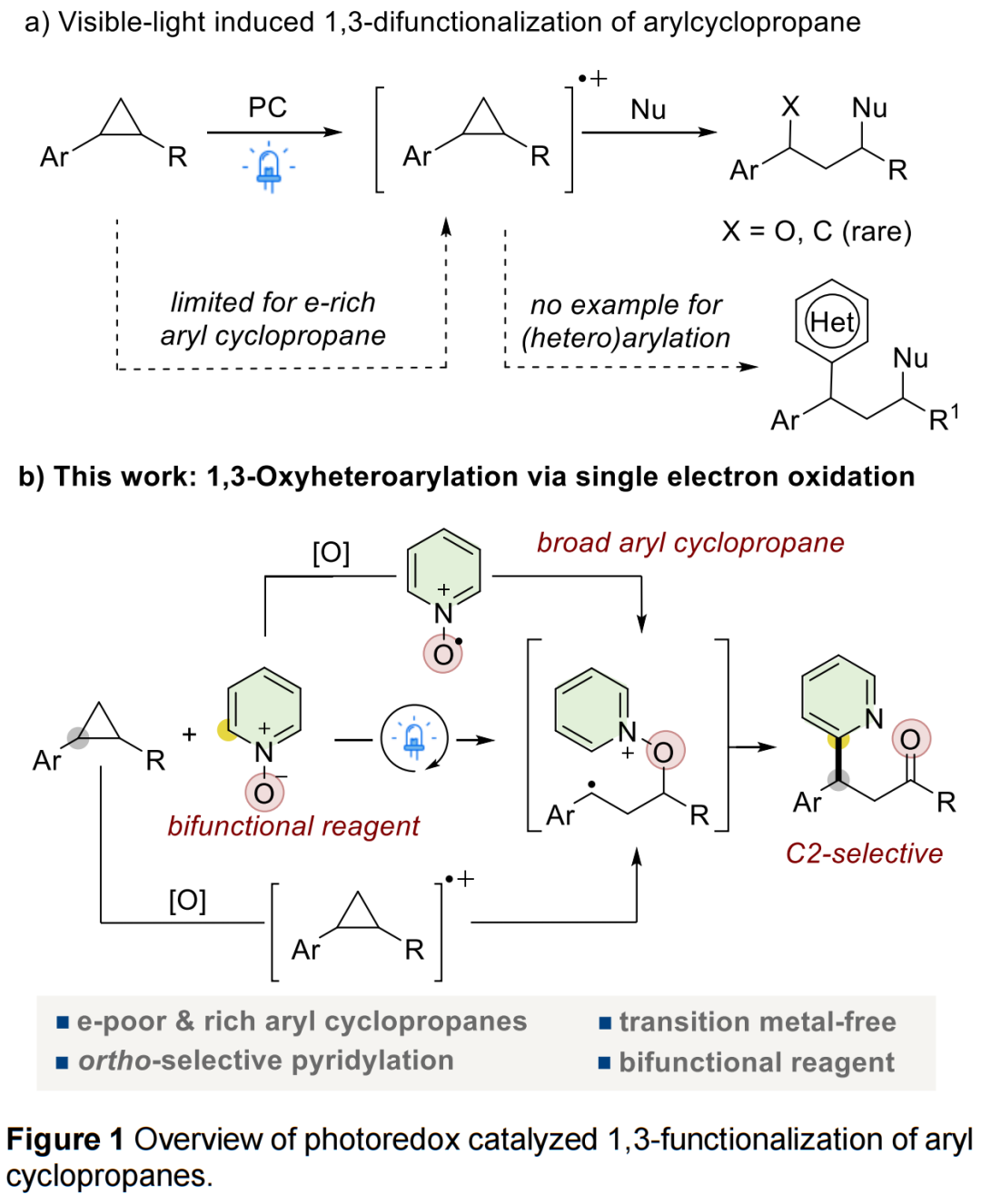
(Figure 1,来源:Chem. Sci.)
首先,作者吡啶N-氧化物(2a,作为亲核试剂)与芳基环丙烷(1a)作为模型底物,对反应条件进行了大量的筛选(Table 1)。筛选结果表明,当以9-均三甲苯基-10-甲基吖啶高氯酸盐(PC-1)作为光催化剂,1-氟-2,4,6-三甲基吡啶三氟甲烷磺酸盐(Py-F)作为氧化剂,440 nm LEDs (30 W)作为光源,MeCN作为溶剂,在室温下反应,可以79%的收率得到1,3-氧杂芳基化产物3a。
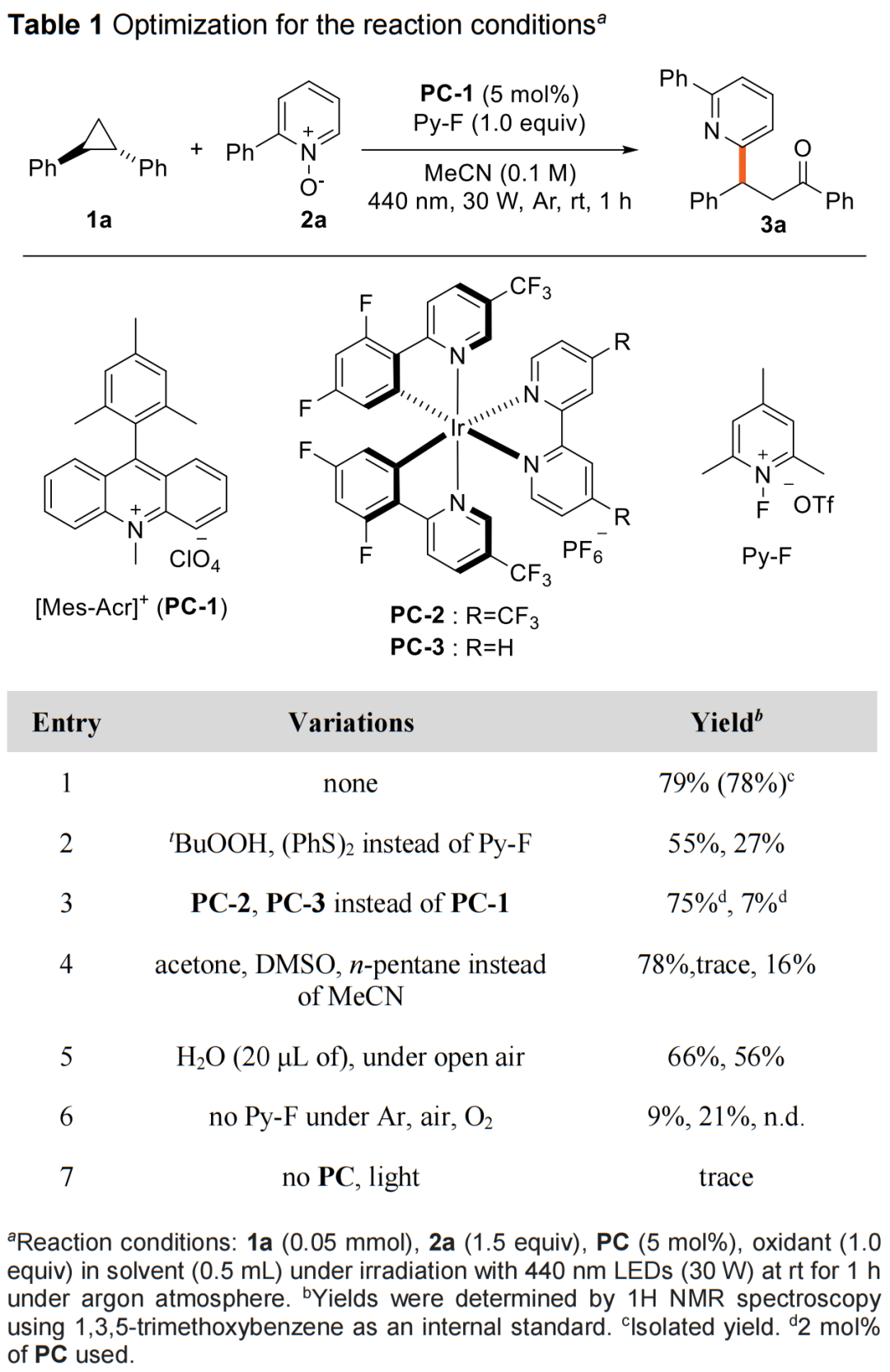
(Table 1,来源:Chem. Sci.)
在获得上述最佳反应条件后,作者对吖嗪N-氧化物的底物范围进行了扩展(Table 2)。首先,当吡啶N-氧化物的2-位含有-Ph、-H、-Br、-CF3、-OMe、-4-F-C6H4、-CH(CH3)2、吡啶基与噻吩基时,均可顺利进行反应,获得相应的产物3a-3j,收率为47-80%。当吡啶N-氧化物的4-位含有-Ph、-nPen、-Ac与-CN时,可获得相应的产物3k-3n,收率为58-75%。然而,由于空间效应,当吡啶N-氧化物的2-位含有-F或3-位含有-CONH2与-Ph时,反应的区域选择性有所降低,获得C2-位或C6-位选择性产物3o-3q,收率为43-66%,dr为7:1->20:1。其次,含有嘧啶、哒嗪、喹啉、喹喔啉以及菲啶的底物,也与体系兼容,获得相应的产物3r-3w,收率为33-73%。此外,该策略还可用于一些药物分子的后期衍生化,如Pyriproxyfen、维莫德吉、苯氧喹啉、罗氟司特等,获得相应的产物3x-3z和3aa-3ab,收率为40-95%。
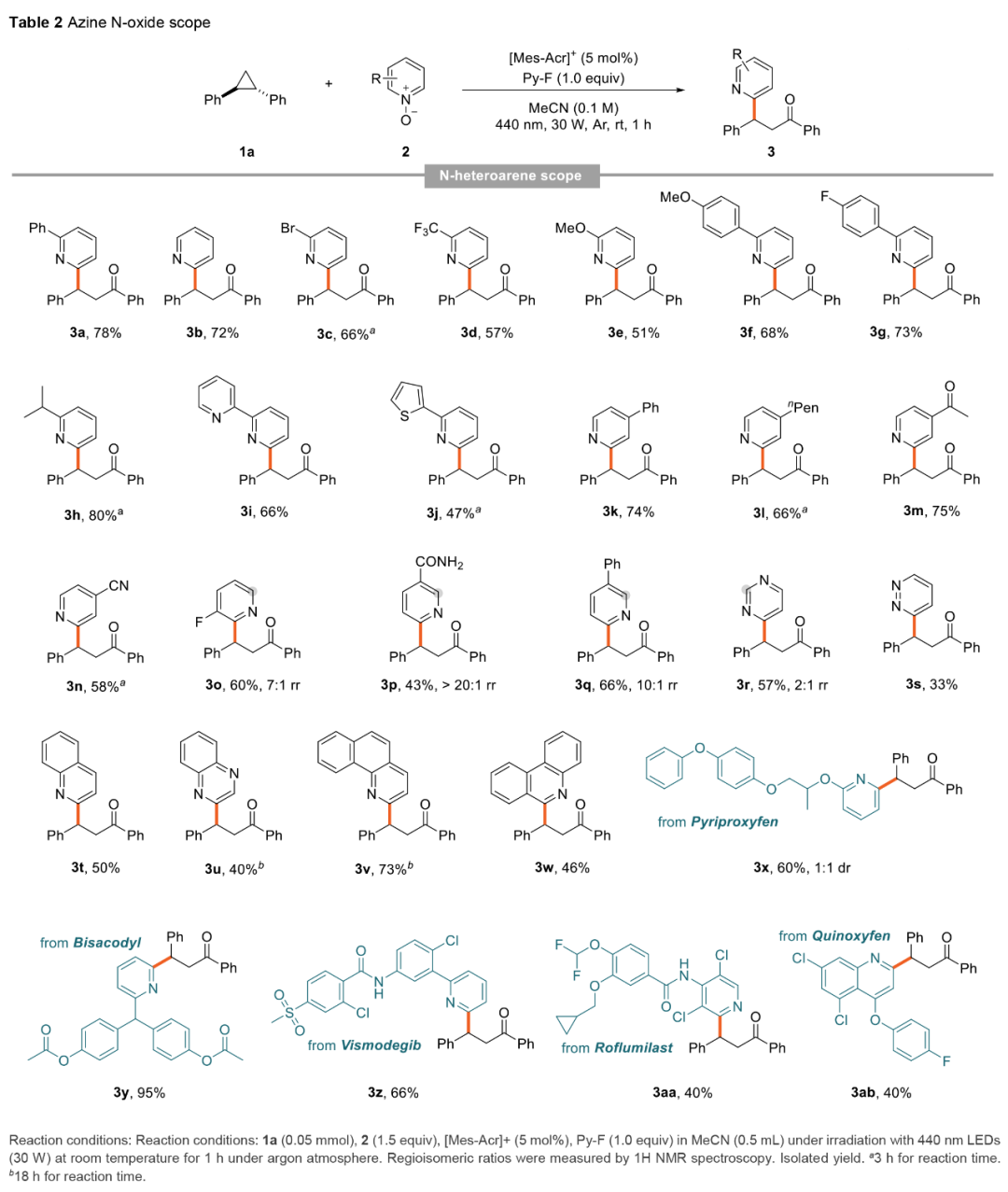
(Table 2,来源:Chem. Sci.)
紧接着,作者还对环丙烷的底物范围进行了扩展(Table 3)。首先,当对称二芳基环丙烷中的芳基上含有不同电性取代基时,均可顺利进行反应,获得相应的产物4a-4o,收率为40-84%。值得注意的是,该策略具有出色的官能团耐受性,一系列活性的基团(如卤素、烷氧羰基、硼基等)均与体系兼容。其次,对于不同取代的非对称二芳基环丙烷,也能够顺利进行反应,获得相应的产物4p-4s,收率为74-83%,rr为1.3:1-6.4:1。其中,当供电子基团和吸电子基团位于不同的芳环上时,反应的区域选择性有所提高(如4s),表明两个环之间的电子差异会影响反应的区域选择性。此外,一系列非对称得芳基烷基环丙烷,也与体系兼容,获得相应的产物4t-4x,收率为41-75%。值得注意的是,二甲基取代的环丙烷,可以52%的收率得到醇产物4y,而非上述的酮产物。同时,该策略还可用于一些药物分子的后期衍生化,如托吡卡胺、半乳哌喃糖与氟比洛芬衍生的环丙烷,获得相应的产物4z、4aa和4ab,收率为67-82% ,rr为1.4:1-5:1。
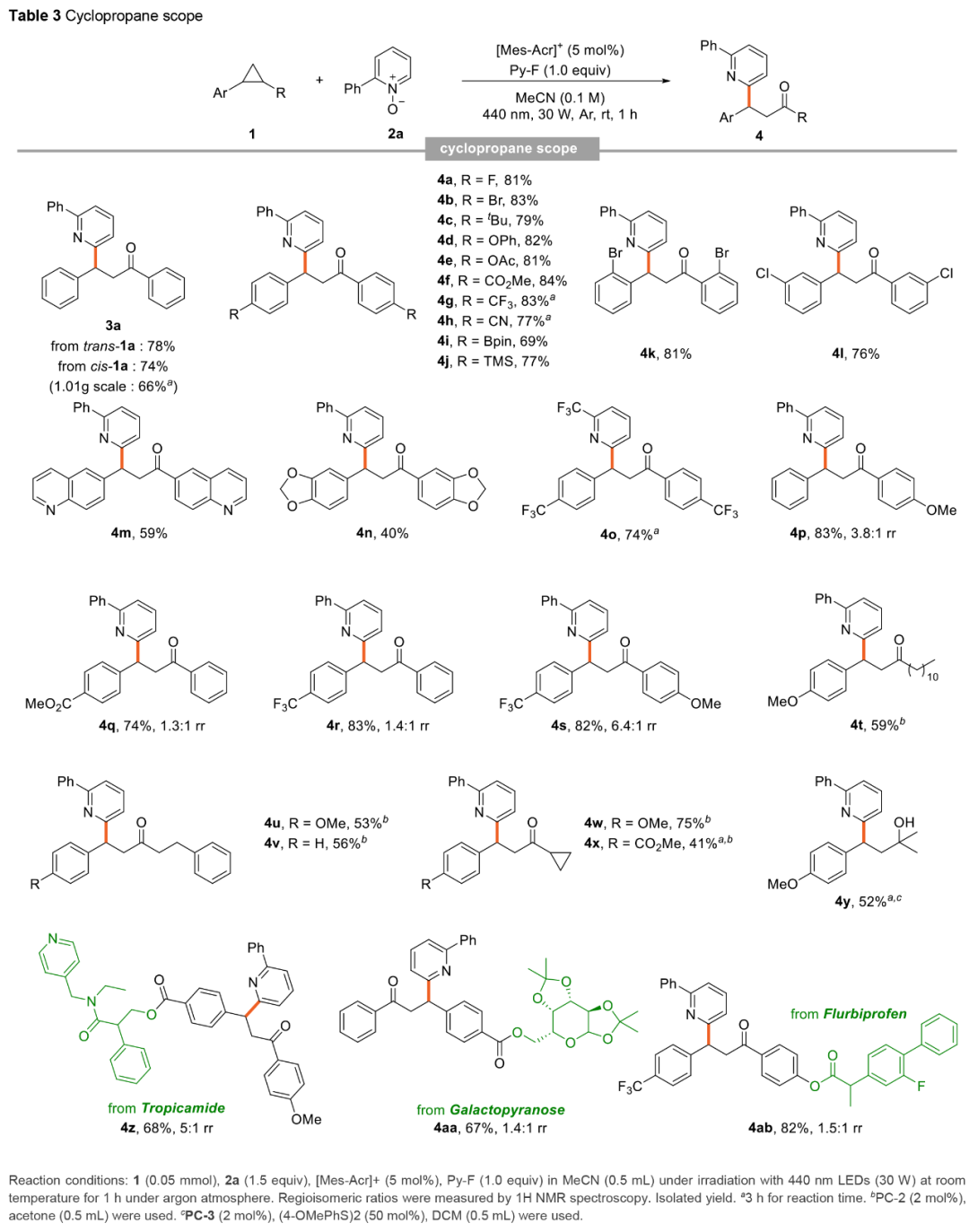
(Table 3,来源:Chem. Sci.)
随后,作者对反应的机理进行了研究(Figure 2)。自由基捕获实验结果表明,反应涉及自由基的途径(Figure 2a)。光开关实验表明,自由基链机理不太可能在这个体系中起作用。中间体的研究结果表明,醇化合物5a可能是反应的中间体(Figure 2b)。光催化剂循环和N-氧化物对有效转化的必要性表明,N-氧化物在醇氧化为酮产物中起着至关重要的作用。Stern-Volmer与CV实验结果表明,反应可能涉及两种协同的途径: 1)通过吡啶N-氧化物与环丙烷氧化形成的环丙烷自由基阳离子通过SN2反应进行开环,2)通过涉及吡啶N-氧化物氧化产生的O-中心自由基通过SH2反应进行开环(Figure 2c)。
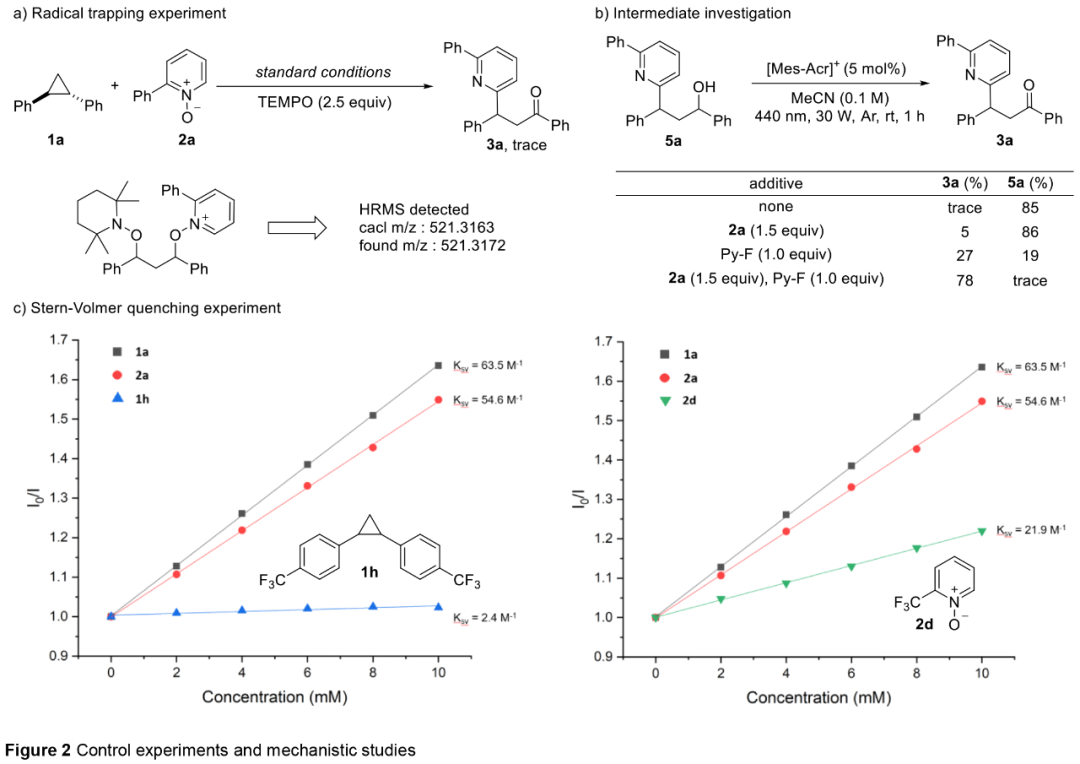
(Figure 2,来源:Chem. Sci.)
基于上述的研究以及相关文献的查阅,作者提出了一种合理的反应机理(Figure 3)。首先,光催化剂的光激发促进环丙烷或吡啶N-氧化物的单电子氧化。吡啶N-氧化物2a对氧化的环丙烷中间体或N-氧化物的O-中心自由基对环丙烷的亲核进攻,导致C-C键的断裂,生成中间体Int 1。其次,中间体Int 1中的苄基自由基加入吡啶环的C-2位后,可实现相应的环化,并生成中间体Int 2。随后,中间体Int 2经N-O键的断裂和重排,生成中间体Int 3。中间体Int 3经分子间HAT或1,2-HAT,生成中间体Int 4。最后,吡啶自由基阳离子氧化苄基自由基后生成苄基阳离子,通过进一步去质子化,可获得目标酮产物3a。此外,作者还提出了另一种替代性的反应机理(见SI)。
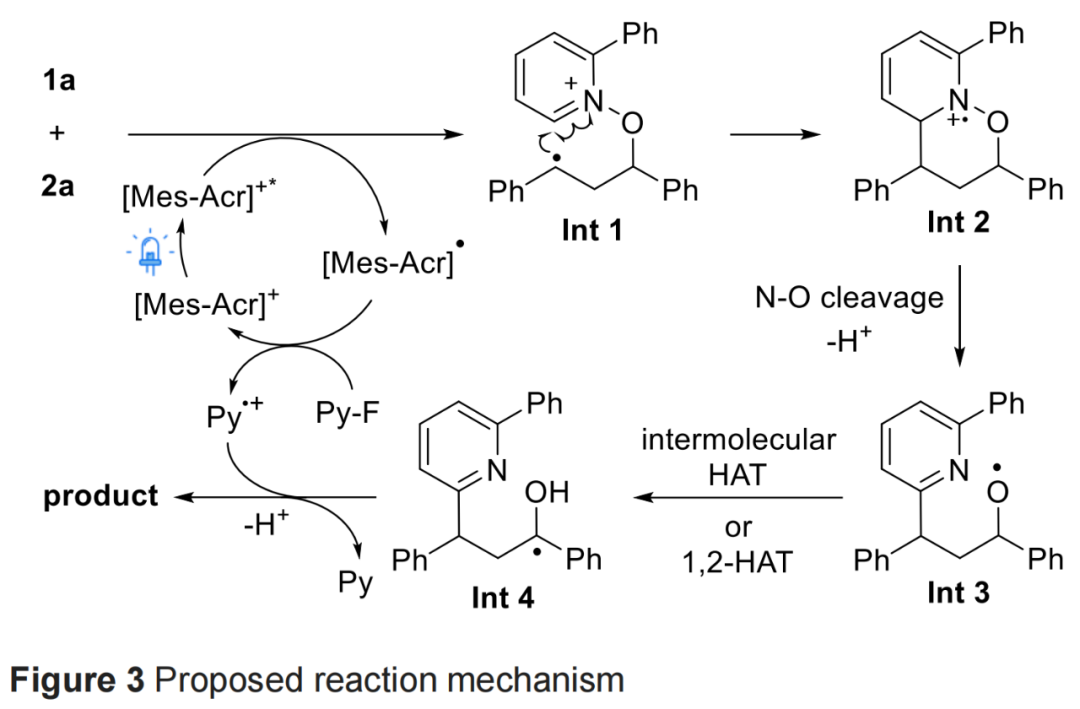
(Figure 3,来源:Chem. Sci.)
总结
韩国科学技术院Sungwoo Hong课题组报道了一种光催化芳基环丙烷与吖嗪N-氧化物的1,3-氧杂芳基化反应,合成了一系列β-杂芳基酮衍生物。同时,该反应具有底物范围广泛、官能团兼容性出色、反应条件温和、无需金属催化剂等特点。机理研究表明,芳基环丙烷和N-氧化物都可以通过不同的途径淬灭光催化剂,证实了自由基过程参与了这一反应。
论文信息
Photocatalytic 1,3-Oxyheteroarylation of Aryl Cyclopropanes with Azine N-oxides
Doyoung Kimab, Hyewon Juab, Wooseok Leeab, Sungwoo Hong
Chem. Sci.
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





