云南大学金毅课题组Adv. Synth. Catal.:通过光氧化还原催化亚砜叶立德的N-H插入构建α-酮酰胺
近日,云南大学金毅课题组报道了一种光氧化还原催化亚砜叶立德实现N-H插入的策略,通过同时引发亚砜叶立德自由基和N自由基,实现C-N键的自由基偶联,并合成了一系列α-酮酰胺。该策略避免了氧化剂的添加,仅使用空气中的氧气作为氧化剂和氧源,并且这种转化可以在温和的条件下进行,具有优异的产率。相关研究成果发表在Advanced Synthesis & Catalysis上。
碳自由基是自由基型 C-X 键偶联反应的基本中间体,发现多功能碳自由基前体是合成方法学的一个重要方向。在这方面,利用简单通用的反应条件形成碳自由基同样重要,这些条件需要实现高化学选择性和广泛的官能团耐受性。硫叶立德因其独特的反应性和易于制备的特点在有机合成中作为单碳骨架得到广泛应用,成为了有机合成领域中最重要和应用最广泛的试剂之一。在简单条件下使用硫叶立德作为碳自由基前体生成碳自由基是一种十分有效的方法。因此,Schuster课题组开创了硫叶立德在可见光照射下作为碳自由基前体的光化学研究。基于此,Chen 等人通过还原质子耦合电子转移(PCET)和氧化单电子转移(SET)两种反应模型证明了硫叶立德在自由基交叉偶联中更广泛的合成应用(图1a)。虽然亚砜叶立德是硫叶立德的一种变体,近几十年来已广泛应用于过渡金属催化的 C-H/C-S 键活化,但它们在光化学径向中的合成研究甚少。自 2023 年以来,Huang 等人先后报道了通过可见光介导亚砜叶立德生成碳自由基的不同方法。这两种方法都是通过 亚砜叶立德在H2O或acid-H的作用下进行还原质子耦合电子转移(PCET)来形成碳自由基(图1b)。作者发现通过氧化单电子转移(SET)从亚砜叶立德中直接得到碳自由基的方法迄今为止很少报道,那是否能寻找一个既简单又通用的光化学体系,通过直接氧化单电子转移(SET)的方式形成亚砜叶立德上的碳自由基。基于以上设想,作者报道了通过光氧化还原催化亚砜叶立德的N-H插入合成α-酮酰胺的反应研究(图1c)。

图1 硫叶立德碳自由基的形成方式(来源:Adv. Synth. Catal.)
作者以亚砜叶立德1a和苄胺2a作为反应原料的模型反应进行了反应条件的优化(图2)。最终发现反应在空气气氛中,以 CH3CN 作为反应溶剂,Ru(bpy)3(PF6)2(2 mol%)作为催化剂,加入 4Å 分子筛,在室温下蓝光LED(420 nm, 15W)照射4小时,以82%的分离收率得到α-酮酰胺衍生物3a。
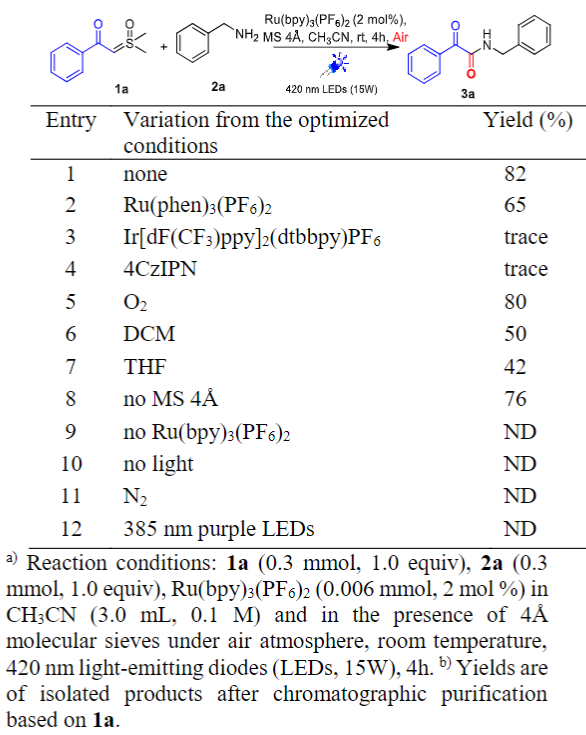
图2 条件优化(来源:Adv. Synth. Catal.)
作者在最优条件下对该反应进行了底物拓展(图3)。首先研究了亚砜叶立德的底物范围,总的来说,苯环上有取代基(3a–3k)的亚砜叶立德都能以中高收率产生相应的产物。芳环上不管是引入吸电子基团(4-F、4-Cl、4-CF3、3-F、3-Br、2-Cl)还是给电子取代基(4-Me, 4-OMe,3-Me和3,5-2 Me)都能顺利进行反应。将苯环换作噻吩(3l),萘环(3m)或环己烷(3n),反应也能顺利进行。随后对胺类化合物的普适性进行了考察,结果发现,不仅不同取代的苄胺(4a-4l)可以以合理的产率获得目标产物,烷基胺(4m-4o),二级胺(4p)和氨基酸酯(4q, 4r)均能兼容该反应。
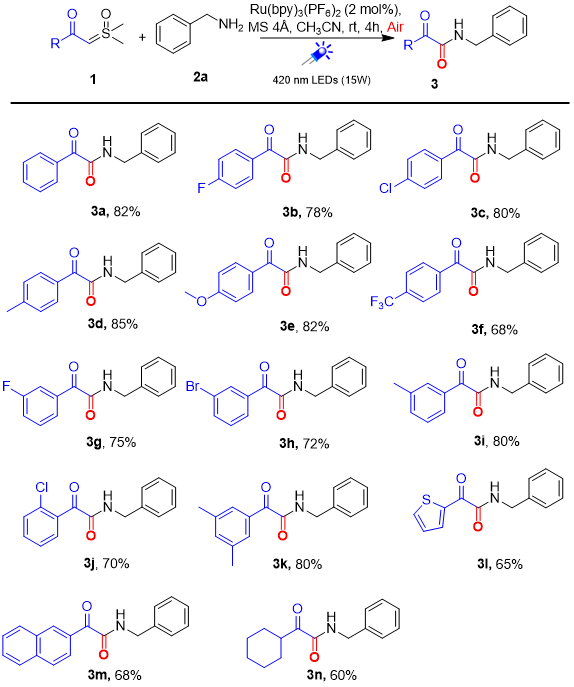
图3 底物拓展(来源:Adv. Synth. Catal.)
为了深入了解反应的机理,作者进行了一系列控制实验(图4a)。首先,为了探索该反应是否涉及自由基中间体,分别将1.0和4.0当量的自由基捕获剂(TEMPO和 BHT)加入到标准条件下的反应中,结果,反应被明显抑制(eq. 1)。然后,作者通过HRMS检测到了 TEMPO 和 BHT 捕获的亚砜叶立德自由基中间体(eq. 2)。作者将2-吗啉代-1-苯乙烷-1-酮5在标准条件下进行反应,无法得到目标产物,排除了化合物5 作为反应中间体的可能性(eq. 3)。为了证明产物中的氧原子来源于氧气,作者用18O2进行了同位素标记实验,得到了同位素标记的产物。为了进一步探明反应中亚砜叶立德自由基生成的机理,作者在空气气氛,非光照条件下增加了10倍光催化剂Ru(II)的量,并在反应中加入自由基捕获剂(TEMPO和 BHT),室温反应4小时,通过HRMS无法检测到了 TEMPO 和 BHT 捕获的亚砜叶立德自由基中间体,排除了亚砜叶立德在反应体系中被 Ru(II)直接氧化为自由基的可能性。最后,作者进行了开关灯实验,目标产物仅在LED的连续照射下生成,排除了自由基的链式反应机制(图4b)。
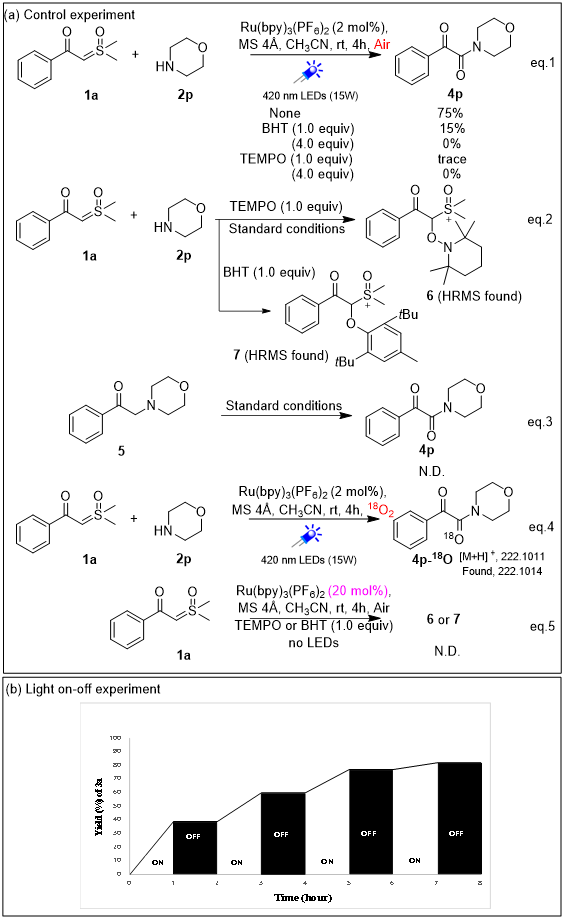
图4 控制实验(来源:Adv. Synth. Catal.)
基于以上机理研究和课题组先前的研究,作者提出了反应可能的机理(图5):最初,反应从被光照激发的Ru(bpy)3(PF6)2 开始,被O2氧化淬灭,产生 [Ru(III)]3+ 和超氧化物O2•−。随后 [Ru(III)]3+ 将1a氧化成亚砜叶立德自由基A,同时 [Ru(III)]3+ 被还原为 [Ru(III)]2+。Ru(bpy)3(PF6)2 的 E1/2(*P/P–) 和 E1/2(P/P–) 分别为0.77 V 和 −1.33 V(vs. SCE),通过循环伏安法测量亚砜叶立德1a的氧化还原电位为 Eox = 0.98 V,Ered < −2.0 V(vs. SCE),因此也排除了被光照激发的Ru(bpy)3(PF6)2直接氧化亚砜叶立德的可能性。另一方面,胺被 [Ru(III)]3+ 氧化得到自由基阳离子B。随后O2•− 从B中夺走一个质子产生自由基C。之后,自由基A与自由基C偶联,得到亚胺型中间体D,并释放出DMSO。最终,亚胺型中间体D被O2•− 氧化,经由过氧化物型中间体E生成目标产物4p。
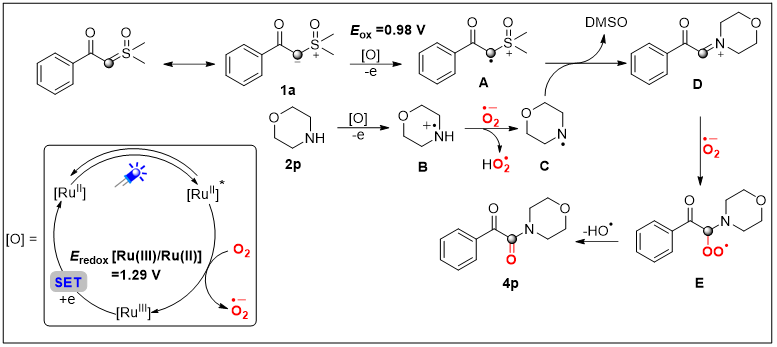
图5 机理推测(来源:Adv. Synth. Catal.)
最后,作者进行了反应应用扩展以证明反应的可扩展性(图6)。作者首先进行了克级反应实验:在标准条件下以亚砜叶立德1a(1.0 g)和吗啉2p(0.43 g)的比例进行了反应,以62%的产率分离得到目标产物4p(0.67 g)。随后作者将α-酮酰胺4p和4-甲基苯磺酰肼在甲苯作溶剂的条件下回流5小时,以80%的收率获得α-甲苯磺酰腙8,证明了反应的可扩展性。
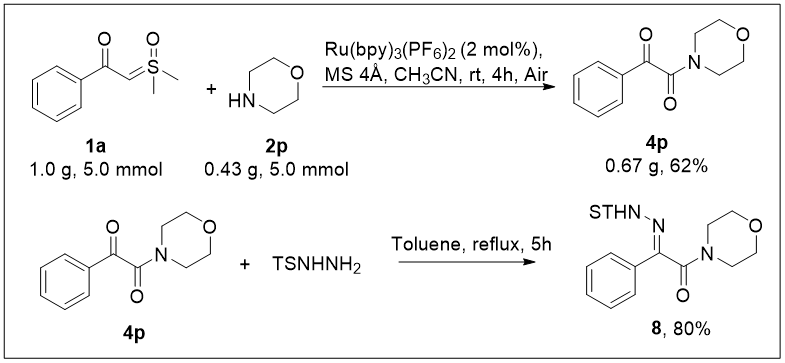
图6 反应扩展(来源:Adv. Synth. Catal.)
综上所述,作者开发了一种通过光氧化还原催化亚砜叶立德的 N-H 插入反应构建α-酮酰胺的方法,为合成α-酮酰胺提供了可行的途径。并进行了克级反应和合成转换,证实了反应的可扩展性和应用价值。该方法还证明了亚砜叶立德可以通过可见光诱导的氧化 SET形成碳自由基,为后续的碳自由基反应设计提供了思路。
云南大学药学院于祥林为该论文第一作者,云南大学金毅研究员为该论文通讯作者。该研究得到了国家自然科学基金项目(22267021;22067020)、云南省自然科学基金(202101AS070034;202001BB050009)、云南省“云岭学者”计划基金(YNWR-YLXZ-2014-009)。
论文信息
Construction of α-ketoamides via Photoredox-Catalyzed N−H Insertion of Amines by Sulfoxonium Ylides
Xianglin Yu, Haiyue Yang, Chang Liu, Qiping He, Zhijun Yang and Yi Jina*
Adv. Synth. Catal. 2024
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





