南京大学俞寿云课题组ACS Catal.: 光激发钯催化由炔烃通过异构化和去消旋化合成光学活性联烯
导读
联烯是具有独特反应模式的分子,被广泛用作合成复杂分子(包括天然产物和生物活性物质)的构建砌块(图一)。它们可以作为酶抑制剂或抗病毒剂,而手性联烯也在不对称合成中作为配体发挥作用。此外,联烯轴手性向中心手性转移产生新的手性中心,也引起有机化学家和药物化学家的极大兴趣。尽管对手性联烯的合成应用已经有了广泛探索,不对称合成这些有价值的分子仍然是一个具有挑战性的任务。
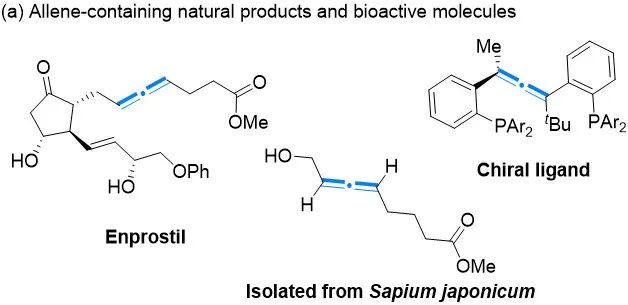
图一(图片来源:ACS Catal.)
炔烃作为联烯的同分异构体,经常被用作联烯合成的起始原料。在碱性条件下通过1,3-质子重排进行炔烃到联烯的异构化,是合成联烯最直接且方便的方法之一。然而,通过这种策略实现对映体富集的手性联烯仍然是一个重大挑战(图二)。2000年,Shioiri及其合作者报道了在相转移催化剂存在下,1,3-二芳基炔烃不对称异构化为轴手性联烯的反应。尽管该反应的对映选择性中等,但它代表了通过炔烃异构化构建手性联烯的早期例子。2009年,Tan及其合作者报道了由Brønsted碱催化的炔烃异构化反应,以高对映选择性生成手性二取代联烯,其中体积庞大的酯基对于实现良好的对映选择性至关重要。2011年,akemoto及其合作者设计了氢键给体催化剂,促进炔基酰胺的不对称异构化生成相应的手性联烯。2019年,Kanai的团队开发了一种铜催化的质子迁移反应实现炔烃到联烯的构建,具有良好的区域选择性和对映选择性。尽管取得了这些进展,炔烃到手性联烯的不对称异构化仍存在显著挑战:(1)转化率通常不理想,炔烃和联烯的极性相近使其纯化变得困难;(2)底物通常需要预先安装极性官能团作为结合位点,限制了结构的多样性。因此,迫切需要一种方法,能够提供高转化率和对映选择性,无需依赖特定的官能团作为结合位点并可以适用于广泛的底物类型。
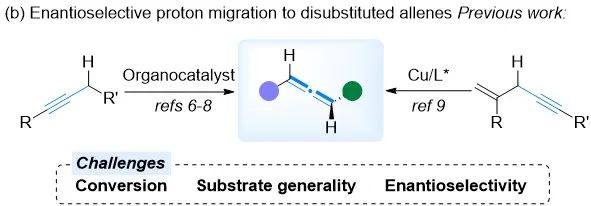
图二(图片来源:ACS Catal.)
俞寿云课题组近年来致力于激发态过渡金属催化的不对称转化(J. Am. Chem. Soc. 2024, 146, 27196; J. Am. Chem. Soc. 2022, 144, 10958; ACS Catal. 2023, 13, 2857; Org. Lett. 2024, 26, 5232.)。最近他们实现了激发态钯催化的消旋联烯的去消旋化反应(J. Am. Chem. Soc. 2024, 146, 21137),在此工作中,消旋联烯需要实现制备。由于炔烃可以通过碱促进的异构化反应很容易地得到消旋联烯。基于此,俞寿云课题组以稳定且易得的炔烃作为起始物,通过碱促进异构化和激发钯催化的去消旋化策略一锅法实现了炔烃向手性联烯的高效不对称转化(图三)。在此工作中,碱在异构化和去消旋化的过程中均起到关键的作用。相关成果发表在ACS Catal.
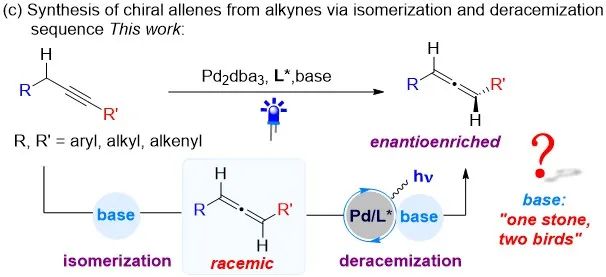
图三(图片来源:ACS Catal.)
成果
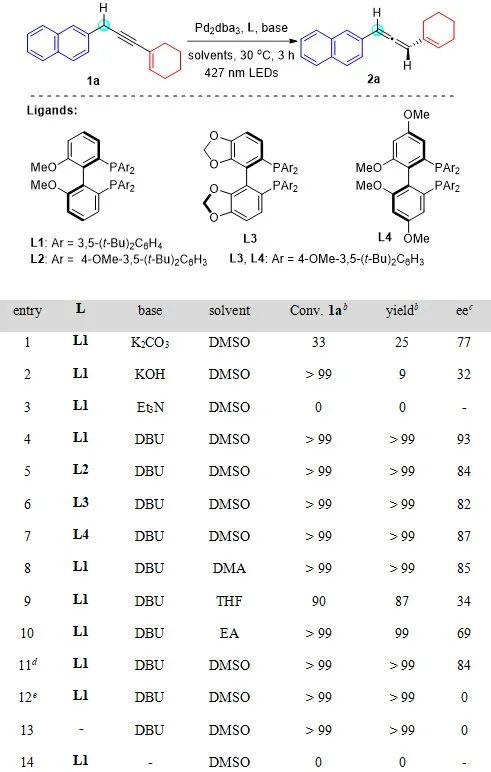
将1a(0.1 mmol)、Pd2dba3(2.5 mol%)、L1(6 mol%)和K2CO3的DMSO溶液用40 W蓝色LED灯(λmax = 427 nm)照射,30°C下反应3小时(Table 1,entry 1)。作者发现以碳酸钾作为碱反应进行缓慢,转化率低(33%)且对映选择性中等(77% ee)。当使用KOH作为碱时,炔烯1a完全转化,但生成的联烯大部分分解(entry 2)。使用Et3N作为碱时未检测到产物生成(entry 3)。找到一种既能有效促进炔烯异构为联烯,又能提高去消旋化过程中立体选择性控制的碱非常具有挑战性。通过对碱进行广泛筛选(更多信息见SI中的Table S3),作者发现DBU是合适的选择。手性联烯2a以几乎定量的产率获得(> 99% GC收率,98%分离收率),且具有优异的对映选择性(93% ee,entry 4)。其他双膦配体,例如MeO-BIPHEP (L2)、SEGPHOS (L3) 和 GARPHOS (L4) 没有获得更好的结果(entry 5-7)。接着进一步探索了各种溶剂的效果:使用DMA、THF和EA作为溶剂,反应产率不变,但立体选择性显著下降(entry 8-10)。将光源的波长改为456 nm并没有影响产率,但对映选择性降低(entry 11)。因为456 nm光源的能量较低,降低了去消旋化速率,并且与Pd/L/联烯复合物的吸收光谱无法实现最大程度的重叠。在没有光、钯或配体的情况下,只得到消旋的联烯(entry 12-13),这表明反应可能首先生成消旋联烯,然后再进行去消旋化以得到对映体富集的手性联烯。在没有DBU的情况下,炔烯完全回收,未检测到联烯的形成(entry 14)。
确定了最佳的反应条件后,作者对该方法的普适性进行了考察(图四)。芳基-烯基、烷基-烯基、芳基-烷基、芳基-芳基二取代联烯均具有较好的反应效果。一些复杂药物分子衍生的炔烃,如阿司匹林、厄洛替尼、吲哚美辛和伊索克酸,也可以高效转化成相应的手性联烯。
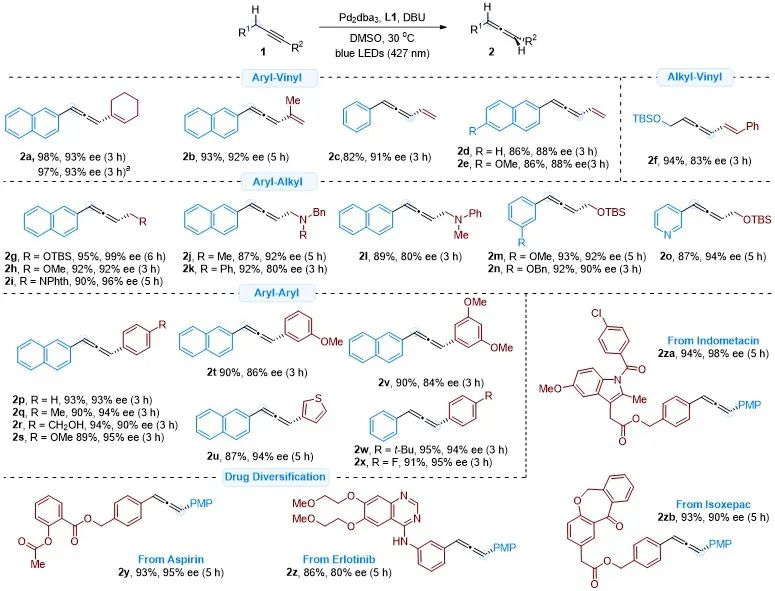
图四(图片来源:ACS Catal.)
为了验证碱的作用,作者进行了动力学实验,并监测了反应的进程(图五a)。观察到随着时间的延长,炔烃1a向联烯2a转化中其产率和对映选择性逐渐提高。DBU的存在显著加速了炔烃1a向联烯2a的转化,仅在30分钟内就达到了68%的产率,并在2小时内完全转化为联烯。联烯的去消旋化速率慢于炔烃的异构化速率,在30分钟时仅检测到22%的ee,并在3小时后达到最大值。为了进一步阐明DBU的作用,作者绘制了消旋联烯rac-2a随时间变化的去消旋化曲线(图五b)。在标准条件下,联烯的ee在2小时内达到峰值。此外,在反应中移除DBU会导致去消旋化的速率和程度均下降。这些发现表明DBU具有双重作用:既可以促进炔烃向联烯的异构,又可以促进消旋联烯向手性联烯的转化。
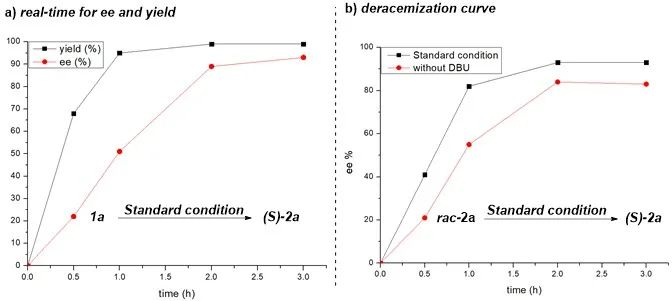
图五(图片来源:ACS Catal.)
为了进一步展示该方法的实用性和底物的多样性,作者进一步研究了不同的炔烃异构体(图六a)。即使使用不同的炔烃前体,也能够以良好的产率和对映选择性获得芳基-烯基(2d)和芳基-芳基二取代联烯(2s)。含有弱酸性氢原子的炔烃(1g')在碱性条件下无法异构化为联烯(2g),导致起始原料1g'完全回收。联烯(2a)的合成潜力通过与二乙基偶氮二甲酸酯和4-苯基-1,2,4-三唑烷-3,5-二酮通过Hetero-Diels−Alder反应得以展示(图六b),生成了并环手性产物3和4。轴手性到中心手性的转化过程中,手性得到了良好的保持。
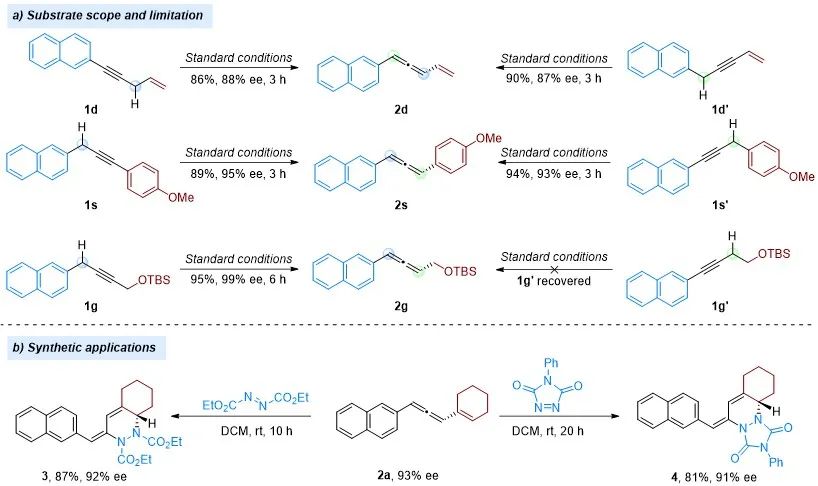
图六(图片来源:ACS Catal.)
小结
俞寿云课题组成功实现了从炔烃到手性联烯的异构化和去消旋化反应,具有高产率和高对映选择性。DBU展现了关键的双重催化效果,有效促进了炔烃向联烯的异构化,并在可见光激发下加速了钯催化的联烯去消旋化过程。成功构建了多种二取代联烯,如芳基-烯基、烷基-烯基、芳基-烷基和芳基-芳基联烯。利用稳定且易得的炔烃作为起始材料,实现了其高效的不对称转化,有效克服了以往此类转化中普遍存在的转化率低和对底物结构敏感的挑战,为手性联烯的合成提供了一条简便和普适的方法。相关文章发表于ACS Catal.,南京大学宋常华博士为论文第一作者,俞寿云教授为通讯作者。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





