南京大学俞寿云/天津大学党延峰课题组JACS:光激发铜催化非环状烯烃对映选择性烯丙基C(sp³)-H酰氧基化反应
碳氢(C–H)键是有机分子中最常见的结构,其直接官能团化能够避免底物预活化的需求,为目标分子的合成提供了更简洁高效的途径。然而,由于C–H键,特别是C(sp3)–H键的化学惰性,这类分子的选择性转化,尤其是对映选择性的控制,成为了一项极其困难的挑战。
目前,对不对称烯丙基C(sp3)–H键直接酰氧基化的研究仍十分有限。在Henry和White课题组针对环状烯烃和末端烯烃所做的钯催化与乙酸的不对称氧化烯丙基乙酰氧基化反应中,尽管取得了一定进展,但两者的对映选择性控制均不理想(图1a)。铜催化的Kharasch-Sosnovsky反应是经典的烯丙基C–H键直接氧化合成烯丙酯的策略,然而其不对称版本目前仅适用于环状烯烃。尽管少数研究尝试了非环烯烃的不对称Kharasch-Sosnovsky反应,但效果同样不够理想(b/l > 20:1,67% ee,图1b)。当前,不对称Kharasch-Sosnovsky反应仍然存在诸多局限,如反应时间长、底物范围狭窄、需大量过量烯烃以及化学键成键类型有限等问题。
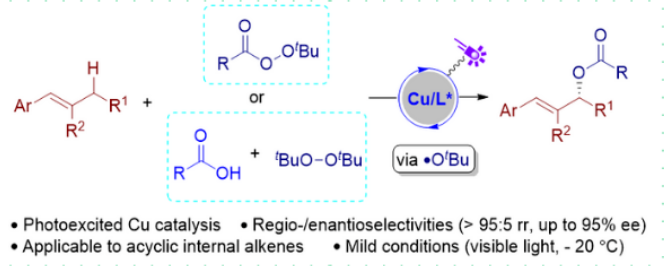
南京大学俞寿云课题组一直致力于激发态过渡金属不对称催化反应研究(J. Am. Chem. Soc. 2022, 144, 10958; ACS Catal. 2023, 13, 2857; Org. Lett. 2024, 26, 5232; J. Am. Chem. Soc. 2024, 146, 21137)。基于此,俞寿云课题组(实验部分)与天津大学党延峰课题组(理论计算部分)合作,开发了这一新型光激发铜催化的非环状内烯的对映选择性烯丙基C(sp3)–H酰氧基化反应。相关成果发表在J. Am. Chem. Soc. (图1c)。
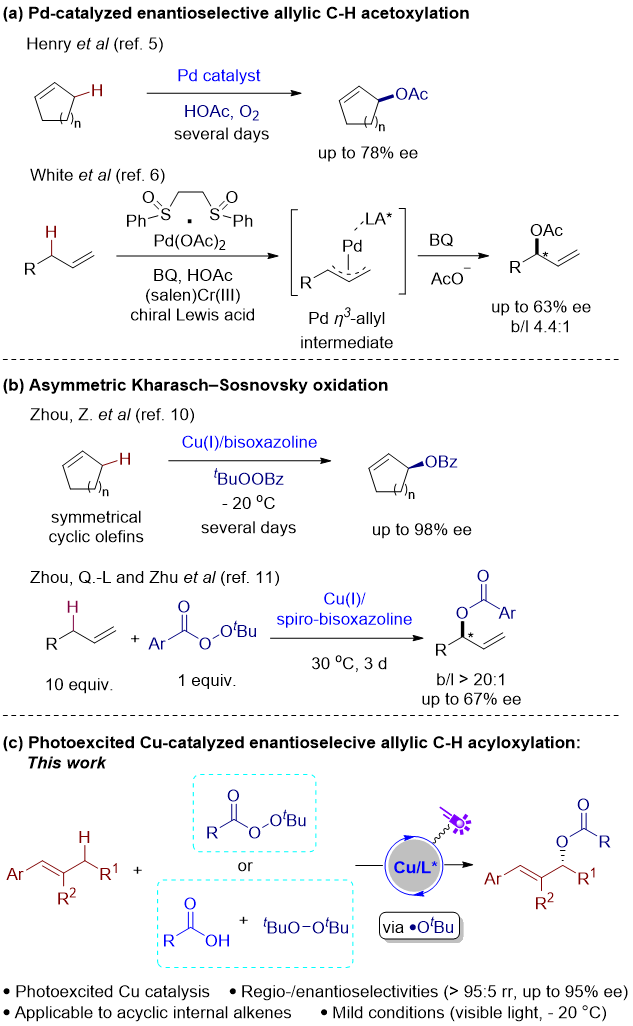
图1 过渡金属催化的烯丙基C(sp3)–H键分子间酰氧基化反应(来源:JACS)
光激发铜催化非环状烯烃对映选择性烯丙基C(sp3)-H酰氧基化反应
作者首先选用 (E)-β-丙基苯乙烯 (1a) 和过氧化苯甲酸叔丁酯 (TBPB, 2a) 作为烯丙基 C–H氧化反应的模板底物,开展反应条件筛选(表1)。初始催化体系由 Cu(CH3CN)4PF6(2.0 mol %)和手性双噁唑啉(Box)配体 L1(2.5 mol %)组成,反应组分溶于1.0 mL DCE,在氮气气氛下,使用45 W蓝色LED灯照射16小时。结果显示,C-H 酰氧基化产物 3a 的GC产率为76%,对映选择性良好(81% ee)。经过系统筛选,最终确定了Cu(CH3CN)4PF6和配体L4,以DCE作为溶剂。为提高对映选择性,反应在-20°C下进行,虽然对映选择性显著提升,但产率下降。通过光源筛选,作者发现-20°C下使用波长390 nm的紫色LED灯照射,能够在不降低产率的情况下获得优异的对映选择性(分离收率78%,92% ee)。控制实验表明,铜配体催化剂和光照都是反应所必需的。
表1. 条件筛选
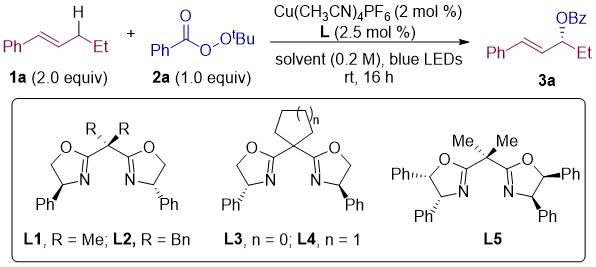
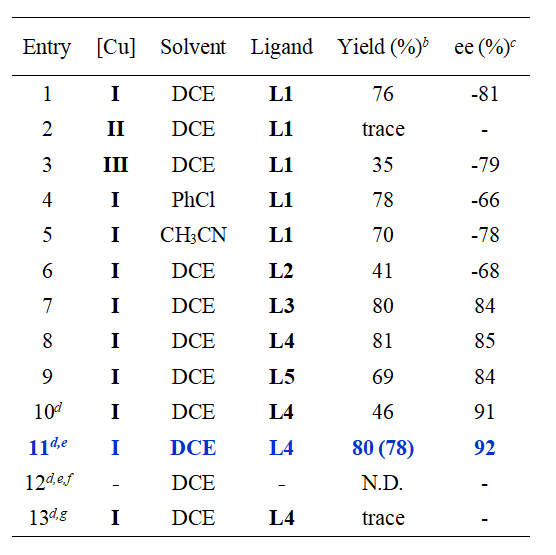
(来源:JACS)
在确定反应条件后,作者考察了底物的适用范围(图2)。延长或缩短烷基链,均能获得与模板反应相似的产率和对映选择性。无论是邻位、间位、对位的给电子或吸电子基团以及卤素取代基,该反应都表现出优异的区域选择性和对映选择性。此外,不仅是二取代烯烃,三取代烯烃同样适用。过氧化物的底物扩展实验表明,各类过氧化羧酸酯均能很好地参与这一反应。
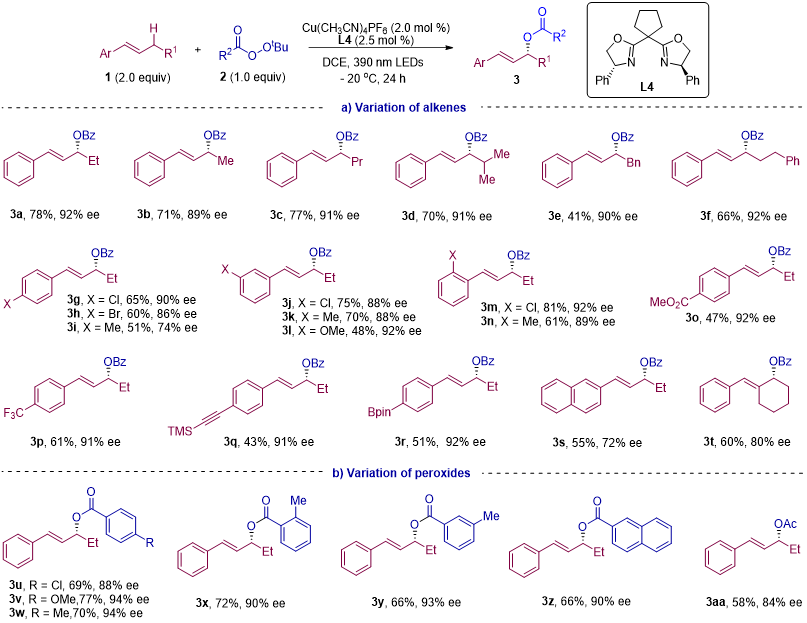
图2. 两组分反应的底物拓展(来源:JACS)
考虑到过氧化羧酸酯的预制和苛刻的保存条件,作者进一步探讨了是否可以使用来源更广泛的羧酸作为亲核试剂,并额外添加二叔丁基过氧化物作为氧化剂,进行三组分反应(图3)。令人鼓舞的是,当作者探索多种商业可得的羧酸时,目标转化依然顺利进行。如图3所示,这一策略适用于多种羧酸,包括芳香羧酸、杂芳环羧酸及多种脂肪类羧酸,均能以相当的产率(37%−82%)和优异的对映选择性(85%−95% ee)合成相应的手性烯丙酯。三组分反应的成功极大地拓展了底物适用范围。
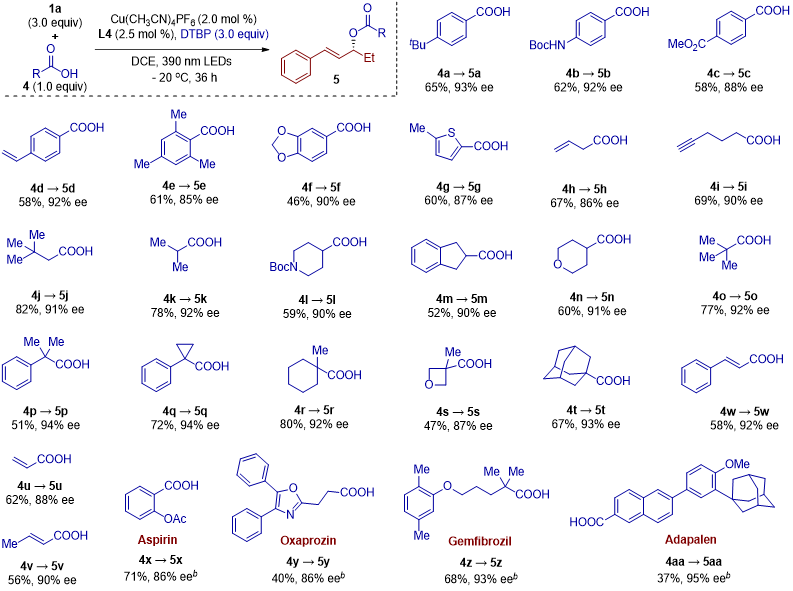
图3. 三组分反应的底物拓展(来源:JACS)
为了进一步展示该反应的合成适用性,作者对二组分和三组分反应进行了克级放大(图4)。在放大反应中,产率和选择性均得到了良好的保持。随后,作者对手性烯丙酯的酯基和双键进行了简单的转化,以进一步证明该反应的应用潜力。
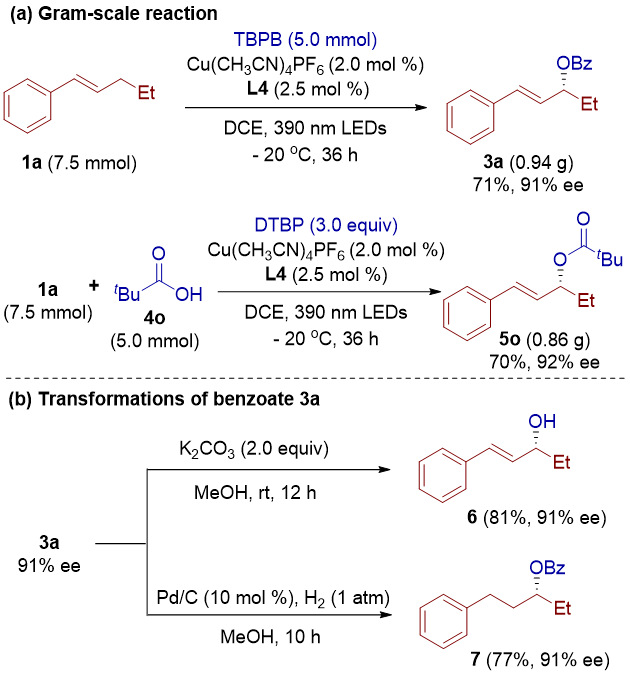
图4. 克级实验及合成转化(来源:JACS)
最后,作者进行了机理实验并提出了可能的反应机制(图5)。最初,L4Cu(I)X配合物与烯烃1结合,形成活性催化物种Cu(II)-烯烃配合物A。在光激发下,配合物A转变为其激发态B。该激发配合物B在TBPB的促进下经历单电子氧化,生成苯甲酸配合物L4Cu(II)物种C和叔丁氧自由基D。随后,叔丁氧自由基D与苯甲酸配合物C发生HAT过程,形成关键的π-烯丙基Cu(III)中间体E。该中间体E接着经历对映选择性还原消除,生成手性烯丙酯3,并再生L4Cu(I)配合物A,进入下一个催化循环。
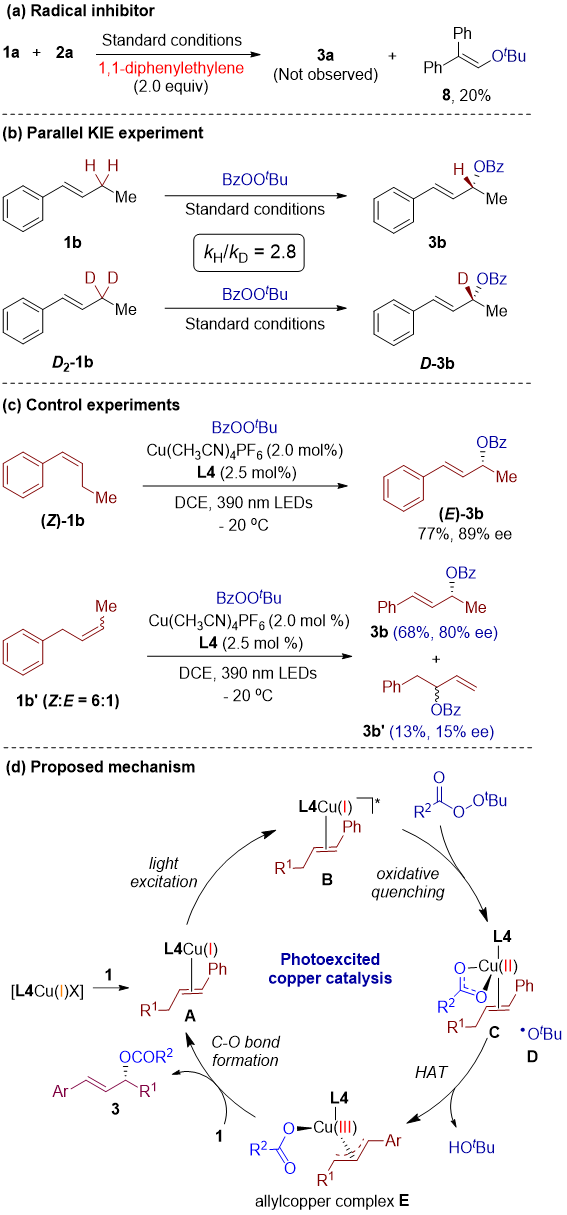
图5. 机理实验及反应可能的机制(来源:JACS)
为验证提出的反应机理,作者与天津大学的党延峰课题组合作进行了理论计算(图6)。以光激发的L4/Cu催化的不对称Kharasch-Sosnovsky反应为例,研究了其反应机理。L4/Cu(I)-π-1b(IM1)被确认为起始点。无光激发条件下,L4/Cu(I)与TBPB的氧化反应需22.0 kcal/mol的能垒,在实验条件下无法实现,证实了仅形成微量产物的结论(表1,条目13)。光激发后,IM1S1经过系间窜跃(ISC)形成三重态IM1T1,热力学能量提高57.2 kcal/mol。IM1T1通过单电子转移生成L4/Cu(II)(IM2)和叔丁氧自由基,活化自由能为0.3 kcal/mol。计算表明HAT过程为速率决定步骤,符合KIE实验结果。综合整个反应路径,涉及的SET、底物解离、HAT、自由基捕获、还原消除及配体交换等步骤均为放热反应,从而推动反应进入下一个催化循环。
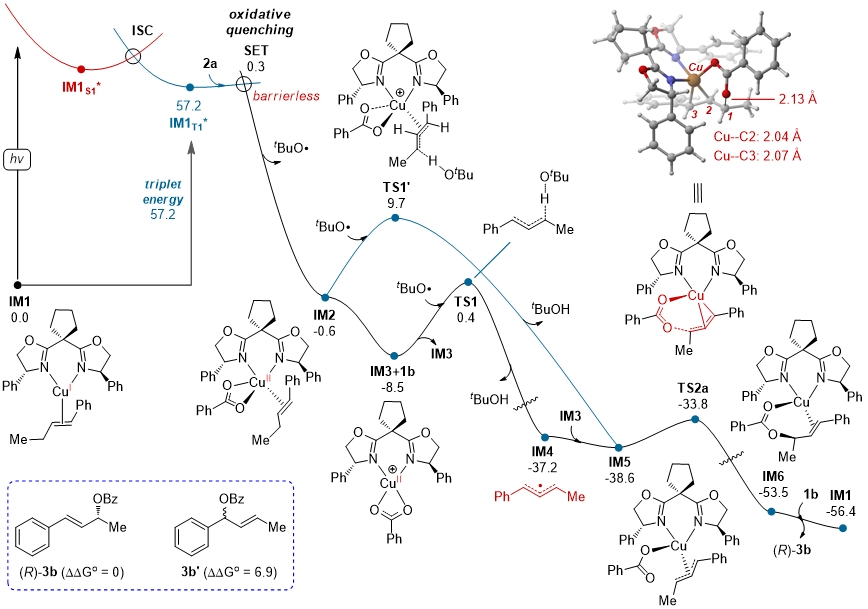
图6. 光诱导铜催化不对称Kharasch-Sosnovsky反应的自由能曲线图(单位:kcal/mol)(来源:JACS)
作者在图7中展示了关键C−O键形成过渡态的优化结构,发现生成(R)-3b的路径最为有利。TS2a的能量至少比其他竞争路径高出1.7 kcal/mol,导致对映选择性和区域选择性倾向于(R)-3b。分析TS2a与TS2b的结构,TS2a中烯丙基苯基团远离L4,配体与底物间的空间排斥较小,同时C−H键与苯环的距离为2.52 Å,增强了C−H/π的色散相互作用,稳定了TS2a。而在TS2a'中,空间排斥和C−H/π相互作用减弱,导致更高的能垒。由于削弱了烯丙基与苯基之间的共轭效应,导致TS2b和TS2b'的区域异构体3b'能量显著提高。因此,结合共轭效应以及上述空间/色散因素,从而为反应的高区域选择性和对映选择性提供了定性的解释。
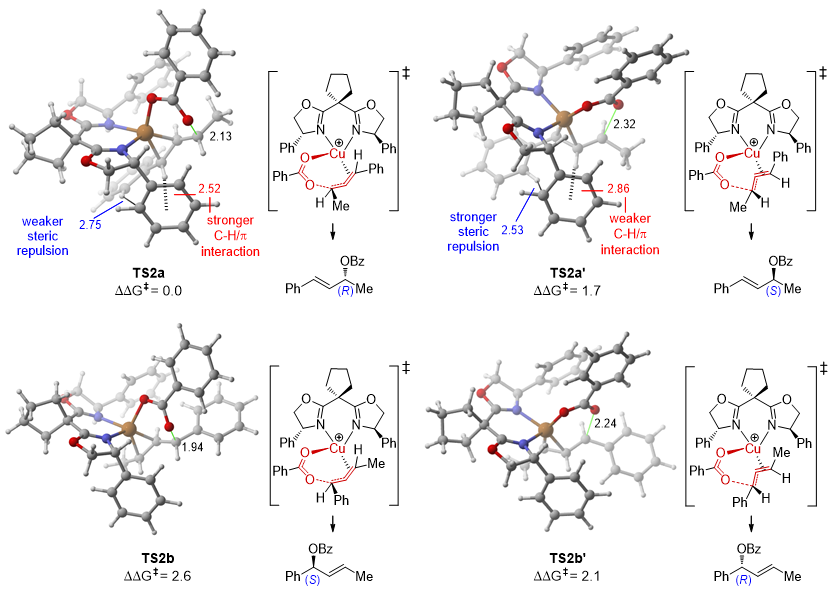
图7. 关键C−O键形成过渡态的优化结构,选定的键长以(Å)为单位(来源:JACS)
小结
作者报道了一种光激发铜催化的非环状烯烃对映选择性烯丙基C(sp3)–H酰氧基化反应,克服了底物范围有限、反应条件严苛和对映选择性欠佳的挑战。通过光催化和优化的铜/双恶唑啉配合物,实现了优异的反应性和对映选择性。该方法适用于多种无环烯烃和过氧化物(或酸),且验证了良好的可扩展性。DFT计算结果表明,共轭效应与空间/色散因子结合,为反应的高区域选择性和对映选择性提供了定性和定量的解释。相关文章发表于J. Am. Chem. Soc.,南京大学博士生汤胜、天津大学许辉为论文共同一作,俞寿云教授和党延峰教授为共同通讯作者。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





