西安交通大学刘乐课题组Org.Lett.:光氧化还原催化的Conia-Ene型环化/Smiles重排级联反应
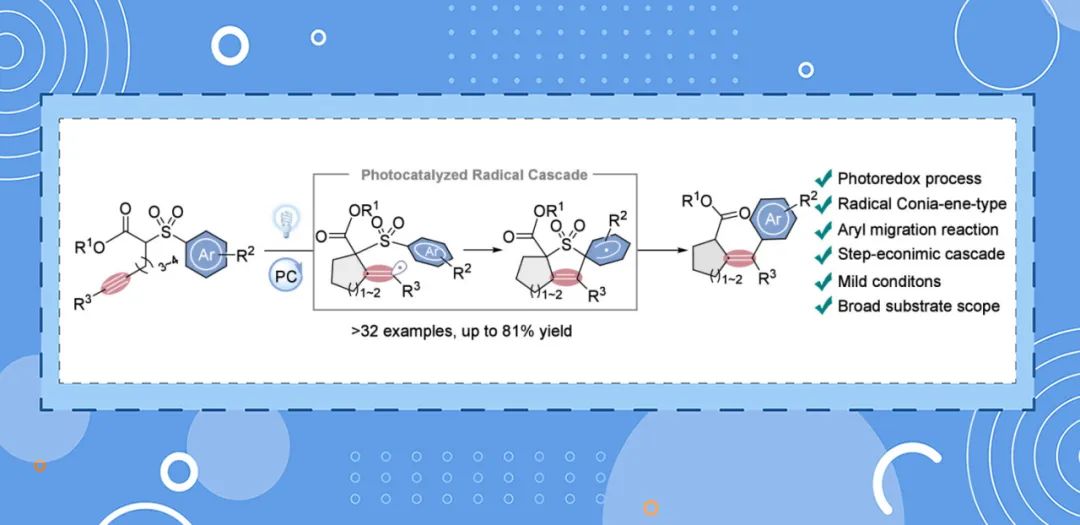
Conia-ene型环化是构建亚甲基环戊烷骨架的一种高效合成策略,其固有的分子内环化后1,5-氢迁移过程长期以来限制了该策略在构建含有不同取代基团的复杂环状骨架结构中的应用。最近,西安交通大学刘乐课题组发展了一例可见光驱动的Conia-ene型环化/Smiles重排级联反应,高效构建了多种多取代的亚甲基环烷烃骨架以及多取代环状内酯衍生物,拓展了Conia-ene型环化反应的应用范围,展示光催化官能团迁移反应的应用潜力。该成果发表在Org. Lett.。
亚甲基环烷烃骨架,尤其是多取代环烷烃骨架,广泛存在于生物活性的天然产物和药物制剂中。Conia-ene型反应,作为一种将炔烃与烯醇化的羰基通过分子内热环化反应形成环戊烷的有效手段,一直备受关注。然而,传统Conia-ene反应常受限于高温条件(超过200°C)且主要适用于高反应活性的末端炔烃(如图1A所示)。为探索更温和条件下的环化途径,研究者们引入了多种金属路易斯酸催化剂(图1B),通过促进金属-乙烯基中间体的交叉偶联反应,为合成多取代亚甲基环戊烷开辟了新路径。尽管如此,该领域仍面临多重挑战,包括内炔的低反应性、烯醇化底物受限,以及合成多功能环状化合物需要多步反应。此外,传统Conia-ene反应中固有的1,5-氢迁移过程限制了官能团多样性的拓展(图1B)。
鉴于上述挑战,开发一种能够规避传统Conia-ene反应局限性的直接合成策略显得尤为重要。近期,西安交通大学刘乐课题组在前期自由基化学和官能团迁移反应(Org. Chem. Front. 2020, 7, 2069-2074;Org. Chem. Front. 2022, 9, 966-972;Org. Lett. 2022, 24, 2767-2771;Org. Chem. Front. 2022, 9, 5599-5605;Chem. Sci. 2023, 14, 6663-6668;Org. Lett. 2023, 25, 5268-5272;Sci. China Chem. 2024, 67, 2022-2028;Chin. Chem Lett. 2024, 67, 10.1016/j.cclet.2024.110253)的基础上,报道了一种光驱动的自由基Conia-ene型环化/Smiles重排级联反应策略(如图1D所示)。此方法不仅为四取代亚甲基环烷烃的合成提供了一条直接且高效的路径,还通过引入芳基迁移机制,成功突破了传统1,5-氢迁移的限制,为合成具有潜在生物活性的新型多取代环烷烃骨架提供了一种新选择。

图1. 研究背景及设计思路(来源:Org. Lett.)
如图2所示,作者考察了一系列带有不同取代基团的远端炔烃磺酰基乙酸酯。结果显示,在标准反应条件下,底物的苯环上无论是携带吸电子基团还是供电子基团,均能与体系良好兼容,并以44%至81%的产率成功生成环状烯烃2ab-2aj。尤为引人注目的是,当磺酰基上的苯基与炔烃部分连接的苯基取代基不相同时,该反应依然能以中等至良好的产率获得非对称的环状四取代烯烃(2ah-2aj),尽管这些产物的立体选择性相对较低。通过细致的控制实验,作者深入剖析了产物立体选择性较低的根本原因,发现这主要是由于生成的烯烃产物在标准反应条件下极易发生光致异构化所致。为了克服这一挑战,研究者们积极探索了多种策略以提升反应的立体选择性。他们首先尝试了将光源更换为绿光,期望通过改变光的波长来影响产物的光化学行为,然而这一尝试并未如预期般显著提高产物的立体选择性。随后,研究者们又尝试了引入其他类型的光催化剂,以期通过调控光催化反应路径来优化产物的立体构型,但遗憾的是,这些努力同样未能达到预期的效果。
另外,一个值得注意的现象是,与缺电子的芳香基底物相比,富电子的芳基磺酰基底物在反应中表现出较差的反应性。这一发现暗示了缺电子的芳香环在Smiles重排反应中更易于发生ipso攻击,从而促进了反应的高效进行。这一结果不仅加深了对Smiles重排反应机理的理解,也为未来设计更具选择性和效率的催化剂提供了参考。
作者进一步深入探讨了炔烃部分上芳基取代基团的电子效应和空间效应对反应的影响。如图2所示,实验结果显示,无论是携带供电子基团(如甲基和甲氧基,无论是否具有空间位阻)还是吸电子基团(如氟、氯和溴)的芳基取代炔烃,均能在标准条件下以中等至良好的产率生成环状产物2ak-2ap。这一发现表明,炔烃芳基上的电子性质对反应效率具有重要影响,但并非决定性因素,因为多种不同类型的取代基均能有效参与反应。
此外,作者还考察了含有其他芳香环(如萘)和杂环(如噻吩)的炔烃底物,发现这些底物同样能够顺利进行级联反应,生成相应的环状产物(2aq和2ar)。这一结果表明,该反应体系对炔烃部分的芳香结构具有较好的兼容性,为合成结构多样的环状化合物提供了可能。
值得注意的是,在标准条件下,烷基取代的内炔烃也能以46%的产率和E/Z比为4:1的选择性生成产物2at。这一发现拓宽了底物的适用范围,表明该反应不仅适用于芳香炔烃,还能有效处理烷基取代的炔烃。同时,三异丙基甲硅烷基(TIPS)保护的炔烃前体也能顺利参与反应,以34%的产率得到产物2av,这进一步证明了该反应体系在保护基团存在下的稳定性和有效性。
然而,实验也发现末端炔烃在这些反应条件下并不兼容,这可能是由于末端炔烃的活性较高,容易引发副反应或导致反应路径的改变。此外,作者在酯部分进行了进一步的官能化尝试,发现无论是简单还是复杂的结构变化,对产物(2aw-2ay)的产率影响均不大。这一结果表明,该反应体系对酯部分的官能团具有较好的容忍性,为后续的合成转化提供了便利。
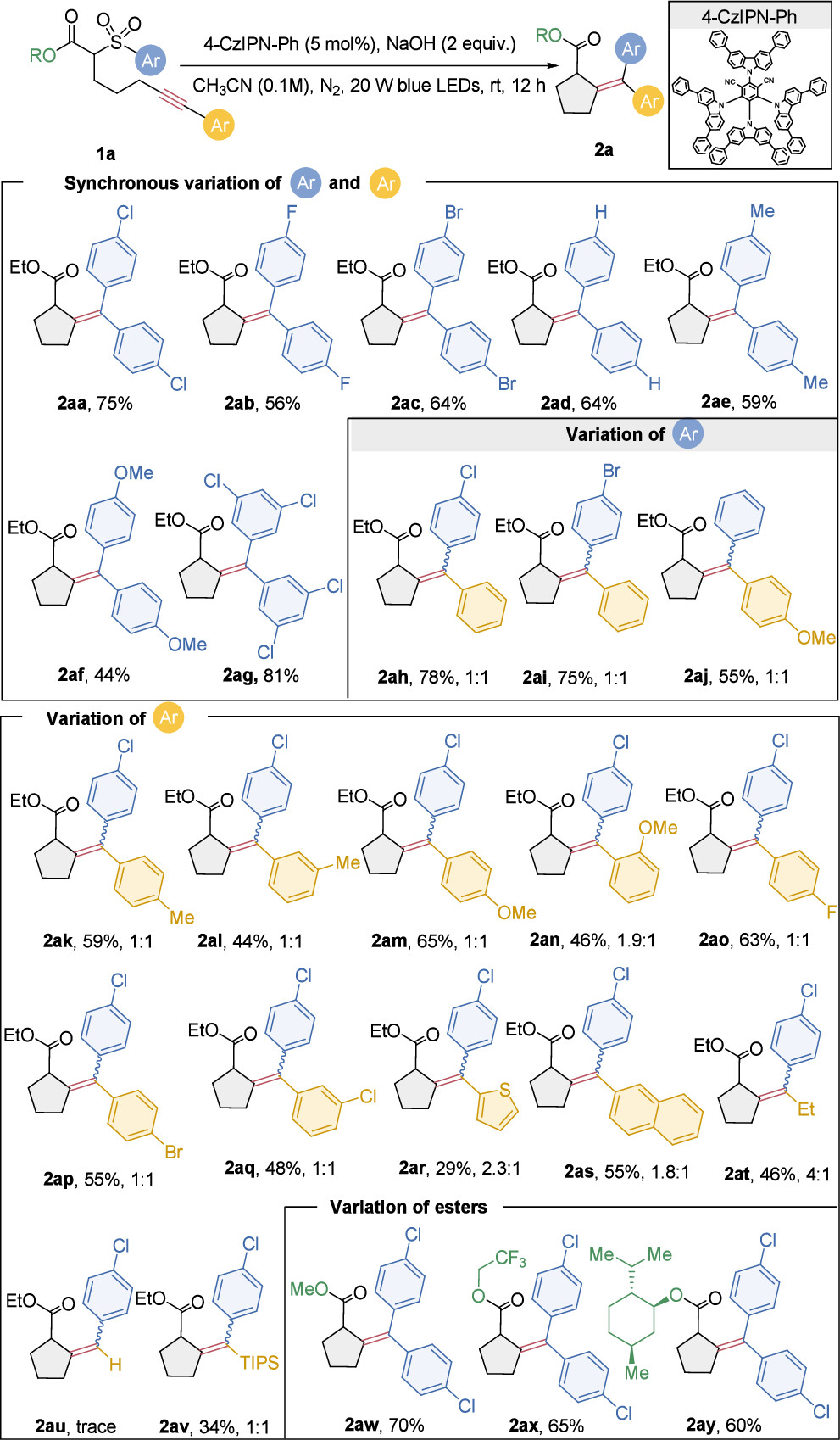
图2. 底物普适性考察(1)(来源:Org. Lett.)
此外,该合成策略的潜在应用价值通过调整炔部分结构得到了进一步展示(图3)。作者首先探讨了活性亚甲基与炔之间连接链长度变化的影响,成功实现了6-exo-dig环化/Smiles重排级联反应,以高产率合成了预期的六元环四取代烯烃(3aa−3af)。然而,尝试利用此策略合成更小或更大环尺寸的烯烃未获成功。此外,将炔的位置转移到酯基部分,并在调整后的反应条件下,成功制备了含有内酯结构的四取代烯烃产物5a和5b,产率中等。这些发现彰显了光氧化还原催化的自由基Conia-ene型环化/Smiles重排级联反应在构建复杂环状结构中的广泛底物适应性和潜力。
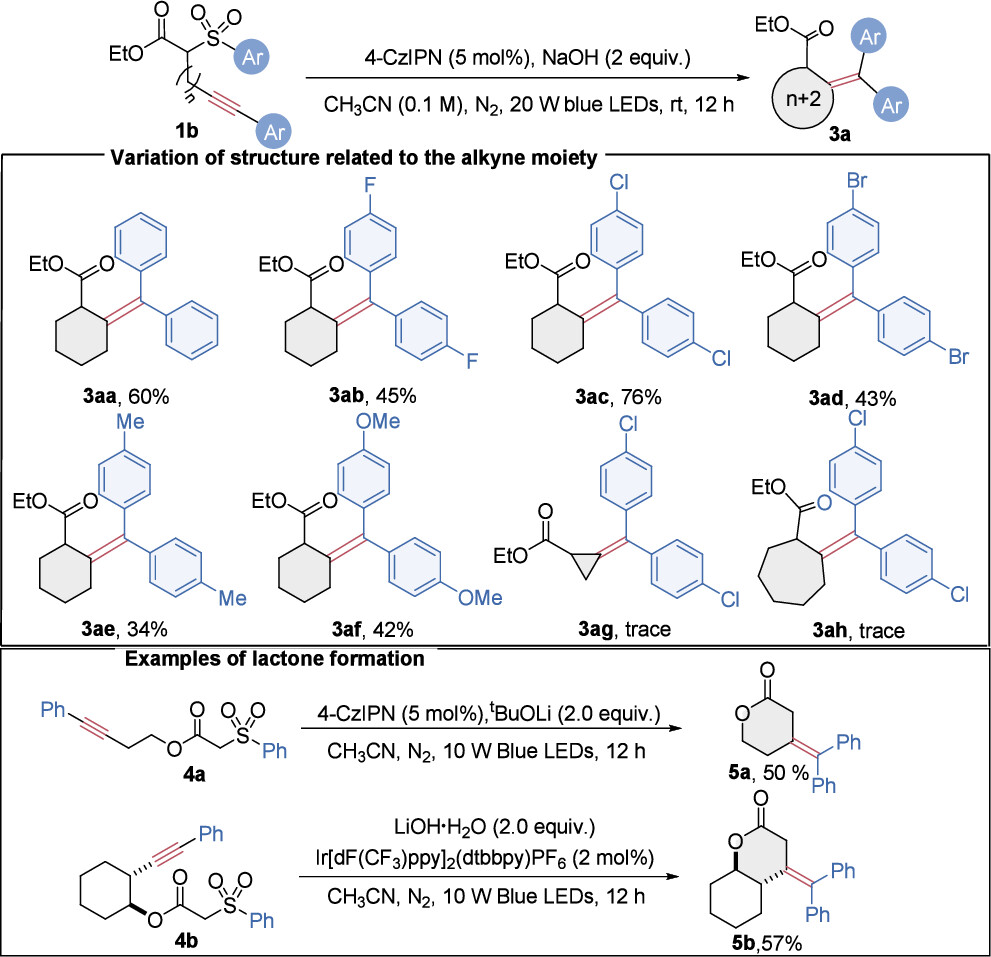
图3. 底物普适性考察(2)(来源:Org. Lett.)
无论起始底物是1as还是其异构体1as',该方法均能高效生成同一产物,且产率与选择性相近(图4A)。在此过程中,4-Cl-苯基的迁移率略高于萘基,这符合芳香环在Smiles重排反应中电子性质的影响规律。值得注意的是,α-磺酰基酯类底物1aa在多种传统Conia-ene反应条件下均未能实现有效环化,凸显了作者策略可以只用作经典Conia-ene反应的有效补充(见方案4B)。
为验证该策略的实用性,作者进行了放大实验,以62%的产率成功制备了产物2aa(图4C)。此外,通过一系列控制实验,作者初步揭示了级联反应的自由基机理。自由基捕获剂TEMPO的加入有效抑制了反应,支持了反应中自由基中间体的存在(图4D)。进一步的循环伏安法(CV)实验深入揭示了反应机理的关键细节。实验结果显示,在碱的辅助下,化合物1aa的氧化电位得到了显著的降低,这一变化使得光催化剂对1aa的氧化反应在热力学上变得更加有利,即反应更容易发生。这一发现与实验过程中观察到的现象高度一致:当1aa与碱混合时,它们能够更有效地猝灭激发态光催化剂的荧光(图4E),为深入理解反应机理提供了有力证据。
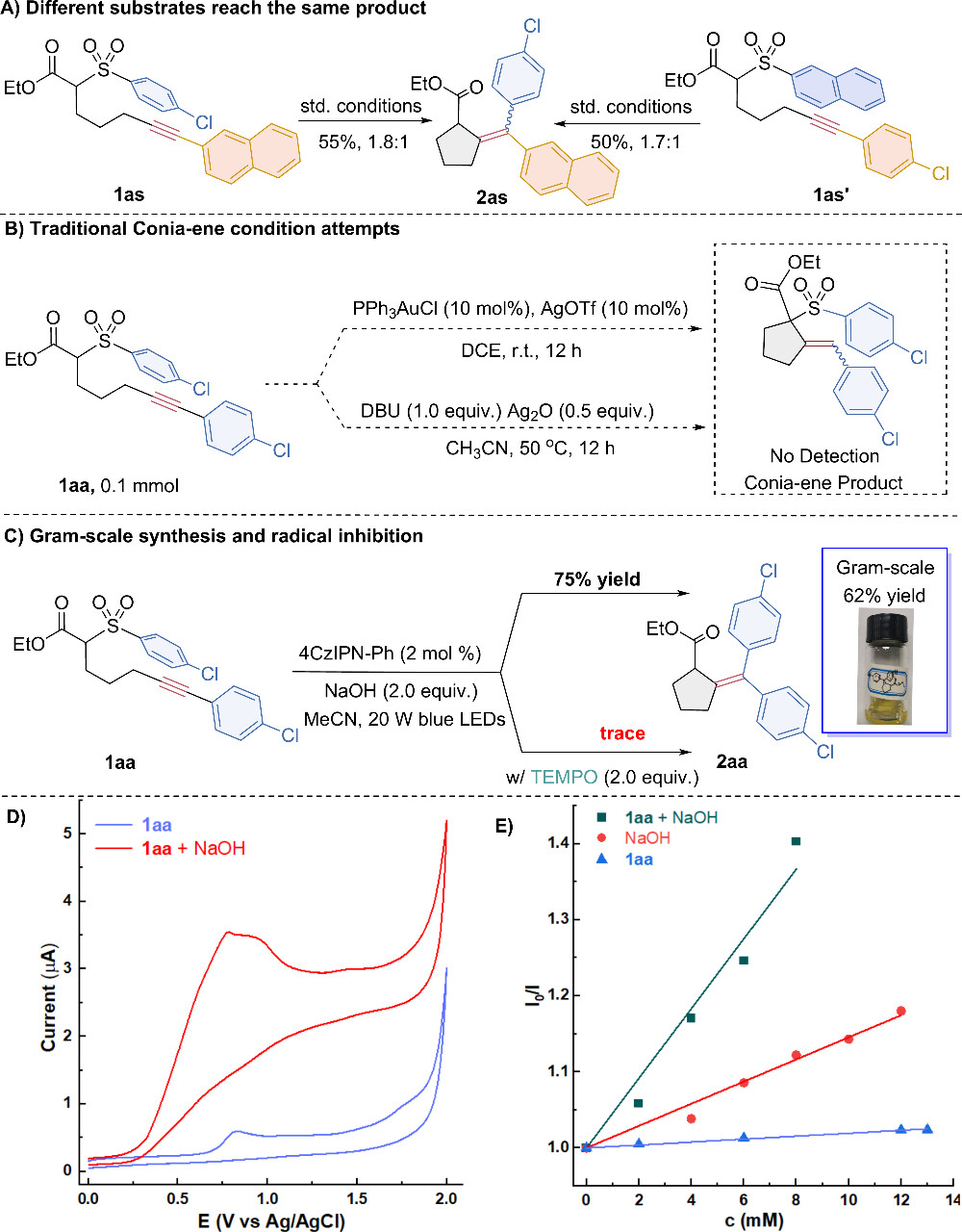
图4. 机理验证(来源:Org. Lett.)
根据以上实验结果和文献报道,作者提出了这种级联反应的可能机理(方案5)。首先,基态光催化剂被光激发到激发态,在NaOH的存在下1aa发生单电子转移(SET)得到碳中心自由基I。接着,通过分子内的5-exo-dig环化反应,生成乙烯基自由基II。该自由基随即与邻近的磺酰基苯环发生环化,形成螺环状的自由基III。最后,SO2的释放得到结构稳定的自由基IV,该自由基被还原态的光催化剂单电子还原并质子化得到最终产物2aa,完成催化循环。
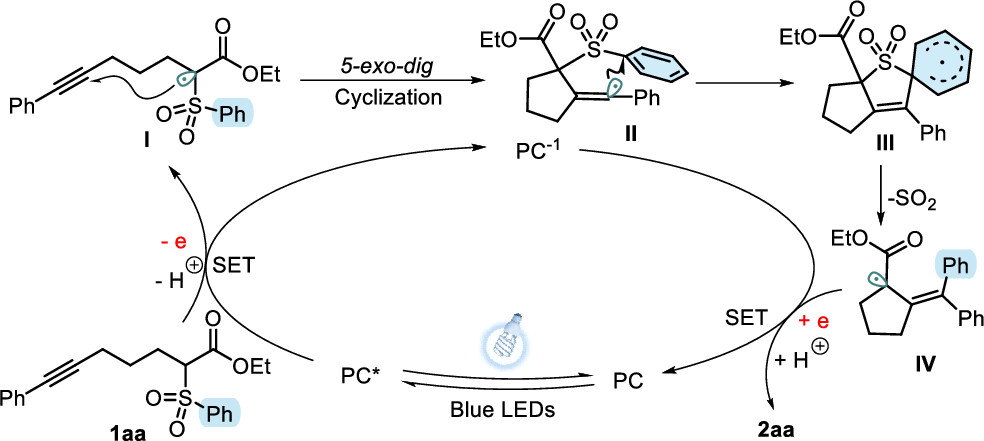
图5. 可能的反应机理(来源:Org. Lett.)
西安交通大学刘乐课题组实现了光催化条件下的Conia-ene型环化/ Smiles重排级联反应,为高效直接合成高附加值的环状四取代烯烃以及环状取代内酯类化合物提供了一种条件温和的新方法。该方法在传统的自由基Conia-ene型反应中引入芳基迁移机制,拓展了Conia-ene型环化反应的应用范围,也进一步拓展了自由基型的官能团迁移反应策略的应用场景。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




