印度加尔各答科学教育研究所ACS Catal.:光/镍催化酚与伯醇的交叉亲电偶联反应
导读
C(sp2)-C(sp3)键广泛存在于天然产物、药物和其它生物活性分子中。通常来讲,含有较高比例sp3杂化碳的化合物展现出多种增强的分子特性,包括溶解度、生物利用度和更有利的三维(3D)结构等,这些特性均有助于其在临床上取得成功。因此,使用简单易得的起始原料,发展新的烷基化方法将有助于推动药物研发的进程。最近,印度加尔各答科学教育研究所(Indian Institute of Science Education and Research Kolkata)Biplab Maji课题组发展了可见光光氧化还原/镍双催化体系,利用生物质衍生的,来源丰富的酚类和非活化的脂肪醇作为偶联配偶体,通过交叉亲电偶联反应实现了C(sp2)-C(sp3)键的构建。此转化具有良好的底物范围和官能团兼容性且可以实现规模化合成。值得注意的是,利用该方法还可以实现药物分子的后期官能团化,证明了此转化的实用性。相关成果发表在ACS Catal. 2024, 14, 14172-14182. 。
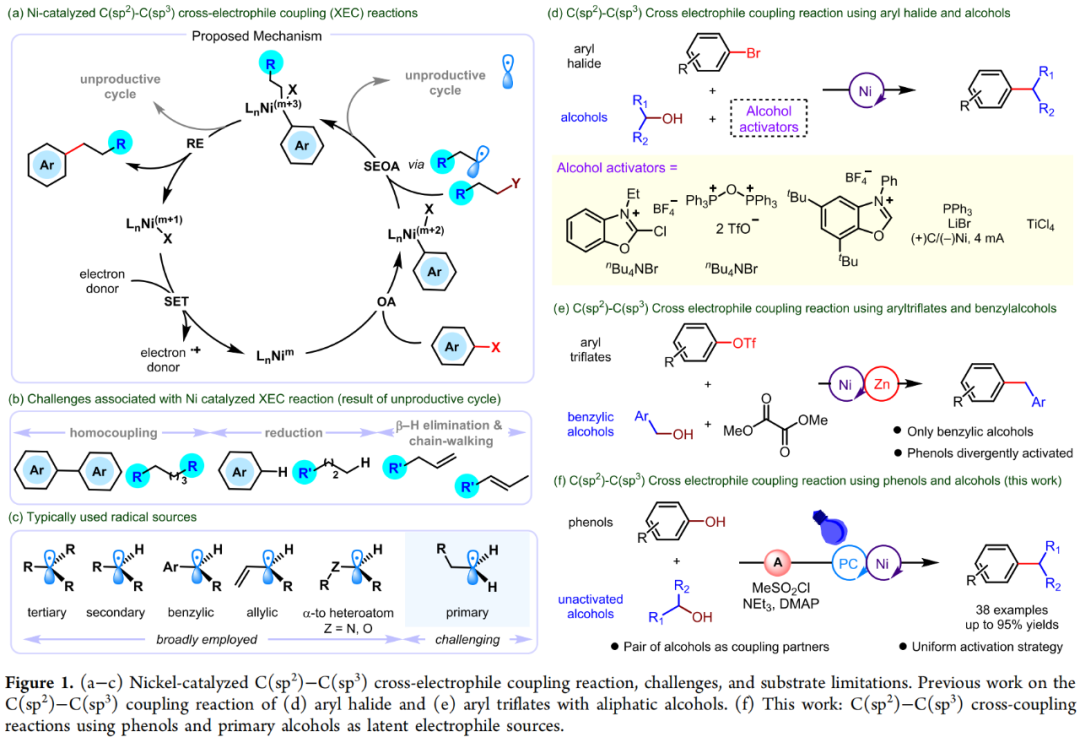
(Figure 1,来源:ACS Catal.)
成果
首先,作者以2-萘酚甲磺酸酯1和醇甲磺酸酯2作为模板底物对此转化进行了探索(Table 1)。经过一系列条件筛选,作者发现当使用1 (0.1 mmol), 2 (0.2 mmol), PC1 (1 mol %), NiCl2·glyme (10 mol %), NL1 (10 mol %), PL1 (10 mol %), ED1 (0.2 mmol), nBu4NBr (0.1 mmol), DBU (0.1 mmol), 在DMAc (0.4 M)中,427 nm蓝光照射下,30 °C, 氮气氛围下反应可以以89%的GC产率和85%的分离产率得到C(sp2)-C(sp3)偶联产物3(entry 1)。控制实验表明, 在不存在PC1、ED1以及光照的条件下反应是不发生的。
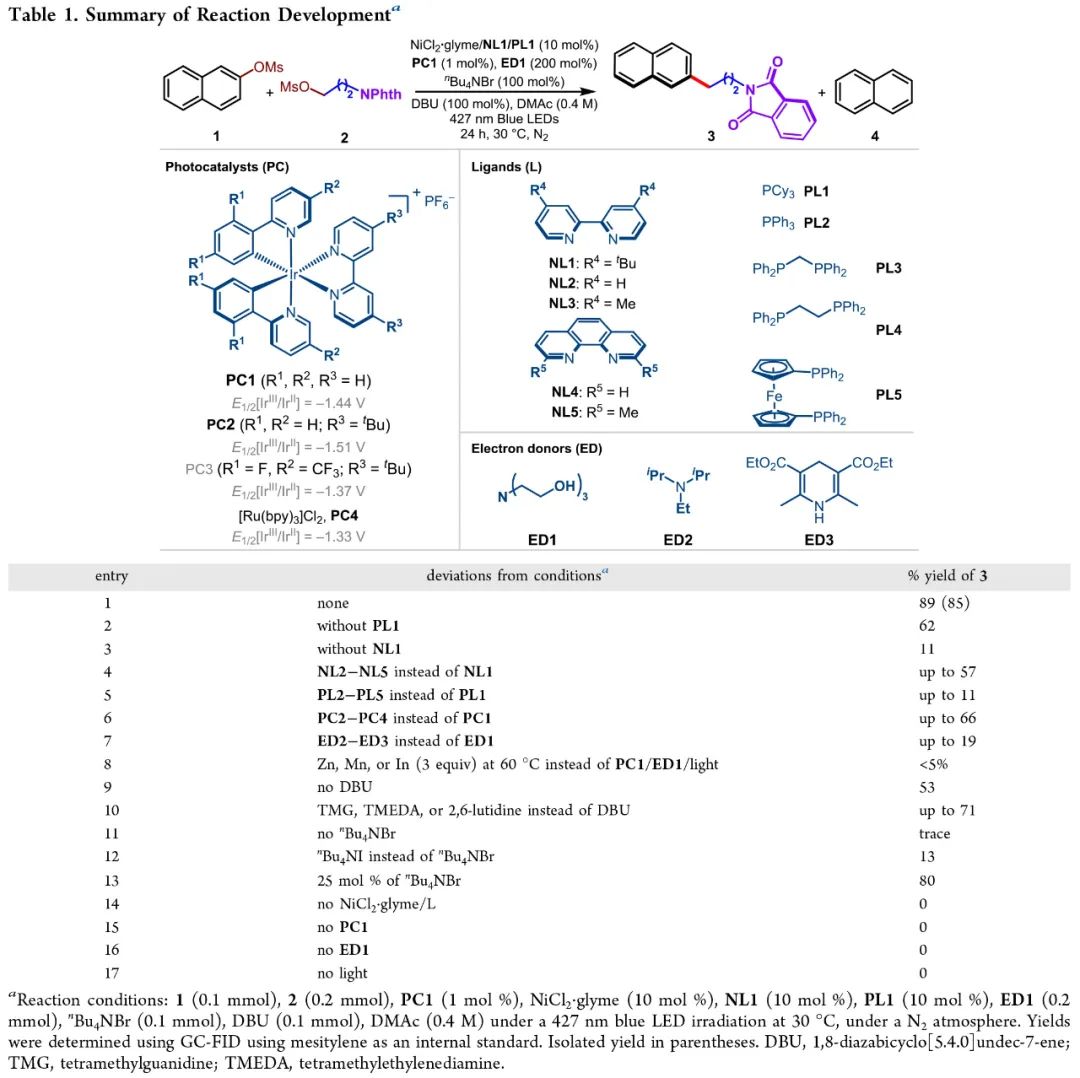
(Table 1,来源:ACS Catal.)
为了深入理解反应机理,作者进行了一系列控制实验(Figure 2)。通过Stern-Volmer实验,作者发现ED1以较高的速率(kq = 11.4 × 105 M-1 s-1)实现PC1的发光淬灭,验证了ED1在反应中作为末端还原剂的作用(Figure 2a)。烷基亲电试剂2和烷基溴2-Br不与激发的PC1相互作用,由此表明激发的PC1与2或2-Br之间没有发生单电子转移。此外,作者还发现了被1 (kq = 8.5 × 105 M-1 s-1)的发光淬灭。然而,循环伏安实验表明,电子从1(氧化电位= +1.9 V vs SCE)转移到激发的PC1(E1/2[IrIII*/IrII] = +1.22 V vs SCE)在热力学上是不可行的(Figure 2b)。在动力学监测过程中,作者观察到烷基甲磺酸酯2转化为2-Br,在整个反应过程中保持一个小且稳定的浓度(Figure 2c)。在2-Br的反应条件下,尽管消耗了90%以上的原料,但24 h后只产生了31%的3(Figure 2d)。虽然该实验证明了2-Br作为中间体参与了反应,但低产率表明在基元反应步骤中缺乏同步性。当在反应中加入自由基捕获剂TEMPO、BHT和DPE时,反应被抑制。且在加入TEMPO的反应中以70%的产率观察到了TEMPO加合物8。此实验表明反应中涉及烷基自由基中间体的生成(Figure 2e)。此外,自由基钟实验进一步证明了烷基自由基中间体的存在(Figure 2f)。最后,作者通过CV实验得出了反应中可能涉及NiI、NiII和NiIII物种(Figure 2g-2i)。
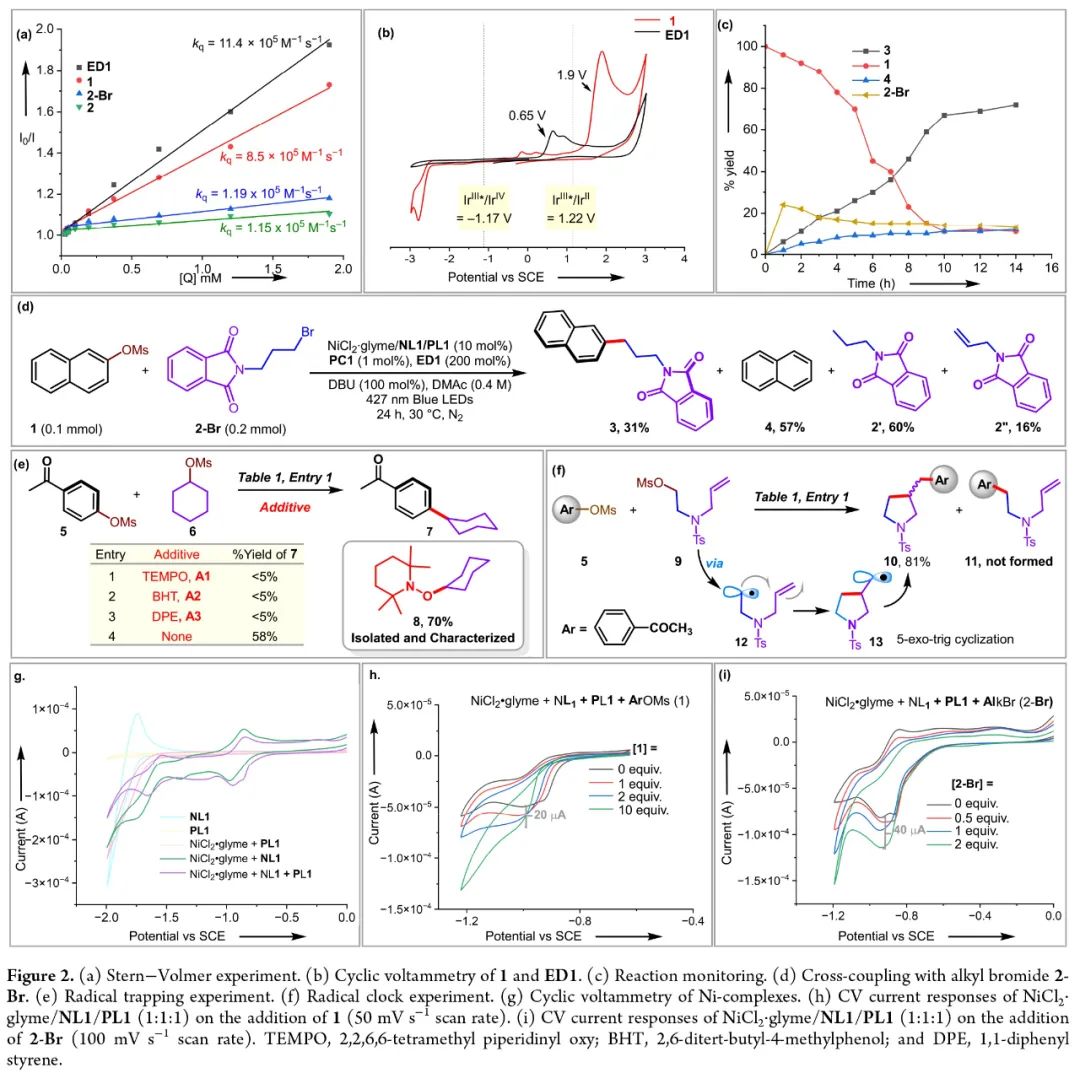
(Figure 2,来源:ACS Catal.)
基于上述实验结果,作者提出了可能的反应机理(Figure 3)。作者假设光氧化还原催化剂PC1在可见光照射下会被激发。有机电子给体ED1(E1/2 = +0.65 V vs SCE)可以还原淬灭激发态的光氧化还原催化剂PC*(E1/2[IrIII/IrII] = +1.22 V vs SCE)。所得的PC•-(E1/2[IrIII*/IrII] = -1.44 V vs SCE)可以将Ni(II)配合物还原为低价Ni(I) (E1/2[NiII/NiI] = -0.9 V vs SCE)。在此阶段,芳基甲磺酸酯1可以与Ni(I)进行氧化加成得到芳基镍(III)物种II,其可以通过光催化循环再经过一次SET反应生成镍(II)种III。同时,由2原位溴化生成的烷基溴2-Br可以与Ni(I)发生单电子转移形成烷基自由基IV,其可立即被中间体III捕获。最后,中间产物V通过还原消除得到C(sp2)-C(sp3)交叉偶联产物3并再生Ni(I)物种I。两个催化循环随后结合并完成催化循环,使该过程可以有效地继续进行。
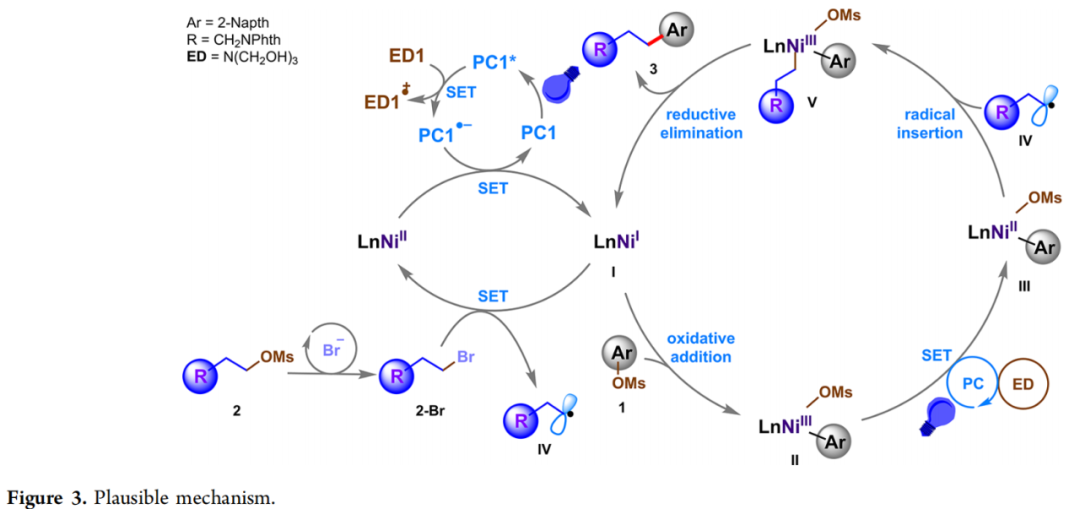
(Figure 3,来源:ACS Catal.)
接下来,作者对此转化的底物范围进行了探索(Figure 4)。实验结果表明此体系对于不同取代的芳基甲磺酸酯和烷基甲磺酸酯均具有良好的兼容性,以43-91%的产率得到相应的产物14-48。其中包括醛基、酮羰基、三氟甲基、烷氧基、全氟烷基、酯基以及杂芳环等均可兼容。值得注意的是,一系列生物活性分子衍生物如apocynin、vanilin、helional等也可以兼容,证明了此转化的实用性。
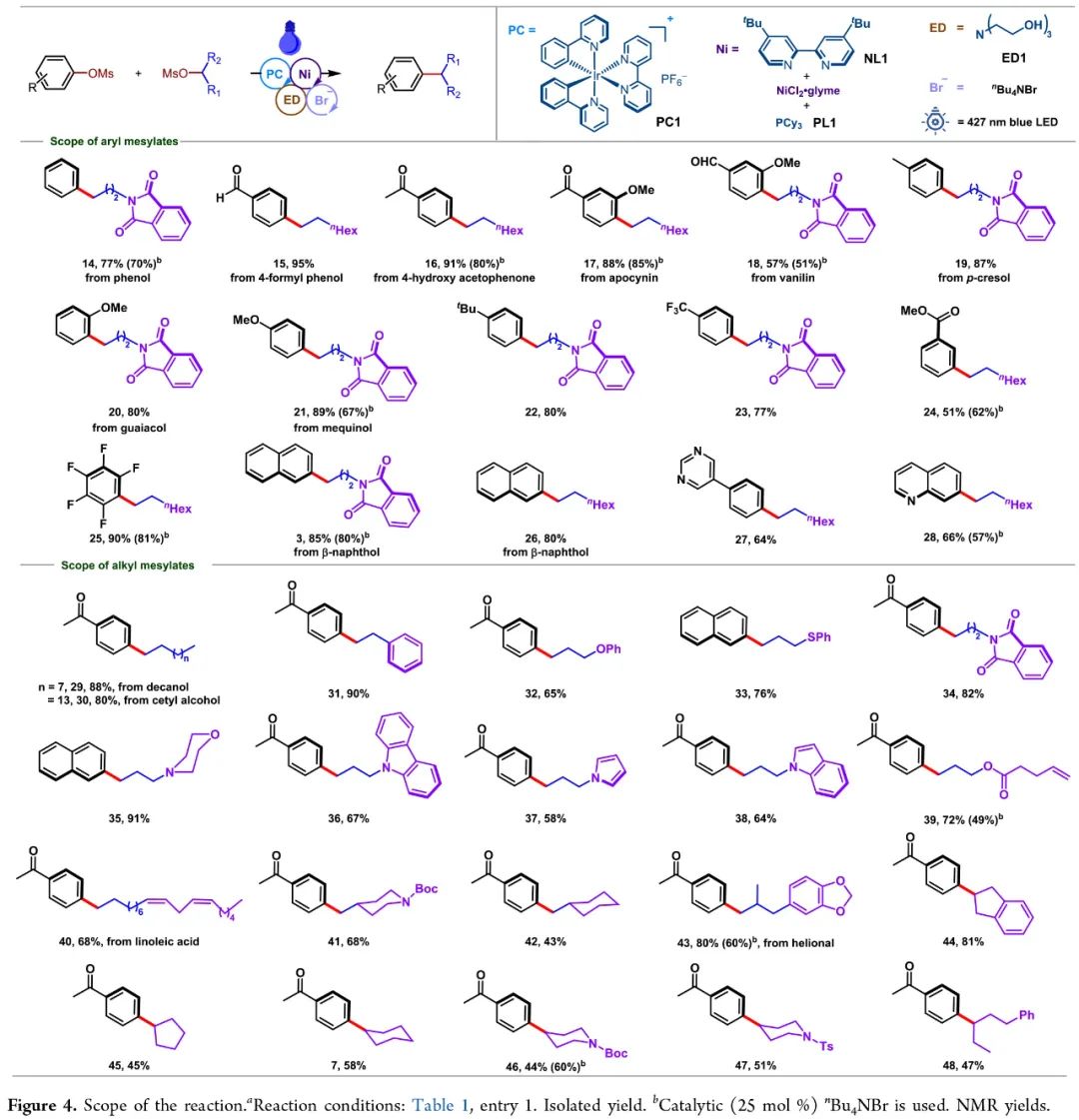
(Figure 4,来源:ACS Catal.)
为了进一步考察此转化的实用性,作者发现通过酚和醇的原位甲磺酰化和交叉亲点偶联串联,一锅法可以以66%的产率得到偶联产物3(Scheme 1a)。此外,当将此转化放大至5.0 mmol规模时,仍可以以81%的产率(1.2 g)得到产物3(Scheme 1b)。
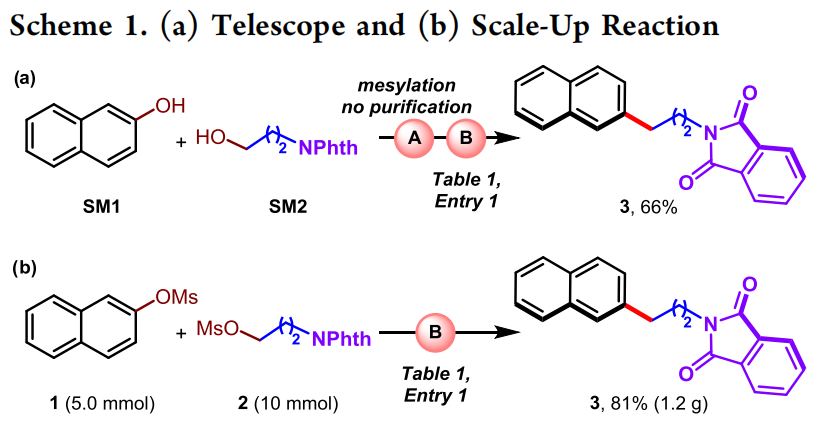
(Scheme 1,来源:ACS Catal.)
此外,作者还利用49实现了“可编辑”的双烷基化过程。49首先经历Weix所报道的烷基化过程与52反应,随后利用此策略与烷基甲磺酸酯2反应可以得到产物53。此外,49可以与苯硼酸50首先经历Suzuki偶联,随后在此反应条件下与2反应以两步70%的产率得到多官能团化产物51(Figure 5a)。作者还利用此策略合成了61,其是一种用于合成用于治疗耐多药结核病药物telacebec (Q203)的关键中间体,与现有合成方法相比大大缩短了合成步骤(Figure 5b)。
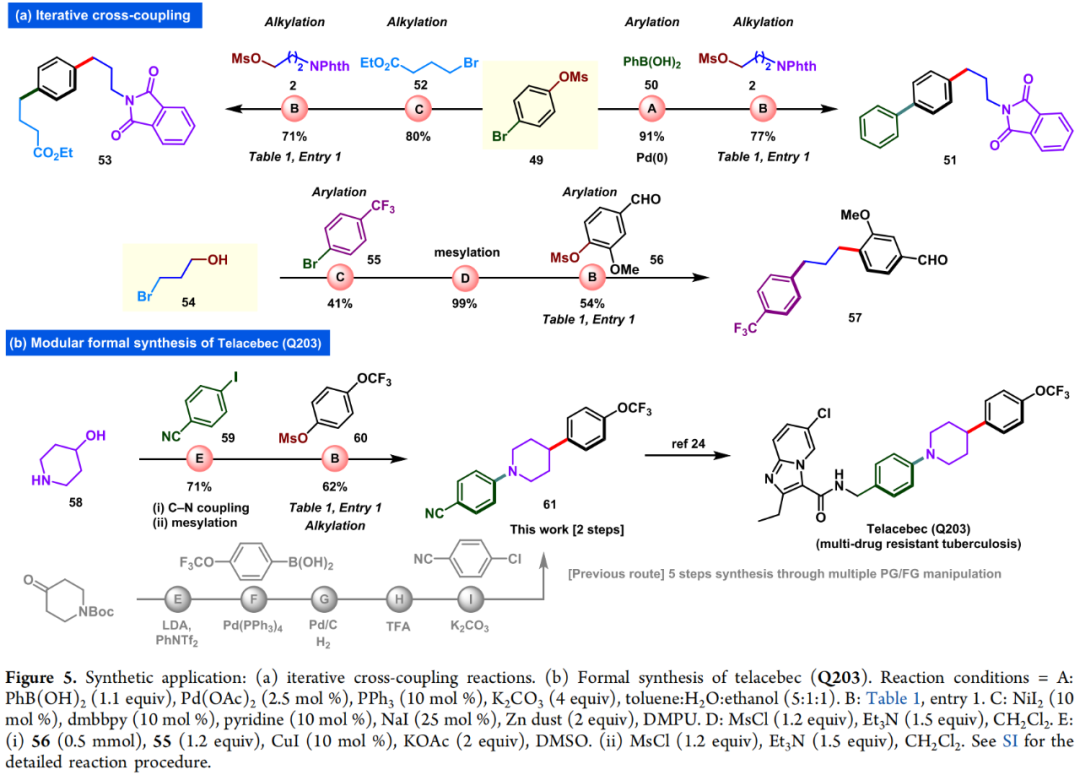
(Figure 5,来源:ACS Catal.)
总结
印度加尔各答科学教育研究所Biplab Maji课题组发展了光/镍双催化体系,实现了酚类和非活化的脂肪醇的交叉亲电偶联反应,实现了C(sp2)-C(sp3)键的构建。该反应具有良好的通用性,可兼容一系列非活化的伯醇、杂环、富电子和贫电子芳烃以及杂芳烃。克级规模合成以及分子的后期官能团化证明了该方法的实用性和效率。Telacebec中间体的高效合成突出了此反应在药物开发中减少合成步骤的应用潜力。此反应的发展为富含C(sp2)-C(sp3)骨架分子的合成提供了一种新的策略。
论文信息
Sayan K. Jana, Rayan Bhattacharya, Purusattam Dey, Sunit Chakraborty, Biplab Maji*. Photoredox/Nickel Dual Catalysis for C(sp2)–C(sp3) Cross-Electrophile Coupling Reaction of Mesylates of Phenols and Primary Alcohols, ACS Catal., 2024, https://doi.org/10.1021/acscatal.4c03975.
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





