南阳师范学院李亭/于永齐团队Adv. Synth. Catal.:可见光诱导下氮杂尿嘧啶的C−H硅基化反应
氮杂尿嘧啶是一类重要的杂环化合物,广泛存在于多种药物分子和天然产物中。通过对氮杂尿嘧啶进行结构修饰,可以调节其化学性质和生物活性。因此,开发有效的合成和修饰氮杂尿嘧啶的方法一直是有机合成领域的研究热点。传统上,氮杂尿嘧啶可以通过环化和交叉偶联反应制备。然而,这些方法通常具有一定的局限性,例如需要使用预官能团化的底物或苛刻的反应条件。因此,迫切需要发展高效合成官能化的氮杂尿嘧啶的方法。
直接C−H官能团化由于其步骤有效性和原子经济性,已成为一种广泛使用的修饰杂环的方法。最近几年,氮杂尿嘧啶直接C−H官能团化的反应相继被报道(Angew. Chem., Int. Ed. 2021, 60, 191−196; Org. Lett. 2023, 25, 8290−8295; Green Chem. 2023, 25, 5721–5726; ACS Catal. 2024, 14, 6247−6258; Green Chem. 2024, 26, 7331–7336)。尽管该领域取得了重要进展,但是目前的方法仅限于构筑C−C键和C−P键。据作者所知,通过氮杂尿嘧啶的直接C−H官能团化构筑C−Si键尚未实现。有机硅是一类非常重要的有机分子,在药物化学、材料科学和有机合成中有着广泛的应用。鉴于有机硅和氮杂尿嘧啶的重要性,发展高效合成硅基化的氮杂尿嘧啶的策略具有很高的合成价值。由于其绿色、高效和温和的特性,光催化在有机转化中起着重要作用。通过有机光氧化还原催化和氢原子转移催化的协同组合,氢硅烷可以很容易地转化生成硅基自由基。南阳师范学院李亭/于永齐团队近年来一直致力于有机硅化合物的合成反应研究(J. Org. Chem. 2023, 88, 14659−14669; Org. Lett. 2024, 26, 1143−1147; Org. Lett. 2024, 26, 5506–5510)。基于此,该团队以4CzIPN为光催化剂,以奎宁环为氢原子转移催化剂,以硅烷为硅源,实现了可见光诱导下氮杂尿嘧啶的C−H硅基化反应(图1)。
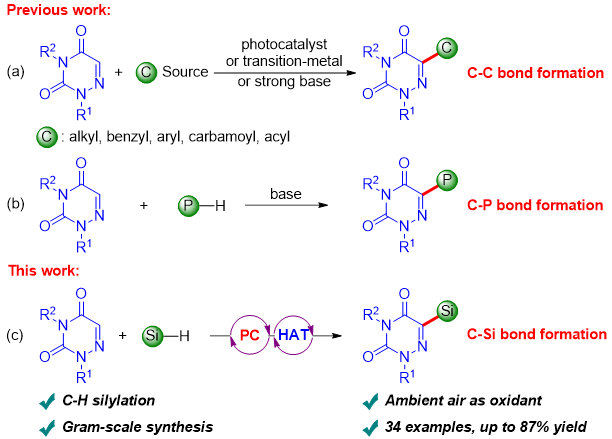
图1. 氮杂尿嘧啶的C−H官能团化方法(来源:Adv. Synth. Catal.)
作者首先以2,4-二苄基-1,2,4-三嗪-3,5(2H,4H)-二酮(1a)和叔丁基二甲基硅烷(2a)作为模板底物对反应条件进行了优化。通过对光催化剂、氢原子转移催化剂、碱、溶剂等条件进行筛选,最终确定了最优的反应条件:氮杂尿嘧啶1(0.20 mmol)、硅烷2(1.0 mmol)、4CzIPN (2.5 mol%)、奎宁环(40 mol%)在乙腈(3.0 mL)中于室温下在空气氛围中蓝光照射反应6小时。
确定了最优的反应条件以后,作者首先对氮杂尿嘧啶的底物范围进行了拓展(图2)。作者发现N2、N4上带有不同取代基(如苄基、乙氧羰甲基、烷基、烯丙基、炔丙基、酯基、羰基和萘基)的氮杂尿嘧啶均可顺利地参与反应,可以以62%-87%的产率得到目标产物3aa−3pa。值得指出的是,N2单取代(1q和1r)和N2/N4未取代(1s)的氮杂尿嘧啶也可以参与反应。此外,含有天然产物和药物骨架(如异龙脑、薄荷醇和布洛芬)的复杂分子,也与反应条件相兼容,可以以62%-81%的收率得到目标产物3ta−3va。受到这些结果的鼓舞,作者试图将底物范围扩展到其他杂环。令人满意的是,吡嗪酮、噌啉酮和色酮在标准条件下也可以成功地进行该硅基化反应。
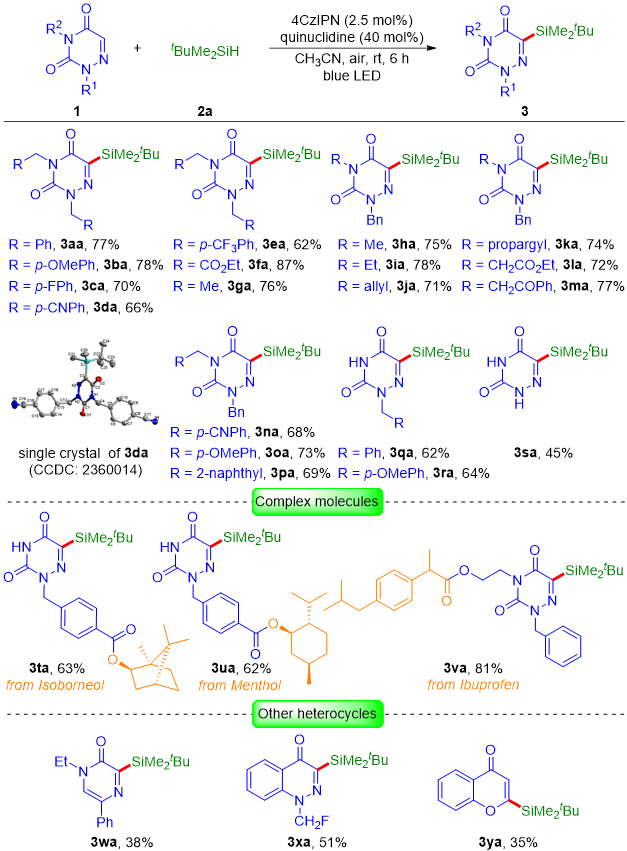
图2. 氮杂尿嘧啶的底物范围(来源:Adv. Synth. Catal.)
随后,作者还探索了硅烷的底物范围(图3)。三烷基硅烷和苯基取代的硅烷(如二甲基苯基硅烷2h、甲基二苯基硅烷2i、叔丁基二苯基硅烷2j和三苯基硅烷2e)均是合适的底物,可以以43%-81%的收率得到相应的硅基化产物。遗憾的是,当使用二苯基硅烷或苯基硅烷作为底物时,没有得到目标产物。
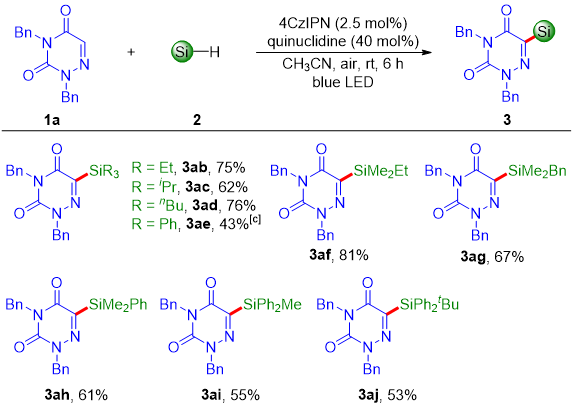
图3. 硅烷的底物范围(来源:Adv. Synth. Catal.)
为了证明该方法的可行性,作者开展了合成3aa的克级反应实验,发现仅用1.25 mol%的4CzIPN和20 mol%的奎宁环就能以60%的收率得到3aa(图4a)。此外,作者还开展了太阳光驱动的实验,以66%的收率得到了目标产物3aa(图4b)。最后,为了展示该方法的综合潜力和实用性,作者对产物进行了转化。其中,用间氯过氧苯甲酸(m-CPBA)处理产物3ja,可以以68%的收率得到环氧化产物4(图4c)。此外,通过铜催化的点击反应,3ka可以很容易地转化为相应的三唑5,产率为81%(图4d)。

图4. 合成应用(来源:Adv. Synth. Catal.)
为了更好地理解该反应的机理,作者进行了几个对照实验。首先,当在标准条件下向反应混合物中加入自由基捕获剂2,2,6,6-四甲基哌啶氧化物(TEMPO)或1,1-二苯乙烯(DPE)时,反应被完全抑制,相应的自由基加合物6或7可以通过高分辨质谱(HRMS)检测到,这说明硅基自由基可能是反应的关键中间体(图5a)。接下来,作者进行了开关灯实验,发现3aa只能在连续光照下才能生成,这排除了链式机制的可能性(图5b)。
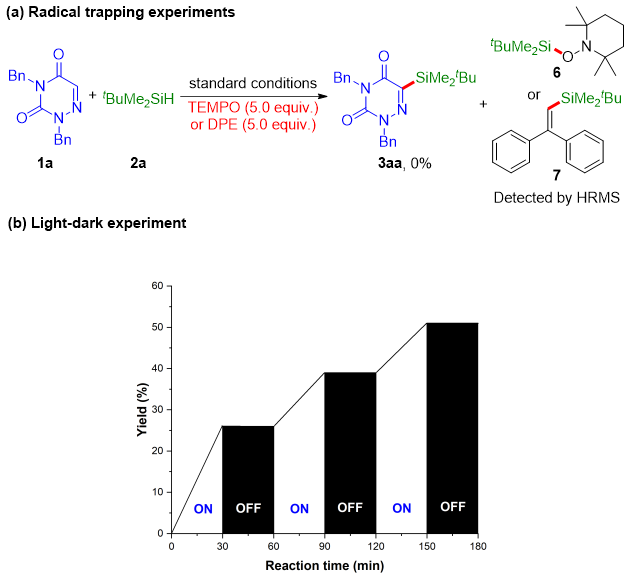
图5. 机理探究实验(来源:Adv. Synth. Catal.)
基于上述实验结果和以前的文献报道,作者提出了一种可能的反应机理(图6)。首先,光催化剂4CzIPN在蓝光的照射下转化为激发态4CzIPN*,该激发态被奎宁环淬灭,得到奎宁环自由基阳离子中间体A和4CzIPN•−。然后,4CzIPN•−在氧气的作用下再生4CzIPN。接下来,A从硅烷2中夺取一个氢原子,得到奎宁环阳离子B和硅基自由基C,后者与底物1结合生成自由基中间体D。中间体D经历1,2-氢原子转移,得到自由基中间体E。最后,中间体E与O2•−发生氢原子转移,得到目标产物3。
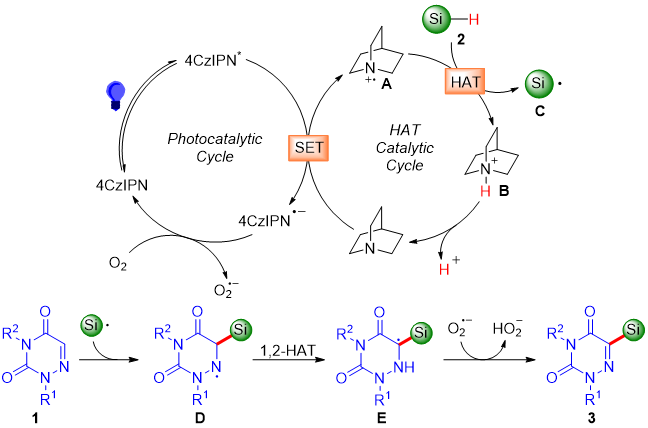
图6. 可能的反应机理(来源:Adv. Synth. Catal.)
总之,作者通过可见光诱导的氮杂尿嘧啶和氢硅烷之间的偶联,实现了氮杂尿嘧啶的C−H硅基化。通过有机光氧化还原催化和氢原子转移催化的协同组合,可以以43%-87%的收率合成一系列硅基化的氮杂尿嘧啶。该反应的优点包括反应条件温和、操作步骤简单以及使用空气作为氧化剂,具有广泛的应用前景。
Visible-Light-Induced C−H Silylation of Azauracils with Hydrosilanes
Yongqi Yu,* Mengdan You, Jiajia Yu, Weiguang Kong, Chunyan Zhang, Jinjin Bai, Wenguang Li,* Ting Li*
Adv. Synth. Catal. 2024
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





