阿姆斯特丹大学Timothy Noel课题组:流动条件下通过金属光催化实现芳基溴化物与低碳烷烃的C1 - 4烷基化反应
导读
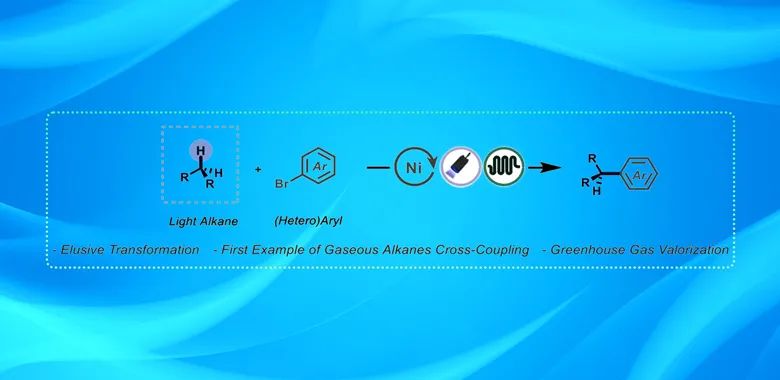
气态 C1-4 烷烃的同族系列是短烷基片段最丰富的来源之一。然而,它们在合成有机化学中的应用却极为罕见,这是因为 C-H 键的裂解具有挑战性,通常需要高温高压,从而限制了它们在构建复杂有机分子中的应用。尤其是 C(sp2)-C(sp3) 键的形成对于构建生物活性分子(包括药物和农用化学品)至关重要。近日,阿姆斯特丹大学(University of Amsterdam)的Timothy Noel课题组通过氢原子转移(HAT)光催化和镍催化交叉偶联,在室温下实现了气态烷烃和(杂)芳基溴化物之间的偶联。利用流动技术,作者可以在更短的反应时间内用可扩展的方式进行这种新型偶联反应,从而使其在学术界和工业界得到广泛应用。密度泛函理论(DFT)计算揭示了氧化加成是决定速率的步骤,活化能垒随着烷基的变小而增大。此外,在丙烷和丁烷类似物中观察到的自由基异构化现象可归因于溴芳烃偶联剂的电子特性,从而突出了氧化加成在观察到的这种转化的选择性中的关键作用。相关研究成果发表在Angew. Chem. Int. Ed.上。
成果
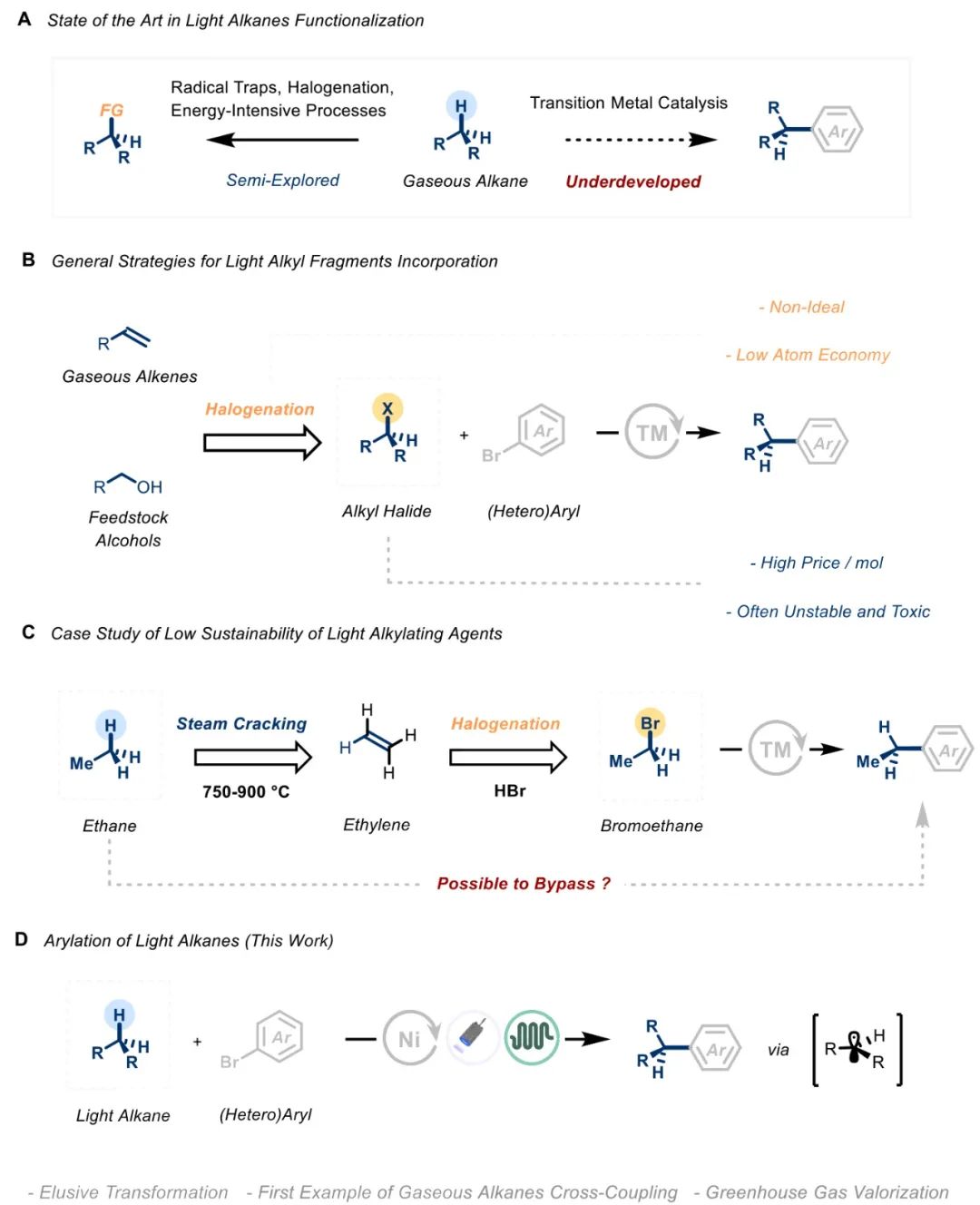
近年来,将烷烃转化为精细化学品的研究引起了极大的关注,人们希望在有机分子中引入 sp3 特性,从而提高其功效并降低损耗率。此外,直接活化脂肪族 C-H 键可绕过功能化分子的使用,用于药物等后期改性。气态碳氢化合物经济适用,但其 C-H 键惰性极强,因此将其转化为功能化衍生物的传统合成方法往往无效或缺乏选择性(Scheme 1A)。在现代合成化学中,芳基化反应是组装相关的构筑基块不可或缺的工具。因此,过渡金属催化的交叉偶联是组装此类单元的黄金标准,通常结合预官能化的起始材料。但预官能化片段存在原子经济性低、毒性高以及不稳定等缺点。在工业制备中主要是用氢卤酸卤化相应的烯烃或转化相应的醇(Scheme 1B)。通过传统的交叉偶联引入乙基单元,表观的C2合成子是溴乙烷或由其衍生的物种。溴乙烷来源于乙烯的溴氢化作用,而后者来源于乙烷的高能耗蒸汽裂解(Scheme1C )。
(图片来源:Angew. Chem. Int. Ed.)
目前,在过渡金属催化中利用气态烷烃作为烷化剂的方法并没有取得重大进展。因此,作者旨在开发一种实用的催化方法来实现轻烃的 C(sp3)-H 芳基化,为纳入低碳烷基片段提供合成策略(Scheme 1D)。具体来说,作者设想将光诱导氢原子转移 (HAT)、镍催化和连续流反应条件结合起来,实现 C(sp2)-C(sp3) 交叉偶联平台。作者建议利用流动技术来解决气液传质和处理气态试剂的安全问题。并整合高强度光源和微型毛细管反应器,确保方案的实用性和可扩展性。最后,通过密度泛函理论(DFT)计算,确定氧化加成步骤为最具挑战性的环节。
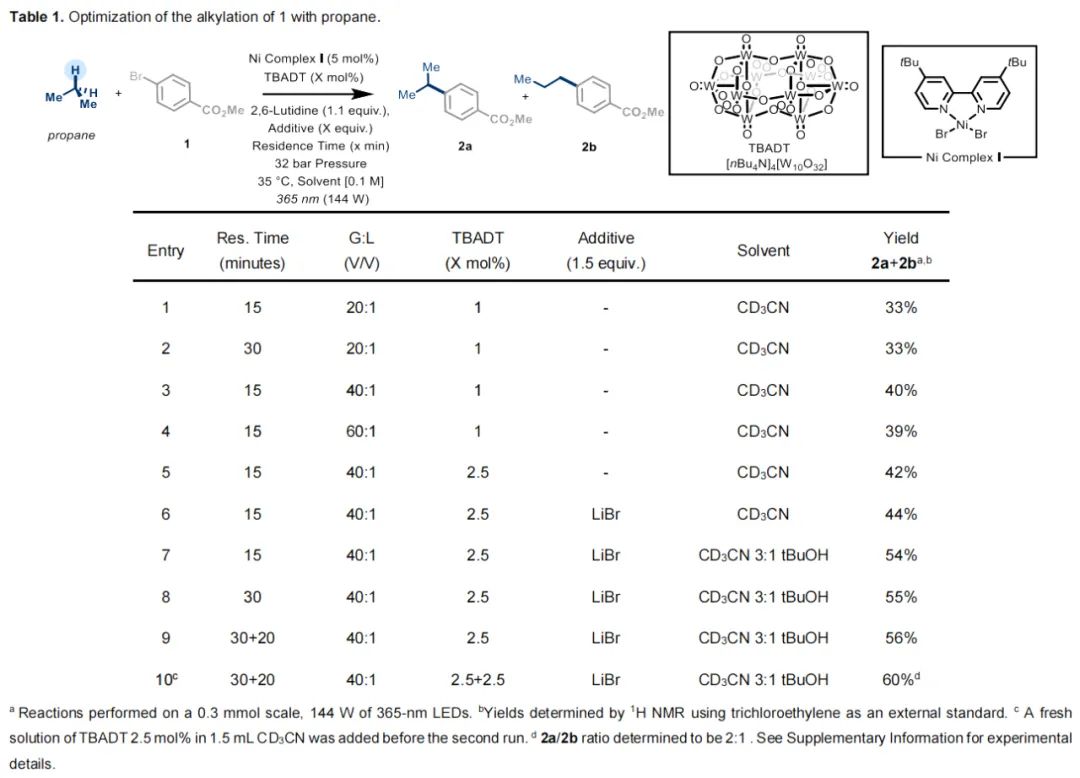
首先,从芳基溴化物 1 与丙烷的反应开始进行优化(Table1)。采用镍复合物 I 和癸钨酸四丁基铵 (TBADT) 的协同作为氢原子转移光催化剂,CD3CN 作为溶剂。气液比 (G:L)为20 : 1 (8 equiv),2,6 -二甲基吡啶用于淬灭反应过程中的氢溴酸。将溶液导入连续流微反应器 (ID = 0.5 mm ; 5 mL) 中,用UV - A光 (片上LED , λ=365 nm;光功率144 W) 照射。压力 32 bar,停留时间 15 分钟(entry 1),可检测到产物2的形成,其区域异构体混合物为1.2:1 (2a:2b)。延长停留时间至 30 分钟(entry 2)并没有产生积极影响。将 G:L 比例提高到 40:1 (16 equiv)和 60:1 (24 equiv) (entries 3和4)后,产量提高到 40%。将 TBADT 的添加量提高到 2.5 mol%(entry 5)后,化学效率进一步提高。对镍催化剂的配体进行了筛选,其中4,4′-二叔丁基-2,2′-二吡啶活性卓越。对反应添加剂和混合溶剂进行评估,其中LiBr 和 tBuOH 有积极影响(entries 6和7)。虽然延长时间的效果并不显著(entries 8和9),但在再循环步骤之前引入新鲜的 TBADT 溶液,可以得到所需的化合物 2,收率为 60%,异构体混合物的比例为 2:1(2a:2b)。
(图片来源:Angew. Chem. Int. Ed.)
在确定反应条件并优化了光化学反应器的设计后,作者在流动反应器平台上探索了低碳烷烃与芳基溴化物的 C(sp3)-H(杂)芳基化反应的范围和通用性(Scheme 2)。利用流动技术和背压调节器可以无缝执行这些反应,而无需重新优化反应条件(Scheme 2)。各种气态烷烃(丁烷、丙烷、乙烷、甲烷)可与芳基溴化物高效偶联。制药相关的杂芳基溴化物,如吡啶、嘧啶、苯并噻唑和氮杂吲哚,都可烷基化。此外,与气态烷烃相比,薄荷醇酯衍生物也可以进行烷基化,合成收率较高(15和24,收率为 32-50%)。研究结果表明,正丁烷和丙烷产率为中等到良好。乙烷和甲烷产率较低但具合成价值。带有强电子捐赠基团的芳基溴化物不能发生所需的反应。

(图片来源:Angew. Chem. Int. Ed.)
随着 C-H 裂解的键解离能 (BDE) 增加,偶联反应的效率降低。此外,对于丙烷和丁烷这两种偶联物,镍捕获自由基时的选择性会下降(Scheme 2)。为解释上述趋势,并进一步了解芳基溴化物与气态烷烃的金属光催化交叉偶合的机理原理,作者进行了详细的 DFT 计算研究。具体来说,作者以环己烷为底物进行了平行动力学同位素效应(KIE)研究(Scheme 3A)。作者观察到环己烷与其氚化底物之间的反应速率差异微乎其微,表明HAT 过程并不参与速率决定步骤(RDS)。作者利用DFT 计算方法研究了气态烷烃与各种烷基自由基的反应趋势(Scheme 3B)。反应开始时,气态烷烃和光激发的癸钨酸盐阴离子(*[W10O32]4-)通过 HAT 过程生成烷基自由基,随后与 Ni(0) 物种 Int1 配位,生成稳定的 Ni(I) 中间体 Int2-R。反过来,Ni(I) 通过过渡态 TS1-R 与芳基卤化物发生氧化加成反应,形成 Ni(III) 中间体,然后通过烷基自由基解离生成 Ni(II) 中间体 Int4。在发生自由基再配位时,Ni(III) 中间体经过渡态 TS2-R 的还原消去作用,为形成 C(sp2)-C(sp3)键创造了条件。最终的 Ni(I)-Br 中间体 Int6 再生为 Int2-R。

(图片来源:Angew. Chem. Int. Ed.)
为了更深入地了解各种自由基反应性差异的根源,作者转向活化应变模型(ASM)和能量分解分析(EDA),重点分析了决定速率的氧化加成步骤(Scheme 3C)。ASM 将电子能 ΔE分解为应变能 ΔEstrain 和相互作用能 ΔEint [公式 1]。EDA 将相互作用能 (ΔEint)分解为:ΔVelstat、ΔEpauli、ΔEoi以及ΔEdisp[公式 2]。
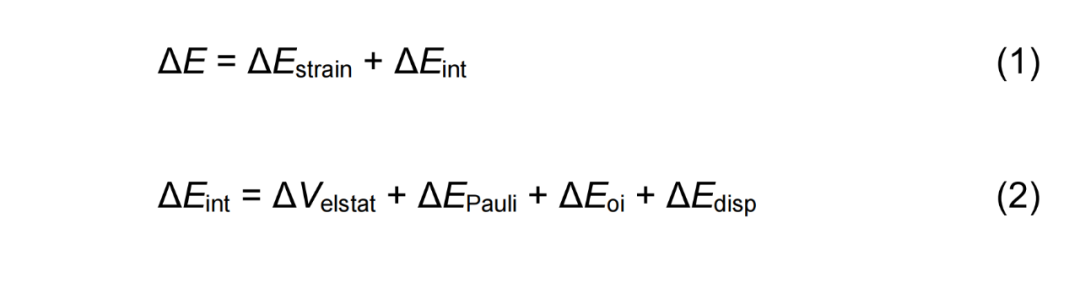
(图片来源:Angew. Chem. Int. Ed.)
甲基自由基的氧化加成反应的反应势垒最高(ΔG‡ = 14.3 kcal mol-1),随着自由基取代基数的增加,能量随之降低。反应活性的差异源于相互作用能的差异,而应变能几乎相同。甲基自由基的活化势垒较高,是因其稳定作用能较低(ΔEint = -25.2 kcal mol-1),而 iPr 自由基的活化势垒较低,是因其稳定作用能较高(ΔEint = -31.4 kcal mol-1)。利用EDA 方法,这种趋势源于静电相互作用(ΔVelstat)和轨道相互作用(ΔEoi)的差异。
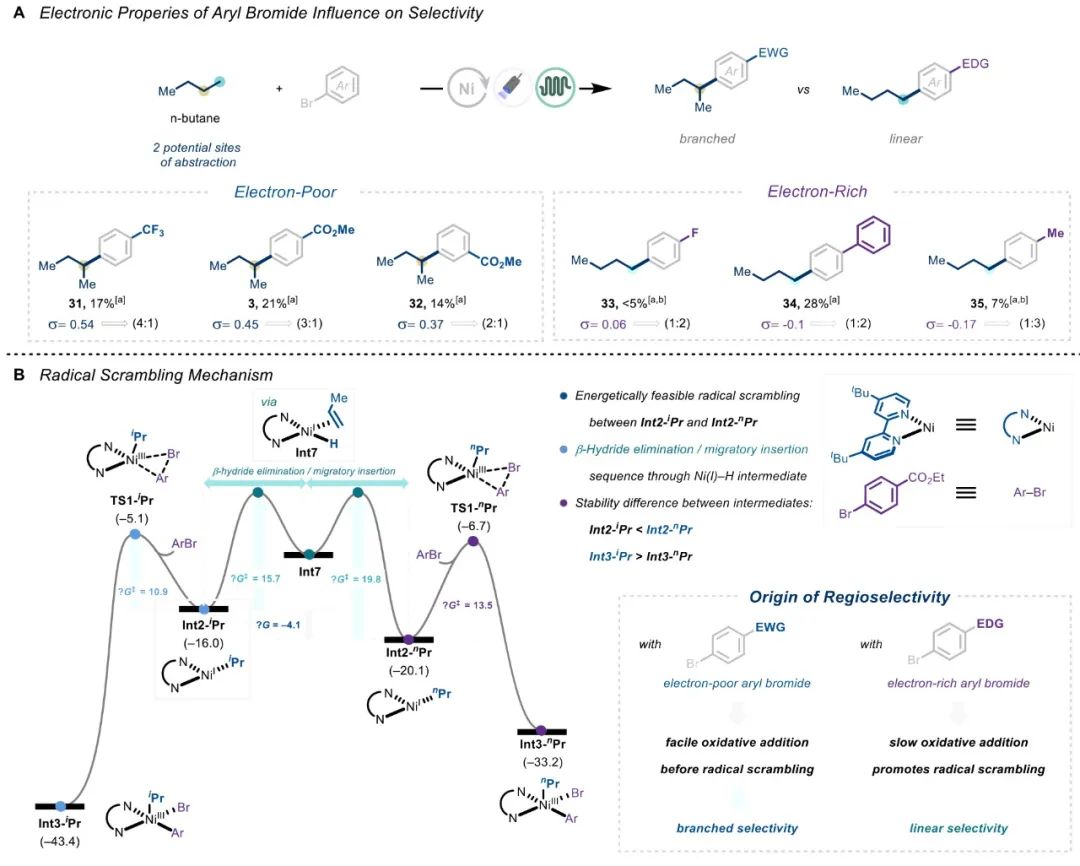
在与丙烷和丁烷的偶联反应中,作者观察到了自由基捕获对选择性的侵蚀,选择性受到芳基溴化物偶联物的影响(Scheme 4A)。当使用贫电子芳基溴化物时,支链烷基化是主要路径,而使用富电子芳基溴化物时,线性路径成为主导路径。为阐明这种区域选择性的来源,作者再次使用 DFT 计算(Scheme 4B)。异构化过程的能垒在能量上是可行的,且与氧化加成的能垒相似。说明氧化加成步骤决定了反应速率和选择性。贫电子芳基溴化物可先进行氧化加成反应,因此支化选择性在反应中占主导地位。富电子芳基溴化物因能垒增加,更易发生自由基扰乱,从而提供线性选择性。
(图片来源:Angew. Chem. Int. Ed.)
总结在此,作者首次展示了一种通过氢原子转移光催化和镍催化相结合的方法在(杂)芳基溴化物和气态烷烃之间进行交叉偶联的实用策略。流动技术的使用在精确控制反应条件、方便优化反应、快速扩大范围和无缝扩展性方面起到了关键作用。通过 DFT 研究,作者了解了独特实验观察结果的来源,并将氧化加成确定为决定速率和选择性的步骤。此外,这种综合方法还为今后在各种偶联反应中利用气态烷烃作为反应物提供了发展框架。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





