【ACS Catalysis】华中科技大学袁伟明课题组:光/镍协同催化烯基卤化物与α-硅胺交叉偶联合成烯丙基三级烷基胺
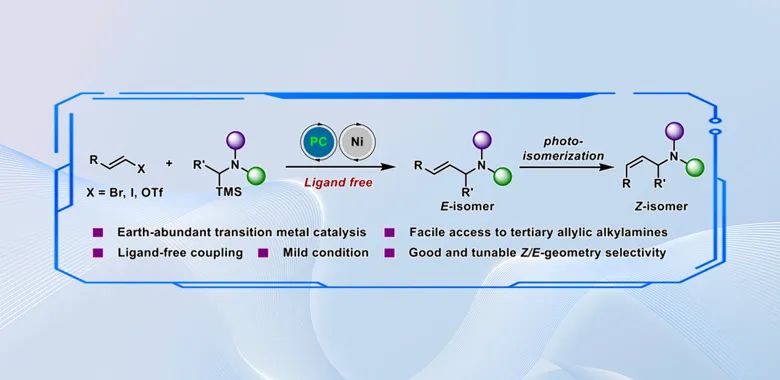
烯丙基烷基胺的合成一直受到化学家们的广泛关注,这不仅是因为其结构本身具有独特的生物活性,还因为其在有机合成中作为多功能中间体可以进行丰富的化学转化。烯丙基三级烷基胺骨架的生理特性及其抗菌、抗癌活性使其成为非常有效的药效基团。图1为含有烯丙基三级烷基胺的代表性药物分子。
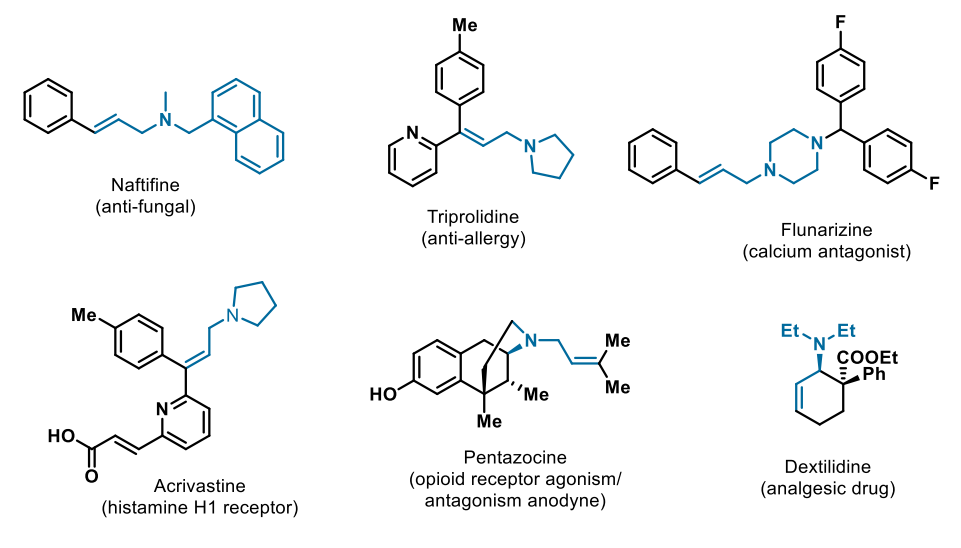
图1. 含有烯丙基三级烷基胺的代表性药物分子(来源:ACS Catalysis)
尽管烯丙基胺的合成方法报道很多,但大多数局限在N-保护的烯丙基胺,即N原子上至少连有一个吸电子基团如Ac、Boc等,而全烷基取代烯丙基胺的合成仍然存在一定挑战(图2)。由于二级脂肪胺的强路易斯碱性,容易与金属中心配位导致催化剂中毒,使得经典的Tsuji-Trost烯丙基胺化反应难以适用于二级脂肪胺底物。2022年,M. C. White和华南理工大学江焕峰课题组分别通过设计胺-BF3复合物缓慢释放二级脂肪胺策略以及通过发展高效的钯/膦配体/醌氧化剂的催化组合,成功实现了钯催化二级脂肪胺参与的烯丙基C‒H氨化反应合成烯丙基三级烷基胺。为了避免经典的Pd (0/II) 催化中Pd-胺配位失活问题,Gevorgyan课题组报导了通过可见光诱导的Pd(0/I/II)单电子转移途径,实现了一级和二级脂肪胺参与的烯丙基C‒H氨化反应。与上述通过链接C‒N键合成烯丙基烷基胺的方法不同,中科大黄汉民课题组设计了一种极性反转策略,通过钯催化烯烃与缩醛胺的Heck型氨甲基化可以有效合成烯丙基三级烷基胺。这种涉及氨基甲基环钯中间体的C‒C键形成方法为避免钯催化剂失活提供了一种有效的替代方案。近年来,通过光/电催化自由基途径合成烯丙基胺成为一种高效的手段。Ritter等人首次报道了通过光催化氮自由基阳离子与烯烃加成途径启动的烯丙基C‒H氨化,但这种策略不适用于构建烯丙基三级烷基胺。Wickens课题组通过电化学手段合成了热力学不稳定的Z-选择性烯丙基三级烷基胺。近期,武汉大学雷爱文课题组和南方科技大学舒伟课题组分别报道了光/钴协同催化无外加氧化剂条件下的脱氢烯丙基C‒H氨化制备烯丙基三级烷基胺的工作。此外,通过α-氨基自由基对烯烃加成/消除策略也可以构建烯丙基胺,但是该方法仅限于合成N-Boc或N-Ar胺,这主要是因为全烷基取代的α-氨基自由基介导的反应面临以下挑战:1)很难精确控制叔烷基胺的单电子氧化生成位点专一的N-烷基取代α-氨基自由基,反应面临复杂的位点选择性控制问题;2)由于生成的α-氨基自由基氧化电位相比原料更低,因此容易进一步被氧化生成亚胺中间体从而失去自由基的性质。为了解决这一问题,华中科技大学袁伟明课题组利用α-硅基取代叔烷基胺具有更低的氧化电位以及位点专一性脱硅的性质,可以很好地解决上述面临的挑战。基于该课题组前期在可见光催化有机胺合成方面的工作基础(J. Am. Chem. Soc. 2022, 144, 17776; J. Am. Chem. Soc. 2023, 145, 23385; Angew. Chem. Int. Ed. 2020, 59, 17910; Angew. Chem. Int. Ed. 2022, 61, e202114731; Angew. Chem. Int. Ed. 2024, 63, e2023143; Chem. Sci. 2023, 14, 1485; Chem. Catal. 2023, 3, 100605;ACS Catal. 2024, 14, 8505),本研究中作者发展了一种可见光/Ni协同催化烯基卤化物与α-硅胺的C‒C键交叉偶联反应,高效获得(E)-选择性烯丙基三级烷基胺,并且通过增强光敏剂的三线态能量或延长光照时间,借助能量转移机制可以将热力学稳定的E-式产物转化为热力学不利的Z-式异构体,从而同时获得顺反异构的两种烯丙基烷基胺骨架。相关研究成果发表在ACS Catal. 2024, 14, 9655−9661。
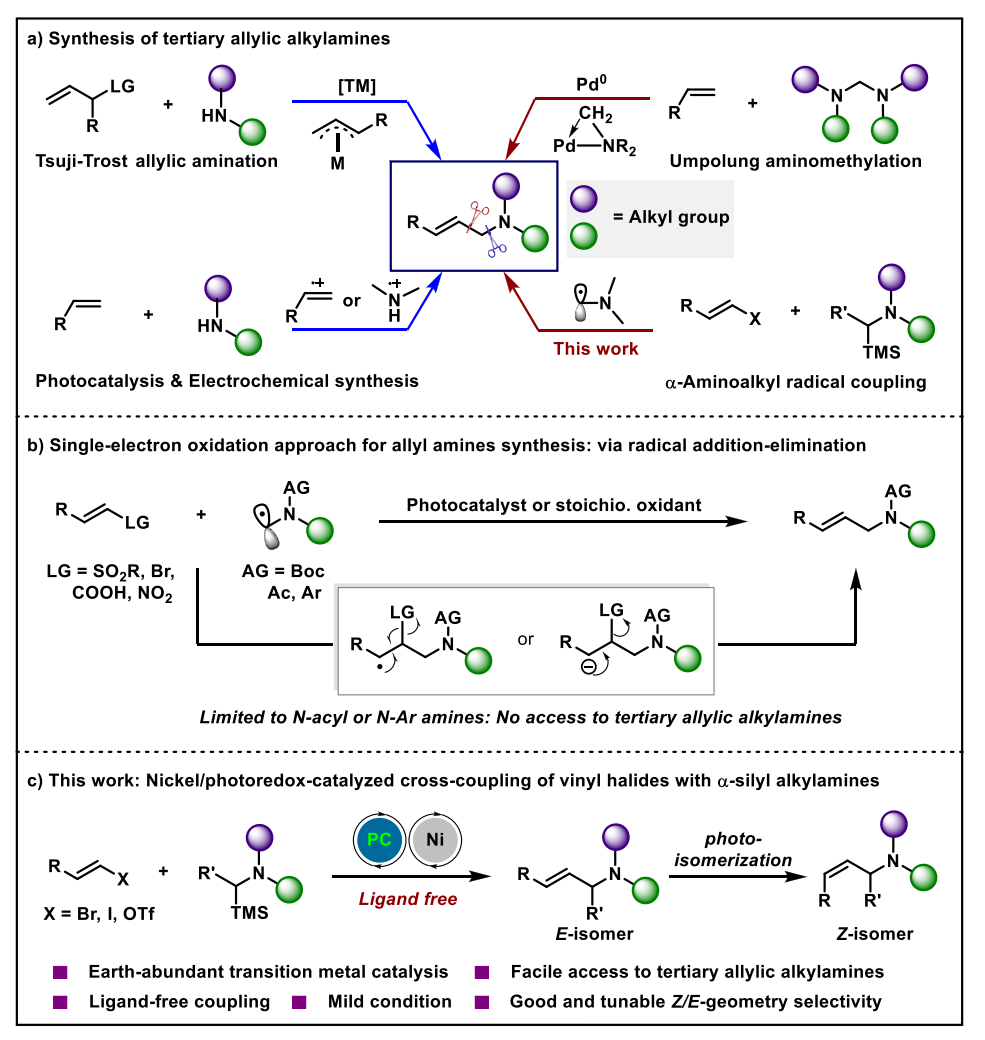
图2. 烯丙基烷基胺的合成报道与本文研究思路(来源:ACS Catalysis)
作者以1a和2a为模板底物,经过系统的条件优化可以72%的GC收率(分离收率为70%)获得目标产物(图3,entry 1)。有趣的是,反应无需添加任何配体即可顺利进行。作者认为酰胺类溶剂NMP可以作为一种潜在的配体。与NiBr2•DME相比,使用其他镍催化剂如NiCl2或Ni(cod)2等导致产率下降(entries 5-6)。光催化剂和溶剂的选择对该反应至关重要,使用Ir(ppy)3或有机光敏剂4-CzIPN时产率降低(entries 7-8),把溶剂换成CH3CN等其他溶剂也会导致产率下降(entries 9-10)。控制实验表明镍、光催化剂和光照是必不可少的(entry 11)。
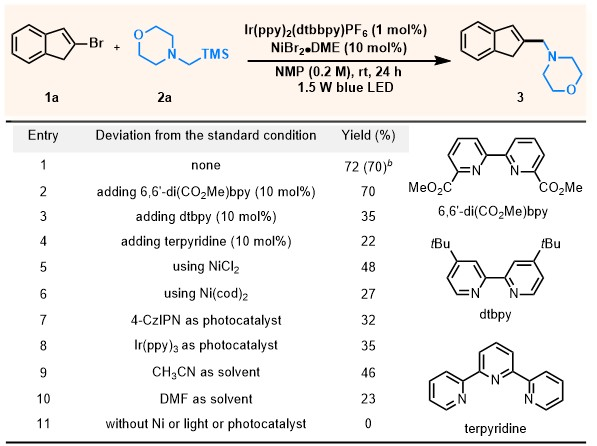
图3. 反应条件优化(来源:ACS Catalysis)
在最优条件下,作者对反应底物适用性进行了探究(图4)。六至八元环状烯基三氟甲磺酸酯都可以顺利进行交叉偶联反应,以中等至良好的产率获得烯丙基三级烷基胺(4-12)。除环状底物外,一系列非环状底物包括α-取代的乙烯基溴化物、(E)-苯乙烯基溴和(E)-β-烷基取代的乙烯基溴都能成功参与偶联过程(13-25)。带有OMe、Ph或OBn (17-19) 等给电子基团或Cl、CN、F (20-22) 等吸电子基团的烯基卤化物都能顺利反应,其活性无明显差异。值得注意的是,α-取代、β-取代、α,β-二取代或α,β,β-三取代的烯基卤化物都是有效的底物,这类具有位阻效应的烯烃通常在钯催化烯丙基胺化反应中不是一类有效的底物,因为较大的立体位阻会妨碍烯烃与过渡金属配位。喹啉基 (23)、吡啶基 (24) 和呋喃基取代的乙烯基卤化物 (25) 等杂环烯烃也可以反应。该反应甚至可以容纳硼取代基 (26),共轭二烯基卤化物 (27),进一步显示了该方法广泛的底物适用性。哌啶 (28)、氮杂环庚烷 (29)、硫代吗啉 (30)、哌嗪 (32)、四氢异喹啉 (35) 和螺环胺 (38) 等药物中常见的N-杂环取代的硅胺底物都能顺利进行偶联反应,以良好的产率得到结构丰富的烯丙基烷基胺产物。进一步研究发现当将光催化剂更换为Ir(ppy)3或将光照时间延长,可以合成热力学不稳定的Z-式为主的烯丙基烷基胺产物 (43-47)。

图4. 底物拓展(来源:ACS Catalysis)
该反应可以放大到3.0 mmol,产率没有明显的下降。为了进一步证明该策略在烯丙基烷基胺骨架药物合成中的应用潜力,作者通过烯基溴与α-硅胺一步高效合成了药物分子氟桂利嗪 (48)、萘替芬 (49) 和贝泊他丁中间体 (50)(图5)。
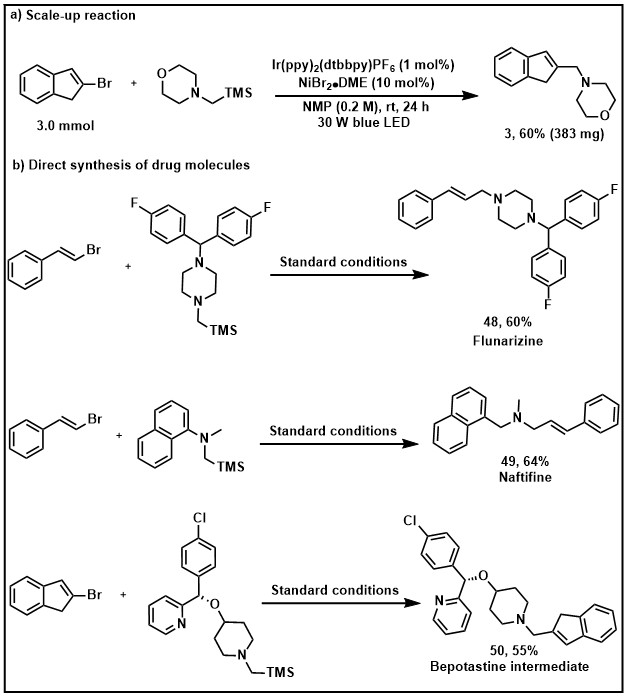
图5. 放大反应与药物分子合成应用(来源:ACS Catalysis)
为了研究反应机理,作者进行了一系列控制实验 (图6)。加入自由基抑制剂2,2,6,6-四甲基哌啶(TEMPO)反应被完全抑制。通过高分辨质谱分析检测到了α-氨基自由基捕获的加合物和亚胺离子物种,表明反应可能涉及自由基历程(图6a)。Stern-Volmer实验结果表明α-硅胺而不是烯基溴淬灭激发态光催化剂(图6b)。控制实验表明在光催化条件下Z-和E-乙烯基溴都能顺利偶联,并观察到产物E→Z异构现象(图6c)。值得注意的是,在标准条件下起始原料E-烯基溴也可以异构化为Z-烯基溴,且E→Z异构化程度与光催化剂的三线态能量成正相关(图6d)。时间跟踪实验表明E-式烯丙基胺可以逐渐转化为Z-异构体(图6e)。根据上述实验和文献报道,作者提出了镍/光氧化还原协同催化交叉偶联反应的机理(图6f)。首先,激发态光催化剂将α-硅胺单电子氧化成α-氨基自由基。另一方面,Ni0与烯基卤化物发生氧化加成生成乙烯基NiII中间体,该中间体捕获α-氨基自由基得到NiIII中间体,经还原消除得到目标产物和NiI。最后,NiI与还原态光催化剂发生单电子转移同时再生镍催化剂和光催化剂。另外,Ni0先与自由基结合再与烯基卤化物氧化加成/还原消除的机理也不能完全排除。而通过光催化剂三线态能量转移(EnT)机制可以导致原料和产物中双键发生异构化,从而同时获得Z/E两种异构体。
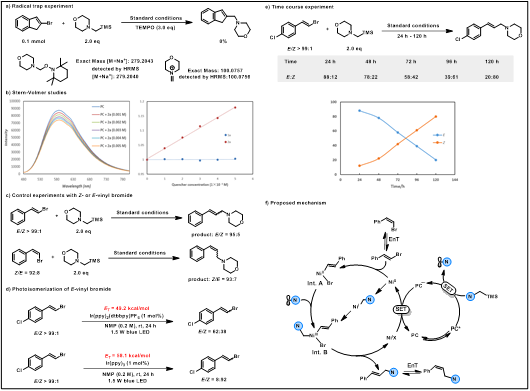
图6. 机理研究(来源:ACS Catalysis)
总结:袁伟明课题组报道了无配体条件下可见光/镍协同催化烯基卤化物与α-硅胺的交叉偶联反应,该方法为合成结构丰富的烯丙基三级烷基胺提供了温和、高效的手段,并通过简单的更换光催化剂或延长光照时间,即可获得E-和Z-式两种烯丙基三级烷基胺骨架。
论文信息:Fu Ye, Shiming Tong, and Weiming Yuan*, Merging photoredox and Nickel Catalysis: A Ligand-free Cross-Coupling of Vinyl Halides and α-Silylamines Toward Tertiary Al-lylic Alkylamines. ACS Catal. 2024, 14, 9655−9661.
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





