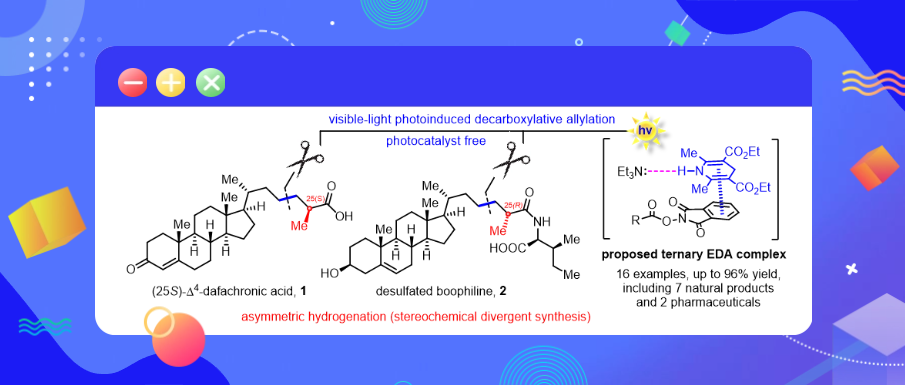
可见光诱导的脱羧烯丙基化反应,实现 (25S)-Δ4-dafachronic acid和脱硫酸酯boophiline的简明合成
导语
近日,上海交通大学吴晶晶与张兆国课题组在天然产物(25S)-Δ4-dafachronic acid和脱硫酸酯的boophiline的高效合成中取得重要研究进展。相关研究成果以“Concise synthesis of (25S)-Δ4-dafachronic acid and desulfated boophiline enabled by photoinduced decarboxylative allylation and asymmetric hydrogenation”为题,在国际有机化学著名期刊Organic Chemistry Frontiers 上线发表。
Dafachronic acid分子是存在于线虫体内的类固醇激素,这类化合物作为DAF-12的配体对线虫的生长发育起到了重要的调控作用,因此研究这类化合物对于农业上防治线虫以及人类的抗衰老研究具有重要的作用。Boophiline作为一种抗菌甾醇酰胺,除了有趣的生物活性外,其C-25手性中心的绝对构型尚未确定。研究表明,分子侧链C-25位的立体化学构型是影响其生物活性的重要因素。因此,C-25手性甲基的构筑成为了合成dafachronic acid分子及相关化合物的关键步骤。对于这一关键步骤,少数研究小组采用了手性池策略,而大多数研究小组采用了包括HWE反应、Wittig反应或Julia烯化反应与不对称氢化反应联用的策略。但是这些方法都需要使用化学计量的强碱(如n-BuLi或t-BuOK),因此这些合成需要额外的保护和去保护步骤。基于此,作者希望开发简明高效的合成路线。
前沿科研成果
利用可见光诱导的脱羧烯丙基化反应,实现 (25S)-Δ4-dafachronic acid和脱硫酸酯boophiline的简明合成。
基于骨架的相似性,作者选择廉价易得的胆酸作为初始原料进行合成。首先,作者对目标分子进行逆合成分析,他们设计了两种策略,其一是直接的脱羧烷基化策略,即化合物6或7与含有手性甲基的化合物5进行脱羧烷基化反应,直接引入手性甲基。另一种有效的策略是在可见光照射下,烯丙基砜试剂9与氧化还原活性酯7发生脱羧烯丙基化反应,随后串联不对称氢化反应构筑手性甲基。
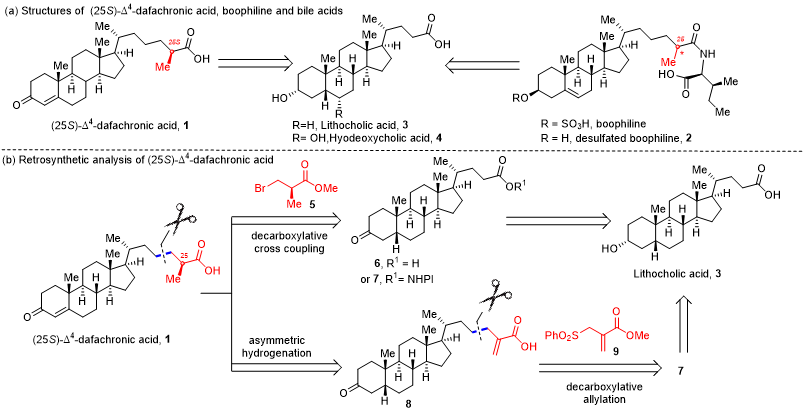
图1. 逆合成分析(来源:Org. Chem. Front.)
首先,作者对直接脱羧烷基化策略进行尝试,他们首先尝试了MacMillan课题组发展的光氧化还原/镍协同催化体系,化合物5与6发生直接脱羧烷基化反应,能以30%的收率得到所需的产物10。但13C-NMR显示,得到的产物为比例为1:1的非对映体。随后,作者尝试了金属镍催化的还原偶联反应,能以10-13%的收率获得目标产物10,但是其C-25位手性甲基也发生了部分消旋化。接着作者又尝试了Baran课题组发展的镍催化的氧化还原活性酯与有机锌试剂的偶联反应。他们把(S)-Roche酯转化为具有较高反应活性的锌试剂11,并与化合物7进行反应,能以28%的收率得到手性完全保留的产物。然而经过对不同类型镍催化剂、配体和溶剂的进一步筛选,反应收率并没有得到显著提高。
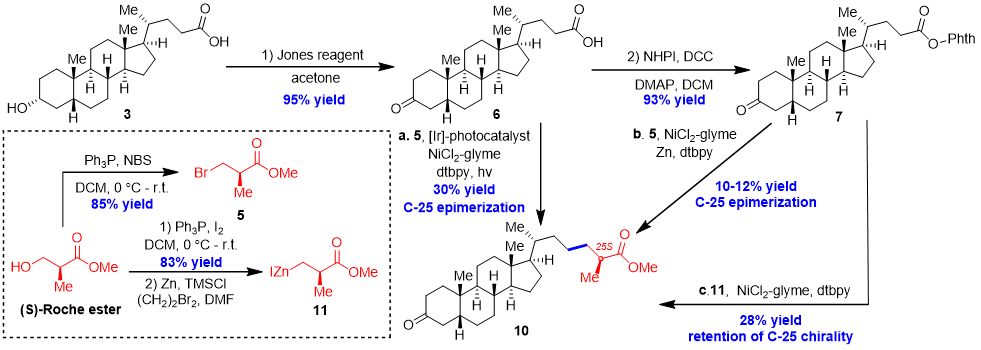
图2. 通过直接脱羧烷基化策略构筑手性甲基(来源:Org. Chem. Front.)
随后,作者对可见光诱导的脱羧烯丙基化策略进行了实验尝试。虽然陈以昀课题组已经通过光氧化还原催化策略报道了类似的反应,但作者想要开发一种无光催化剂的转化。受Aggarwal、陈以昀以及尚睿等课题组开创性工作的启发,作者提出Hantzsch酯(HE)和氧化还原活性酯可以形成电子给受体(EDA)复合物,在可见光照射下生成烷基自由基,烷基自由基随后可与烯丙基砜化合物发生反应实现脱羧烯丙基化反应。具体实验中,在蓝光照射下,化合物7和9在三当量的Hantzsch酯存在下,以DMA为溶剂可以42%的收率得到目标产物。当在体系中加入三个当量的三乙胺时,收率可以提高至70%。
表1. 可见光诱导的脱羧烯丙基化反应条件筛选(来源:Org. Chem. Front.)
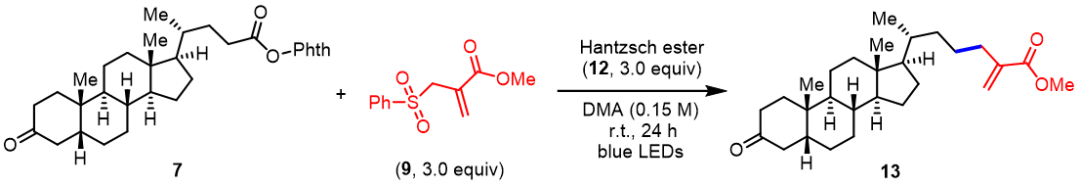

在完成了关键步骤的探索后,作者开始了对目标分子的合成。首先,从石胆酸3出发,经过Jones氧化和DCC缩合反应,可以很容易地制备出氧化还原活性酯7。在标准的光诱导脱羧烯丙化条件下,以69%的收率得到了所需产物13。化合物13水解后,在NaHCO3和PPh3存在下,以(S,Sp)-RuPhox-Ru为手性催化剂,在20 bar H2条件下对丙烯酸进行不对称氢化反应,可以优秀的产率(99%)和非对映选择性(>20:1 d.r.)得到目标产物手性羧酸14。最后,化合物14经IBX氧化得到最终的目标产物(25S)-Δ4-dafachronic acid,总路线包括六步,总收率为29%。
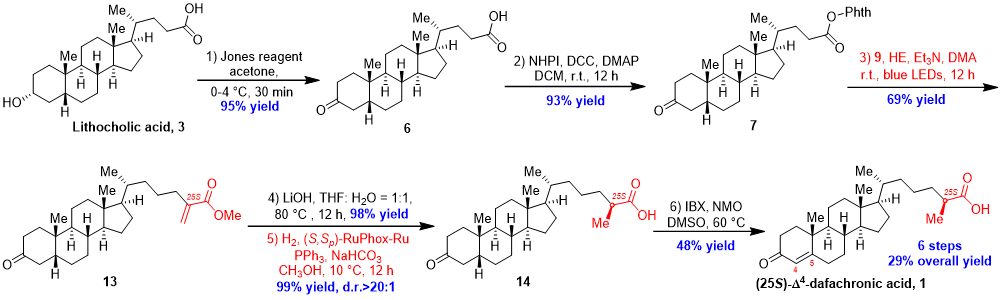
图3. 6步合成天然产物(25S)-Δ4-dafachronic acid(来源:Org. Chem. Front.)
对于目标分子2,作者选择以猪去氧胆酸4为初始原料进行合成。化合物4依次经过甲酯化、对甲苯磺酰基保护C-3和C-6羟基得到化合物15。随后,该化合物在醋酸钾存在下在冰醋酸溶液中回流同时发生6α-tosylate消除和C-3 Walden翻转,得到化合物16,产率为61%。随后,通过连续的水解、DCC缩合反应,可以制备氧化还原活性酯17。在标准的光诱导脱羧烯丙化条件下,可以78%的收率得到目标产物18。接下来,化合物18经水解得到丙烯酸化合物19。为确定目标产物在C-25位置的绝对构型,作者使用了两种构型的RuPHOX-Ru催化剂对化合物19进行了不对称氢化反应,以优异的产率和非对映选择性得到化合物20和22,随后二者分别与L-异亮氨酸反应完成最后的合成,得到两种异构体。最后,通过与天然产物分离文献中13C-NMR谱的比较,确定其C-25绝对构型为R。总合成路线包括九步,总收率为14%。
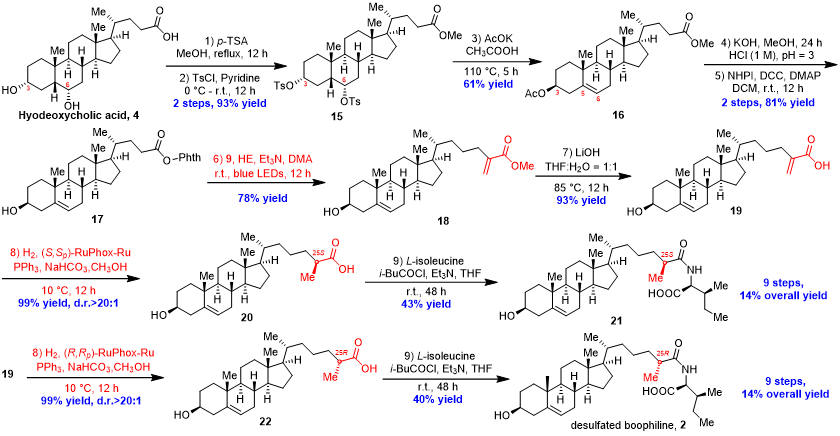
图4. 9步合成天然产物desulfated boophiline(来源:Org. Chem. Front.)
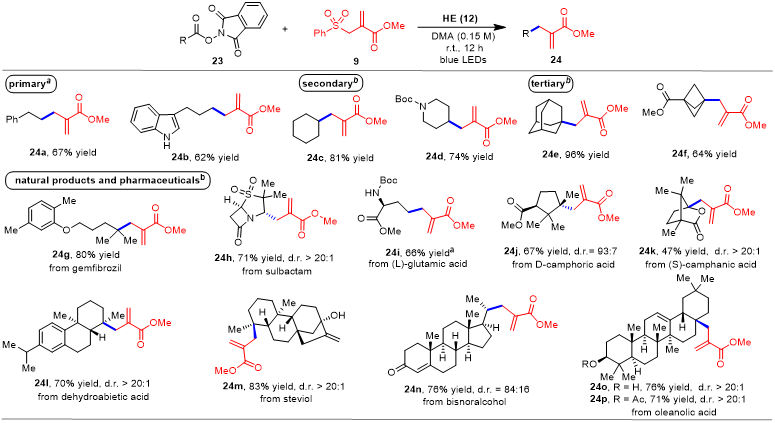
在上述两个天然产物合成中,作者已经验证了新发展的可见光诱导的脱羧烯丙基化反应的实用性。作者认为,新发展的反应操作简便,条件温和,应该可以应用于复杂天然产物后期修饰中。于是作者首先挑选了几种有代表性的简单一级、二级、三级羧酸,进行脱羧烯丙基化研究,发现都能以中等到优秀的收率给出目标产物。进而作者利用新发展的反应,对一些复杂的药物分子和天然产物,如:舒巴坦、谷氨酸、樟脑酸、脱氢松香酸、甜菊醇、齐墩果酸等分子,进行了后期脱羧烯丙基化修饰,反应都能顺利进行,收率普遍在中等到良好,且大多数情况下都能得到较好的非对映选择性。
表2. 脱羧烯丙基化反应底物拓展(来源:Org. Chem. Front.)
接着通过UV-Vis实验、自由基钟实验,作者对该反应的机理进行了初步验证,并提出以下机理:氧化还原活性酯与Hantzsch酯相互作用形成EDA复合物,该复合物通过光致电子转移(PET)生成烷基自由基和Hantzsch酯自由基阳离子。产生的烷基自由基被烯丙基砜捕获,然后发生β-裂解,即可得到所需的烯丙基化产物。
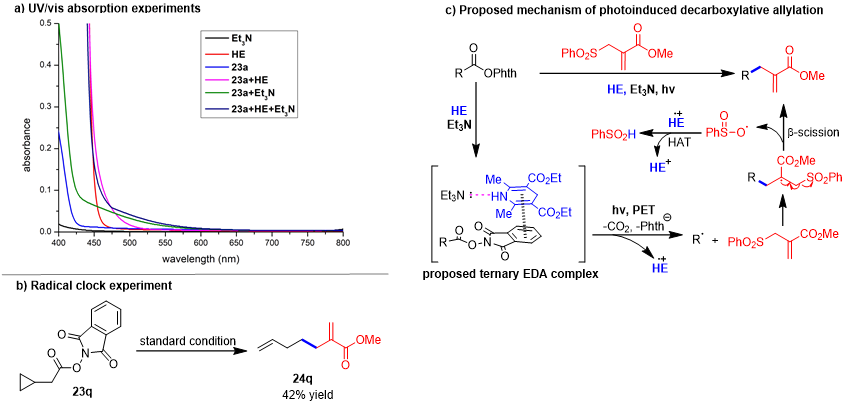
图5. 机理探究(来源:Org. Chem. Front.)
综上所述,作者从廉价易得的胆酸出发,以光诱导的脱羧烯丙基化策略作为关键步骤,完成了生物活性天然产物(25S)-Δ4-dafachronic acid和脱硫酸酯的boophiline的简明合成。值得强调的是,作者通过立体化学发散性合成,完成了脱硫酸酯的boophiline的两个非对映异构体的合成,从而首次确定了boophiline C-25位的绝对构型。此外,作者开发的基于可见光激发EDA复合物的脱羧烯丙化反应,具有条件温和、操作简单、官能团耐受性广等特征,为复杂天然产物和药物分子的后期官能团化修饰提供了新的可能。
吴晶晶课题组博士生李晓童为论文第一作者,张兆国教授和吴晶晶副教授为论文的共同通讯作者。作者特别感谢上海交通大学张万斌教授的支持,以及新加坡南洋理工大学Phillip. S. Grant助理教授在文章写作中所提供的帮助。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





