许民瑜课题组Nature:光诱导天然糖类的自由基官能团化
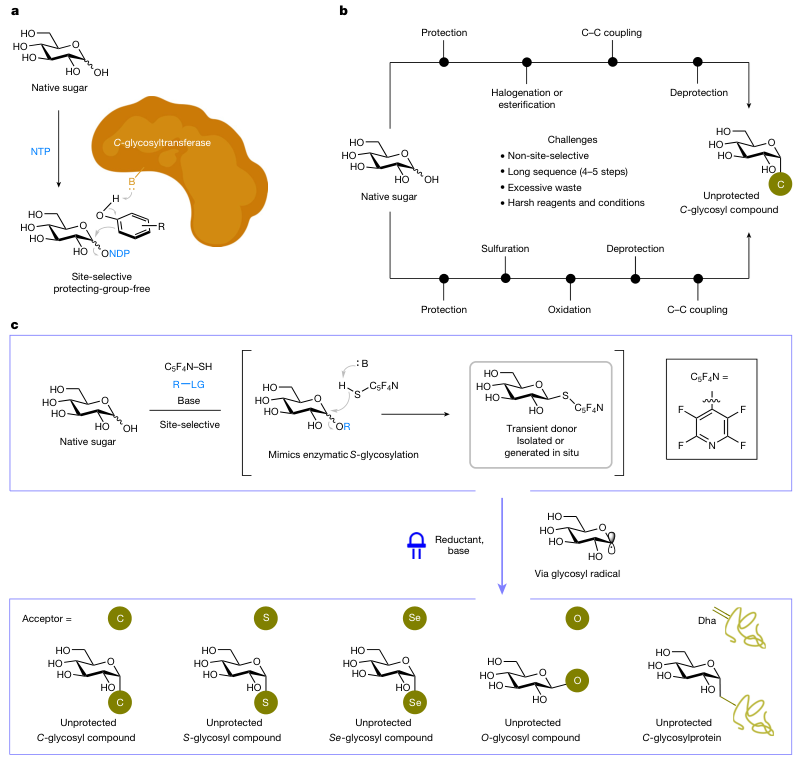
糖类化合物是生命细胞结构的主要成分以及供能物质,不仅可以为各种生命活动提供所需要的能量,还可以参与代谢及免疫功能的调节,以及维持肠道微生物群。然而,从自然界中分离提取纯的糖类化合物并非易事,科学家经常通过化学合成手段来合成糖类化合物以深入研究其功能。具体而言,未保护天然糖(自然界中最丰富的有机化合物)经羟基保护、官能团化和脱保护等多步合成序列来获得所需的无保护C-糖苷化合物(图1b)。但是,目前发展的化学糖苷化反应通常需要繁琐的保护基策略来克服位点选择性问题,同时存在反应条件苛刻、原子经济性差等缺点,影响其广泛应用。相比之下,酶促C-糖苷化反应能够在温和的条件下进行,并且具有高立体选择性和区域选择性(图1a),同时避免化学合成中繁琐的保护-去保护操作。
受生物催化S-糖苷化反应的启发,新加坡国立大学的许民瑜教授课题组发展了一种仿生“封端-糖基化(cap and glycosylate)”策略,成功地实现了天然糖类化合物位点选择性和立体选择性的糖苷化转化(图1c),全过程无需金属催化和保护基操作。具体而言,首先是“封端(capping)”,天然糖中的异头羟基(半缩醛)经仿生催化的S-糖基化反应产生硫代糖苷中间体;然后是“糖苷化(glycosylation)”,该硫代糖苷中间体经光活化后可与多种亲电试剂进行立体控制的脱硫自由基交叉偶联反应,从而以高产率、高区域选择性和立体选择性获得一系列C-、S-、Se-和O-糖基化合物。此外,该方法还能用于在水相蛋白质的直接翻译后糖基化,进一步展现出该方法的实用性和该类新型糖给体优异的生物相容性。相关成果于近日发表在Nature 上,许民瑜教授和the Rosalind Franklin Institute及英国牛津大学的Benjamin G. Davis教授为通讯作者。文章第一作者是许民瑜组博士生蒋仪(目前Davis组博士后),共同第一作者为许民瑜组博士后魏怡(现任中南民族大学副教授)。
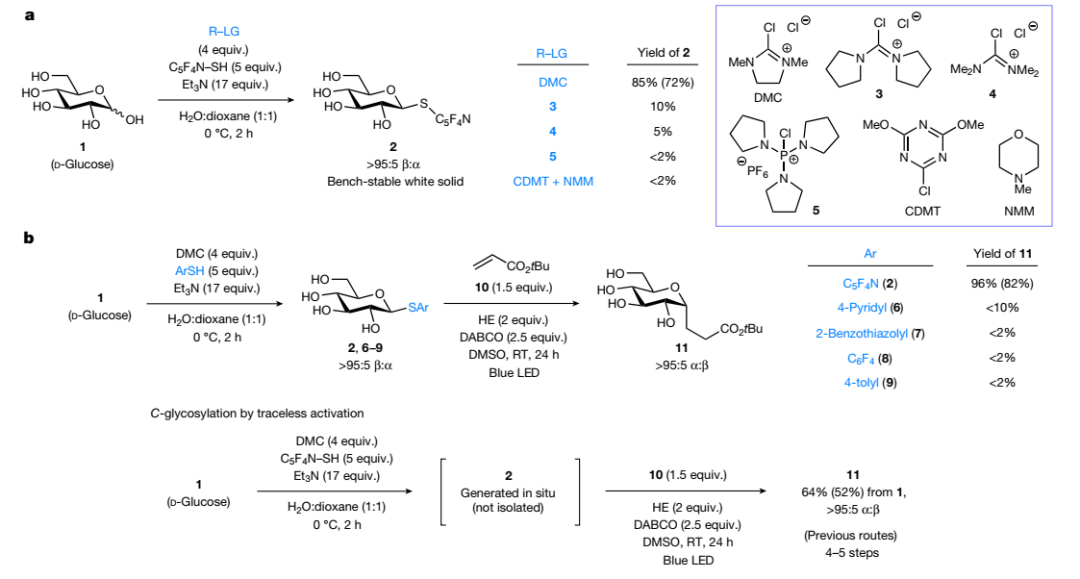
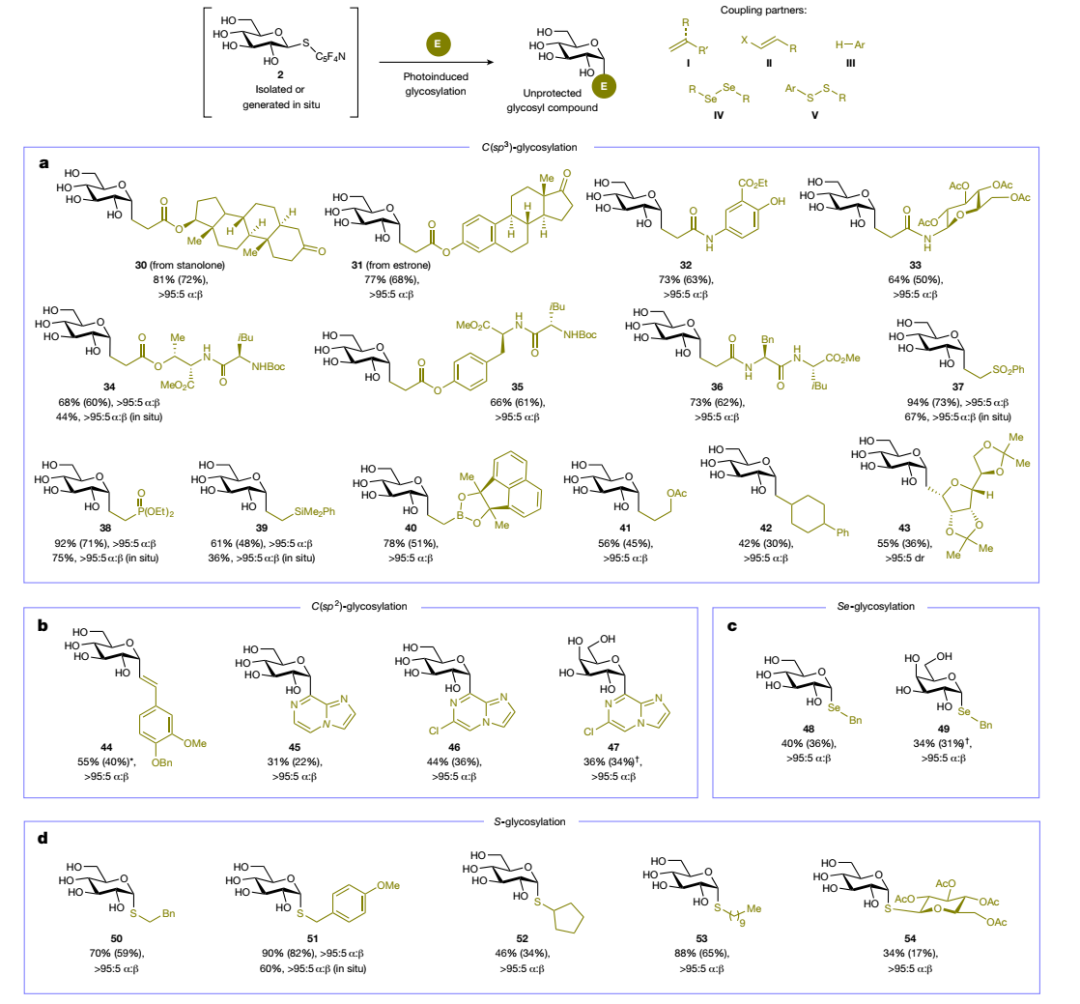
首先,作者选择D-葡萄糖1为模板底物对区域选择性亲核取代的反应条件进行优化,结果显示在市售2-氯-1,3-二甲基氯化咪唑鎓(DMC)为活化剂、三乙胺为碱、C5F4N-SH为亲核试剂、H2O:dioxane(1:1)为混合溶剂的条件下于0 °C反应2 h,能以85%的产率(分离产率:72%)、>95:5 β:α选择性获得2,3,5,6-四氟吡啶-4-硫代糖苷衍生物2(图2a),可以在室温存储数月而不会分解。值得一提的是,该糖给体试剂为首次报道。随后,作者将4-硫代糖苷衍生物2与丙烯酸酯10置于可见光照射下进行脱硫C-C键偶联反应,发现在Hantzsch酯为还原剂、1,4-二氮杂双环[2.2.2]辛烷(DABCO)为碱、二甲基亚砜(DMSO)为溶剂的条件下于室温进行蓝光照射,可以96%的产率(分离产率:82%)和>95:5 α:β选择性得到未保护的C-烷基糖苷11(图2b),而其它氧化还原活性较低的S-糖给体(6-9)则转化率较差,进一步凸显出氟代杂芳基单元对实现光诱导交叉偶联反应的重要性。此外,作者从D-葡萄糖1出发,无需分离糖给体即可一步合成α-11(产率:64%、分离产率:52%、>95:5 α:β),而此前已有报道则需要4-5步。
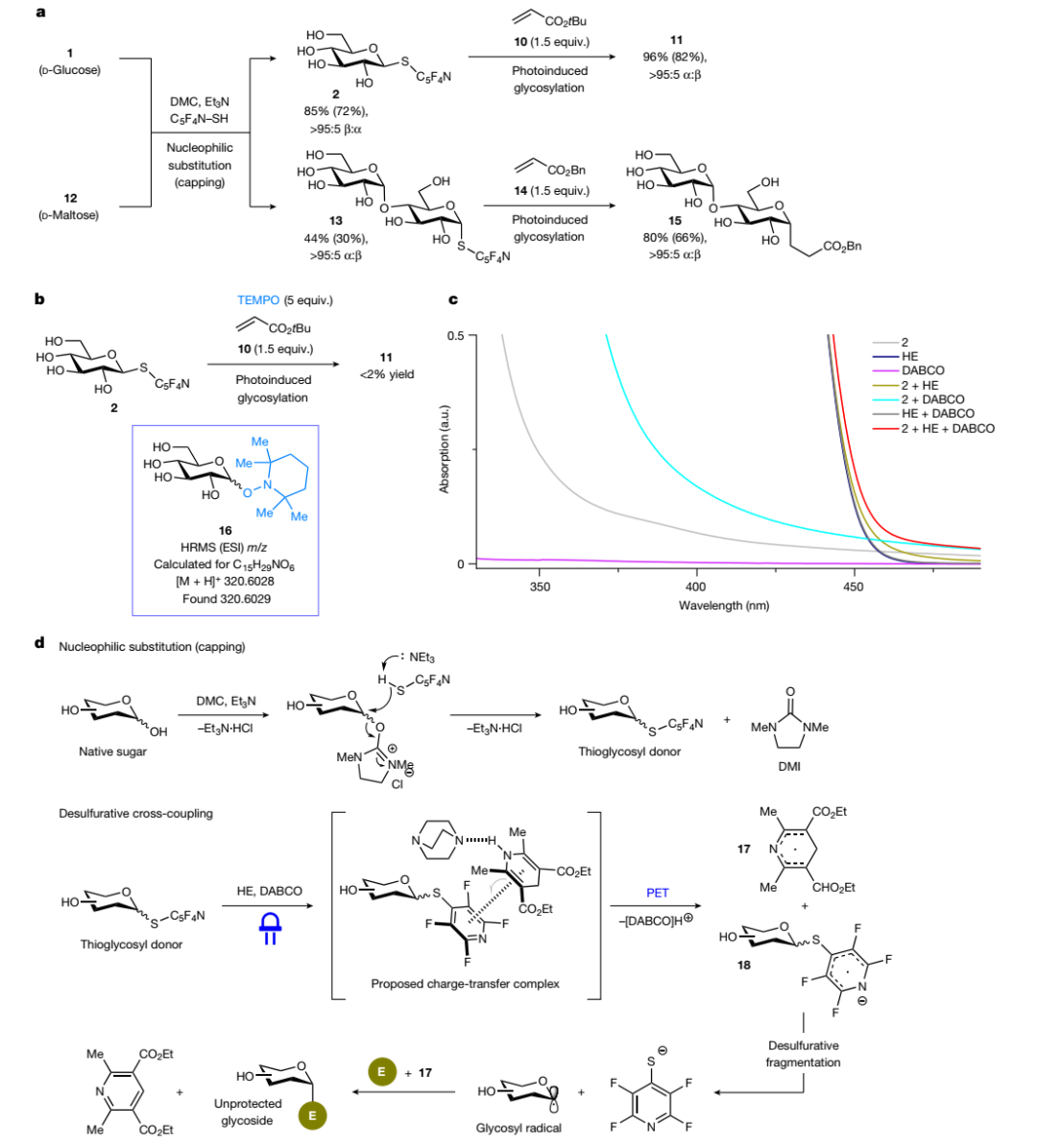
D-葡萄糖1 和D-麦芽糖12进行亲核取代时得到立体化学相反的硫代糖给体2和13,但是将两者分别置于标准交叉偶联条件下与丙烯酸酯进行反应时得到的产物11和15却具有相同的立体选择性(图3a),这说明与异裂解糖基化反应不同,S-糖给体的C1立体化学无关紧要,进而突出该策略在将未保护天然糖异构体的混合物通过其硫代糖苷衍生物转化为立体异构纯糖苷的优势。另外,向2与丙烯酸酯10的交叉偶联反应中加入外源性TEMPO,抑制了2→11的光诱导转化(图3b),高分辨质谱(HRMS)分析显示形成了TEMPO-糖苷加合物16,进而证实了糖基(异头物)自由基物种具有足够长的寿命。如图3c所示,作者还通过紫外-可见吸收(UV-vis)光谱探索了光诱导反应的性质,结果表明2、Hantzsch酯和DABCO之间形成了三元复合物,可以吸收可见光并裂解为糖基自由基。在此基础上,作者提出了可能的反应机理(图3d):首先,DMC对酸性更强的异头羟基进行位点选择性封端并形成活化的离去基团,然后在碱性条件下被C5F4N-SH亲核进攻并形成硫代糖给体和副产物1,3-二甲基-2-咪唑啉酮(DMI)。随后,所得的硫代糖给体与Hantzsch酯和DABCO在溶液中进行缔合,形成的三元配合物可以吸收可见光并引发光诱导电子转移(PET),从而得到二氢吡啶自由基17和自由基阴离子18,18易脱硫裂解并得到糖基自由基和2,3,5,6-四氟吡啶-4-硫醇盐(反应混合物中检测到其共轭酸)。最后,糖基自由基在17的促进下与亲电试剂交叉偶联,实现动力学控制的立体选择性偶联反应,从而得到所需的无保护糖苷。
在最优条件下,作者对天然单糖和寡糖的适用范围进行了考察(图4),结果显示单糖(19-21、24)、稀少糖(22、23)、非天然L-葡萄糖(25)以及天然复杂二糖和寡糖(15、26-29)衍生的硫代糖给体均能兼容该反应,以中等至较好的产率和优异的立体选择性得到所需的无保护C-烷基糖基化合物。此外,作者探索了亲电偶联试剂的底物适用性,结果显示生物活性化合物(30、31)、氨基水杨酸盐(32)、氨基糖(33)和寡肽(34-36)衍生的丙烯酸酯和丙烯酰胺、其它Michael受体(如:乙烯基砜(37)、乙烯基膦酸酯(38)、乙烯基硅烷(39)、乙烯基硼酸酯(40)、乙酸烯丙酯(41))甚至活性较低的烷基取代烯烃(42)均能顺利地实现这一转化并获得相应的无保护C-烷基糖苷化合物(图5a)。值得一提的是,卤代烯烃、杂芳烃、二硒化物和二硫化物也能以高立体选择性获得相应的无保护C-烯基(44)、C-杂芳基(45-47)、Se-(48、49)和S-(50-54)糖基化合物(图5b-5d),其中44可能是通过糖基自由基加成-还原-β卤素消除进行的。经过对反应条件进行略微调整,苯酚类化合物作为受体以中等产率(17-43%)和>95:5 β:α选择性转化为相应的O-糖基化合物(55-59)。
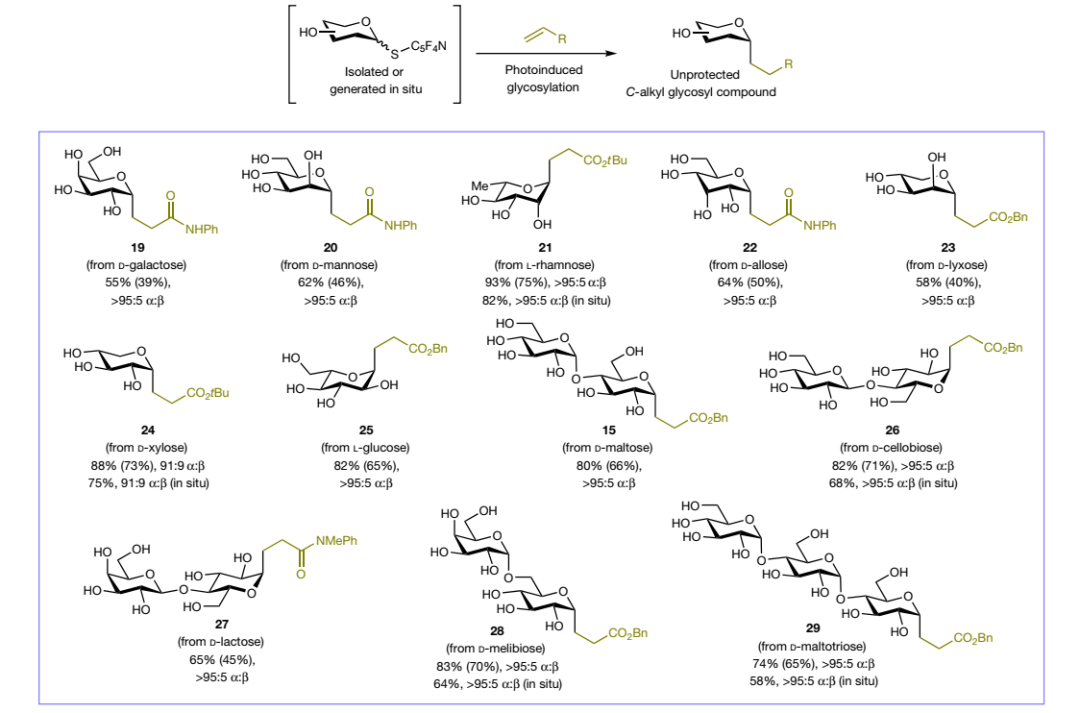
图4. 糖类化合物的底物拓展。图片来源:Nature
总结
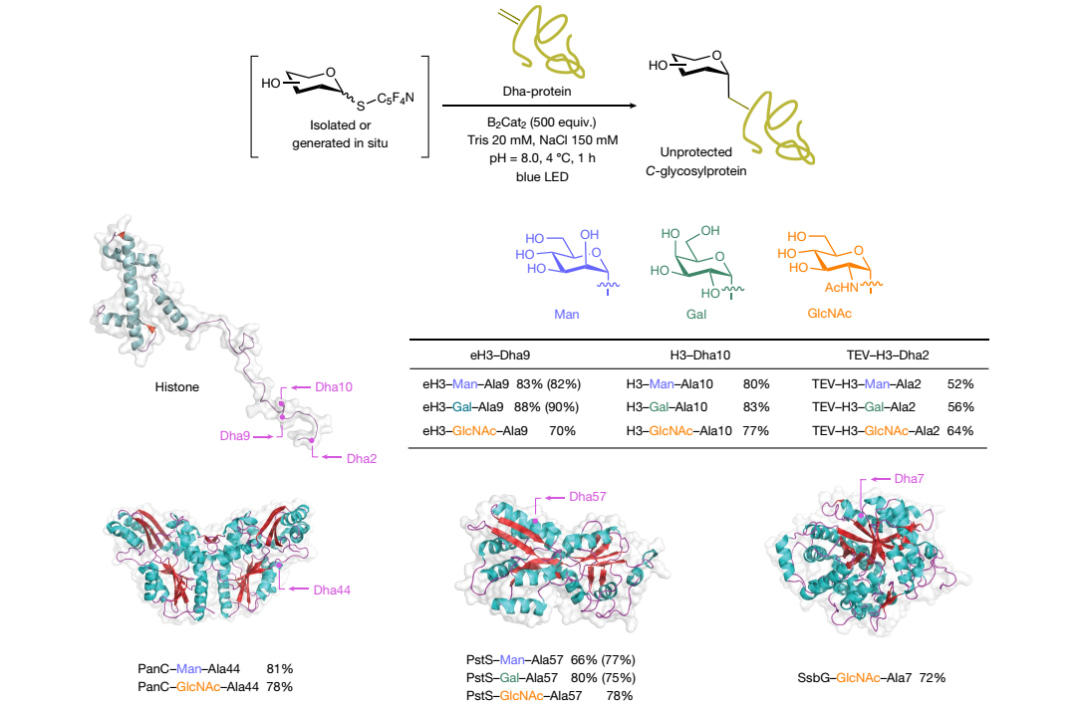
许民瑜教授课题组利用光诱导的脱硫交叉偶联策略,成功实现了天然糖类化合物的位点选择性和立体选择性糖基化反应。该报道以高产率、高区域选择性和立体选择性获得了一系列无保护C-、S-、Se-和O-糖基化合物。此外,作者还将该方法应用于水相蛋白质的直接翻译后糖基化,进一步展现出该方法的实用性。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





