马普所最新Nature Catalysis:光催化实现C-杂原子与富电子芳基偶联
第一作者:Shengyang Ni
通讯作者:Josep Cornella、Tobias Ritter
通讯单位:马克斯普朗克研究所
研究背景
基于钯、镍和铜的过渡金属催化的C-N和C-O交叉偶联反应已被广泛研究(图1a)。近期通过设计配体如磷化合物或N杂环卡宾等来改善反应活性取得了进展。MacMillan和Buchwald报道了一种不需要辅助配体的镍催化C-N偶联反应,采用光催化机理生成高价态Ni(III)活性中间体,实现迅速且热力学有利的C-N还原消除。相关的镍-光催化C-O偶联反应也有报道,但需要N配体。此类简单高价态金属参与的偶联反应受到广泛关注,并进一步拓展至电化学或能量传递诱导的镍催化体系。
尽管机理存在细微差异,但使用富电子芳香卤代物作为偶联底物仍面临挑战。推测是由于低价态镍对富电子芳基卤代物的氧化加成较慢,导致镍物种聚集和失活(图1b)。当前方法仅能处理特定的富电子芳基卤代物,对于一些primary烷基胺需要长达一周的反应时间,亟需找到更通用的解决方案。
研究内容
作者着眼于提供一种通用的解决方案,以包含富电子芳香伪卤代物。通常,L-Ni(I)物种对C-X键的氧化加成可通过亲核芳香取代、单电子转移、协同氧化加成或卤原子夺取等机理实现。无论遵循何种机理,氧化加成的成功主要取决于芳环的电子结构。与芳卤代物不同,芳基噻嗪盐(ArTT)的氧化还原性主要由噻嗪基团决定,可作为单电子转移的受体。当低价态镍物种(如Ni(I))对其进行单电子还原时,C-S键发生快速中性裂解,生成合成有用的芳基自由基。这一过程有利于受电子给体取代基影响的芳环。拟利用Ni(I)在光照条件下的还原能力,首先对ArTT盐进行单电子还原,随后芳基自由基与镍物种配位生成Ni(III)中间体,实现所需的C-N还原消除(图1c)。据此,作者提出了一种简单的镍催化C-杂原子键偶联反应,适用于电子中性和富电子的ArTT盐,解决了长期存在的镍光化学领域的难题。该方法在室温下进行,不需添加配体,适用于大分子和高官能团密度的亲核试剂和噻嗪盐片段的偶联,能够迅速构建复杂分子。与已知的镍催化C-杂原子键形成反应相结合,这一策略具有互补性。

Fig. 1: State-of-the-art of C–heteroatom coupling. a, Canonical low-valent two-electron cross-coupling versus the high-valent NiI/III redox cycle. b, Electron-rich aryl halide: a recurrent limitation. c, This work: a general ligand-free nickel-catalysis platform for the C–N, C–O and C–S coupling of electron-rich and neutral arenes. EDG, electron donating group.
图文解析
在蓝色LED光照条件下,2 mol%NiCl2·6H2O催化ArTT盐1与哌啶2反应,可在N,N-二甲基乙酰胺(DMA)溶剂中25°C、16h内得到近乎定量的产物3(表1a,条目1)。对照实验证实需要光照(条目2)。NiBr2·双二乙二醇也能作为催化剂,但NiCl2·6H2O更经济(条目3)。此前作者报道了一种无需光照的镍催化卤代反应,利用锌作还原剂,但仅能得到不到10%的产物3(条目4),与本反应机理不同。进一步研究表明,富电子和中性的ArTT盐都能以50-93%的收率转化为产物(表1b)。相比其他镍催化胺化反应,亲电子底物反应效率较低。这可能是由于亲电子芳环的氧化加成更快,但存在还原脱官能团化的竞争副反应,导致收率较低。虽然未能确定此副反应的具体原因,但可能源自从胺或溶剂的α-C-H位的氢原子转移。该方法对官能团普适性强,适用于含有磺酰胺、酰胺、环丙基、醚、联芳基、卤素、腈基、酯基、杂环、氨基等的复杂分子。这为后期修饰复杂分子提供了有用的方法。对于邻位取代的ArTT盐,该方法不适用,会得到还原脱官能团化的副产物及未反应的原料。

Table 1 Reaction development and the amination scope of ArTT salts: a, discovery and optimization; b, scope of the amination of ArTT salts
在此反应条件下,各种N亲核试剂如primary烷基胺、secondary烷基胺、苯胺、磺酰胺和酰胺都能良好适用,如表2所示。各种不同环大小的cyclic secondary胺、α-甲基取代的吡咯烷、N-Boc保护的哌嗪、吗啡啉以及缩环、螺环、嘧啶和苯并异噻唑环胺都能参与反应。二甲基胺可高效得到80%收率的目标产品。但使用比二甲基胺更大位阻的linear secondary胺时,收率有所降低。这可能是由于位阻效应减缓了反应速度,且与镍催化剂配位后发生β-H消除。通过添加3equiv. 2-叔丁基-1,1,3,3-四甲基胍(BTMG)、将镍源改为10 mol%NiCl2·二乙二醇、以白光LED照射,primary胺也能参与反应顺利得到产品。相比蓝光LED,白光LED在primary胺的情况下能略微提高收率。此外,对于易发生副反应的底物,如含烯烃(Heck)和硼酸酯(Suzuki)的,以及酸性官能团也都能兼容。这些类型的底物在之前报道的钯催化胺化反应中通常存在问题。

Table 2 Scope of the amination of nitrogen nucleophiles
本催化剂体系被扩展到与MeOH作为亲核试剂进行具有医学意义的甲氧基化反应。如表3所示,各种简单和高度官能化的ArTT盐都能参与这一过程,包括含有烷基、卤素、酰胺、杂环和酯基的底物。其他的一级和二级醇,以及酚类化合物,也能参与该反应,生成脱功能基化的副产物为主。尽管以前已经报道了使用ArTT盐构建C-O键的反应,但那些转化并非催化性的,需要化学计量的铜。此外,对于卤化反应,需要使用不均相的金属锌粉来生成Ni(I)催化剂,这可能会给大规模应用带来挑战。此外,C-S键的构建仅局限于芳香硫醇,无法涵盖脂肪族硫醇。目前的方法克服了这些局限性,为氮、氧和硫亲核试剂提供了统一的途径。此外,碘化钠、溴化钠和四丁基氯化铵(TBACl)也可作为亲核试剂参与该催化体系,为药物分子的后期卤化提供了一种简单易行的方法,尽管到目前为止还无法扩展到氟化反应(表3)。

Table 3 Extension to other C−X bond formation: a, scope of C−O bond formation; b, extension to C−X bond formation with pyriproxyfen−TT 75
为验证该方法的可扩展性,作者进行了两种药物分子的克级偶联反应,如图2a所示。化合物79之前通过从溴代芳烃80开始的7步合成序列制备。采用作者的方法,可以从更加便宜的原料78开始,通过硫醚化、胺化和亲核取代(SN2)反应,将合成路线缩短到3步(图2b)。
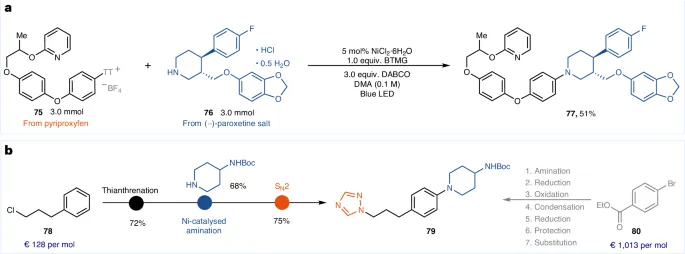
Fig. 2: Synthetic applications. a, Gram-scale process for fragment coupling. TT, thianthrene. b, Alternative retro-synthetic strategy. See Supplementary Methods for the detailed experimental procedure. The price of compounds 78 and 80 was retrieved from Sigma-Aldrich on 5 July 2023.
关于Ni催化的C-X键形成的工作假设如图3a所示。基于之前关于光诱导的Ni催化反应的例子,推测Ni(I)物种可能通过LMCT过程在光照下从简单的Ni(II)盐中生成。没有光照的情况下,加入Ni(COD)2和Fe(Cp)2BArF氧化剂也能生成90%收率的C-N偶联产物3,证实了Ni(I)的参与(图3b,条目1)。而单独使用Ni(0)或Ni(II)盐在黑暗中反应都未能得到目标产物(图3b,条目2和3)。可能的机理是首先单电子转移氧化ArTT阳离子。测得的正但较小的Hammett ρ值为1.1,意味着芳环上的取代基对氧化加成的影响较小,反应主要受硫并芳烃阳离子本身的电子结构控制。光照实验证明该反应需要连续的可见光照射,不存在自持的Ni(I)/Ni(III)循环(补充信息图5和6)。这与之前有关Ni光诱导C-N键形成的研究一致。虽然可以获得一些关于机理的信息,如Ni(I)物种的重要性,但由于该催化体系没有辅助配体,难以分离和表征反应中间体,对于还原消除前的具体过程仍难以确定,可能存在多种反应通径。

Fig. 3: Mechanistic investigation. a, Proposed mechanism. RE, reductive elimination. b, Experiments with stoichiometric nickel without light irradiation.
文章结论
Ni(I)催化的C-杂原子键形成反应,为在简单Ni盐的光诱导Ni催化体系中引入富电子芳基亲电试剂提供了一般性方法。通过根本不同的单电子转移氧化加成过程,硫并芳烃盐解决了长期存在的富电子芳基(伪)卤化物偶联的难题。Ni(I)/Ni(III)氧化还原循环与ArTT盐的电子结构相得益彰,在之前反应发展的基础上取得了重要进步。作者证明,这种方法与位点选择性的C-H硫并芳基化相结合,为后期多样化修饰提供了一种全新的策略。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





