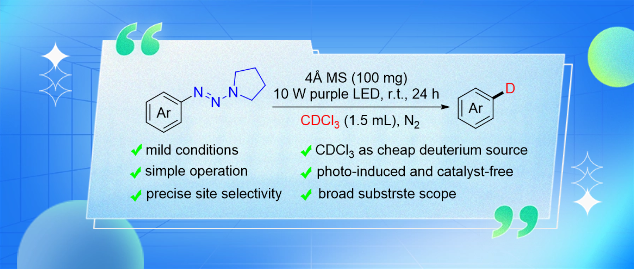
新疆大学刘晨江教授团队Org. Lett.:光诱导芳基三氮烯与CDCl3的氘化反应研究
氘标记已被广泛应用于有机合成、反应机理研究、核磁共振光谱学、药物代谢和药物改性等领域。与C–H键相比,C–D键更具稳定性。因此,氘代分子能够延长代谢半衰期,提高效率并减少副作用。2017年,世界上首个氘化药物氘代丁苯那嗪(Austedo)经美国食品药品监督管理局(FDA)批准上市,这进一步激发了化学家们开发新的氘化方法的热情。
芳基通常存在于药物分子中,因此芳烃的直接氘化有利于生产和开发高活性新药。在已报道的方法中,芳基卤化物通过锂卤交换、过渡金属催化、光诱导和电化学脱卤氘化等方法应用比较广泛。此外,也可以使用芳基重氮盐和芳基噻蒽盐作为亲电芳基试剂,以及芳基硼酸或酯、芳基醛和芳基偶氮砜作为亲核芳基试剂来合成氘化芳香族化合物(图1)。然而,以上方法需要使用高活性烷基锂试剂、过渡金属催化剂、强碱、光敏剂或昂贵的氘供体,这限制了其应用范围。因此,开发无金属条件下,使用廉价的D源,以环境友好的方式合成氘化化合物的新方法具有重要意义。
芳基三氮烯具有良好的稳定性和优异的反应性,被作为理想的芳基源或导向基团广泛应用于各种合成转化中。新疆大学刘晨江教授、张永红教授课题组在近年来将其作为容易获得的芳基化试剂开发安全和可持续的有机合成方法的持续研究(Org. Lett., 2016, 18, 2000−2003; Asian J. Org. Chem., 2017, 6, 102−107; New J. Chem., 2019, 43, 9255−9259; ChemistrySelect., 2021, 6, 5701−5704; Arabian J. Chem., 2021, 14, 103158−103167; Synthesis, 2022, 54, 5110−5118; Adv. Synth. Catal., 2022, 364, 1962−1968; Eur. J. Org. Chem., 2023, 26, e202300044; J. Org. Chem., 2023, 88, 11056−11068; Org. Chem. Front., 2023, 10, 6063−6069; Org. Chem. Front., 2024, 11, 1050−1056)基础上,发现芳基三氮很容易被光活化,产生芳基自由基,然后可以从大多数溶剂中攫取质子。受此启发,近日该团队在室温无催化剂的条件下,以相对廉价的CDCl3为氘源,开发了一种光促进芳基三氮烯选择性脱氮氘化方法。该方法具有操作简便、条件温和、氘源廉价、位点选择性高和底物范围广等特点。由于芳基三氮烯可通过芳胺制备,因此该方法可作为一种将氘原子引入芳香体系的通用新方法。相关成果以“Photoinduced Catalyst-Free Deuterodefunctionalization of Aryltriazenes with CDCl3”为题在线发表于Org. Lett.(DOI: 10.1021/acs.orglett.4c01350)。
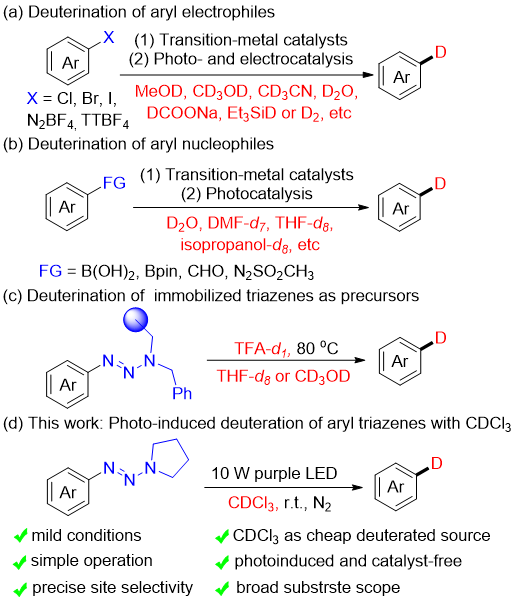
图1. 芳香族化合物的氘代合成策略(来源:Org. Lett.)
光诱导芳基三氮烯与CDCl3的氘化反应研究
表1. 反应条件优化a(来源:Org. Lett.)

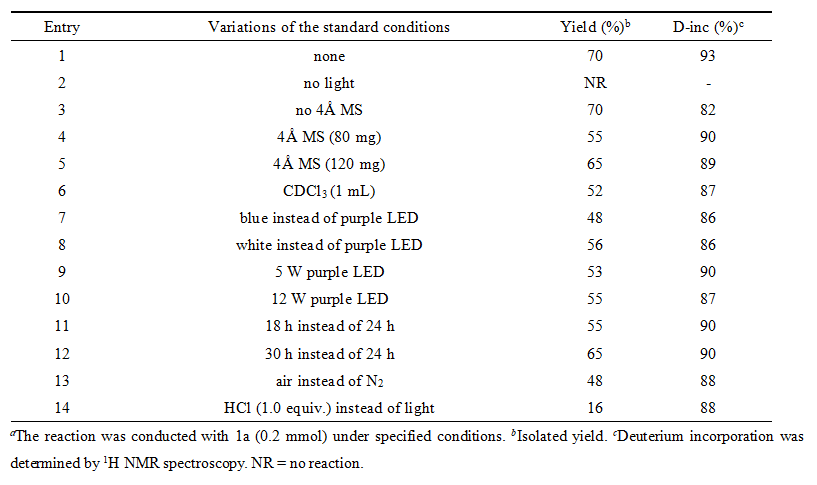
在条件筛选中,作者系统考查了光源,溶剂和添加剂用量,最终确定了最佳的反应条件为:室温氮气氛围下,以CDCl3 (1.5 mL)为氘源和溶剂,芳基三氮烯(0.2 mmol)在10 W紫光照射下搅拌反应24小时,以70%的收率和93%的氘代率得到相应的目标产物。在此条件下作者对芳基三氮烯的底物范围进行了考察(图2),具有不同骨架的芳基三氮烯,均具有良好的耐受性,并能有效地转化为相应的产物。值得注意的是,药物分子苯佐卡因也能成功地转化为相应的氘化产物,产率为75%,氘代率为87%。此外,还成功地获得了含有两个氘原子的氘代产物。研究还发现含氟、氯和溴原子的芳基三氮烯也能适用于该反应,并成功地得到含氘的产物,这些产物可以通过各种过渡金属催化交叉偶联进一步转化。为了进一步证实该方法潜在的应用性,作者进行了放大实验,将反应放大至1 mmol,以83%的收率,90%的氘代率到目标产物,证明该反应具有一定的应用前景。
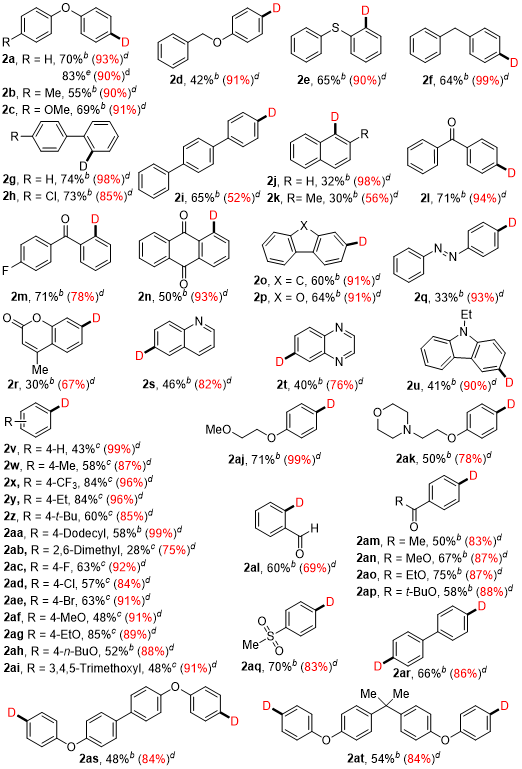
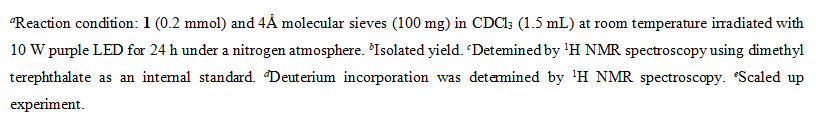
图2. 芳基三氮烯的底物范围a,b,c,d,e(来源:Org. Lett.)
为了阐明该反应的历程,作者首先进行了自由基捕获实验(图3),通过实验证明,在反应体系中分别检测到了自由基加合物3和4,说明在该反应中存在芳基自由基,可能经历一个自由基历程。并通过EPR实验检测到了强的碳自由基信号,进一步表明该反应过程中存在芳基自由基(图3)。
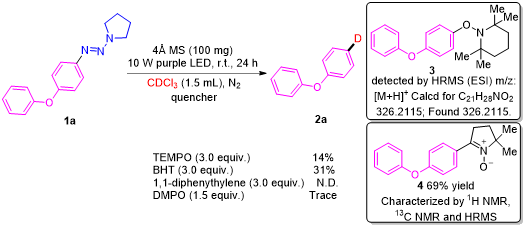
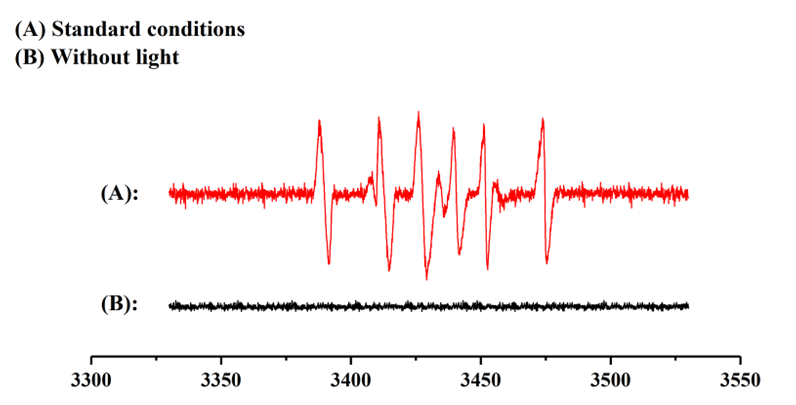
图3. 自由基捕获实验及EPR实验(来源:Org. Lett.)
另外,作者进行了开关灯实验,在紫光照射时,反应可以顺利进行。无光照射时,反应则立即停止(图4)。实验结果证明连续的紫光照射是该反应顺利进行的必要条件,也是不可或缺的关键因素。
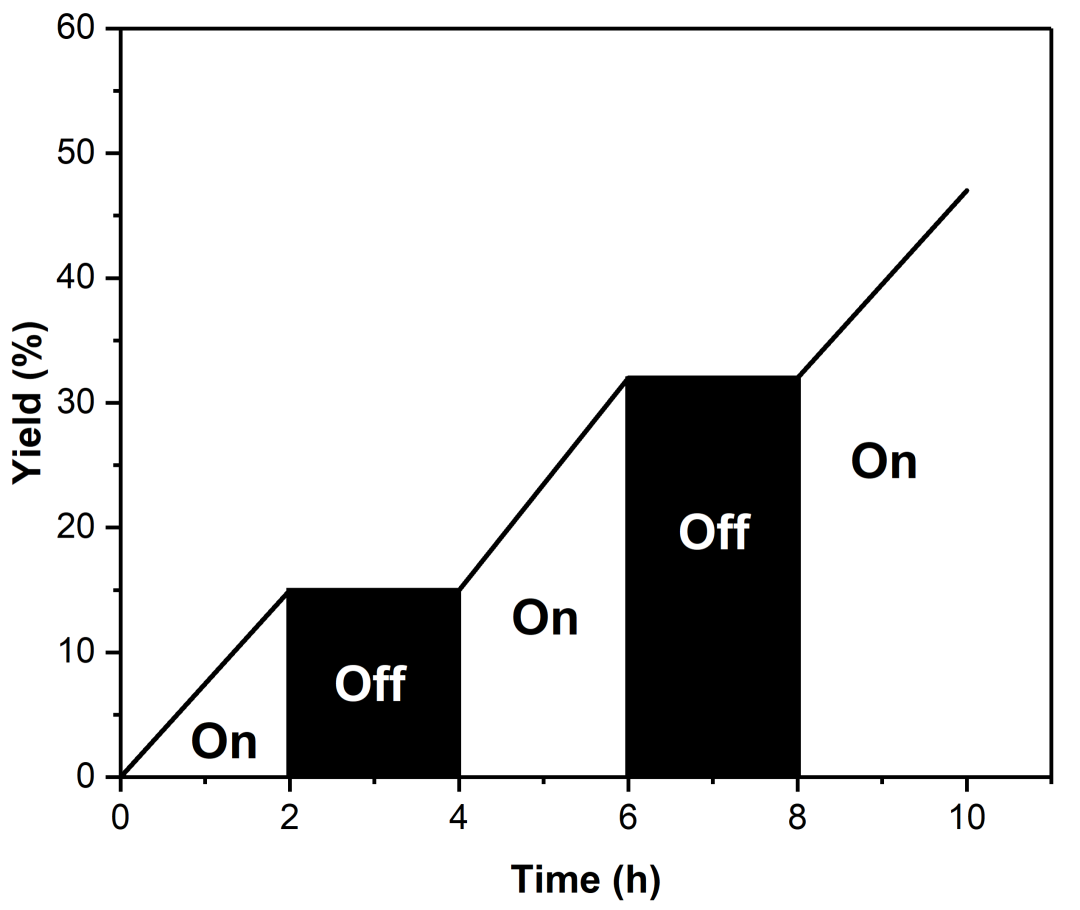
图4. 开关灯实验(来源:Org. Lett.)
基于以上研究,作者提出了该反应的可能机理(图5),最初,在光照条件下,芳基三氮烯的N1= N2键异构化形成了碱性更强的(Z)-芳基三氮烯。接下来,(Z)-芳基三氮烯被体系中的水或HCl中的质子活化,并分解生成四氢吡咯和芳基偶氮中间体A,其进一步与Cl或OH阴离子通过单电子转移(SET)生成芳基自由基B,并释放N2。随后,芳基自由基B与CDCl3通过氘原子转移(DAT)生成最终的氘代产物2和CCl3自由基。CCl3自由基与Cl或OH自由基偶联形成四氯化碳或不稳定的三氯甲醇中间体,三氯甲醇分解成盐酸和二氧化碳。最后,四氢吡咯和盐酸结合产生四氢吡咯盐酸盐。
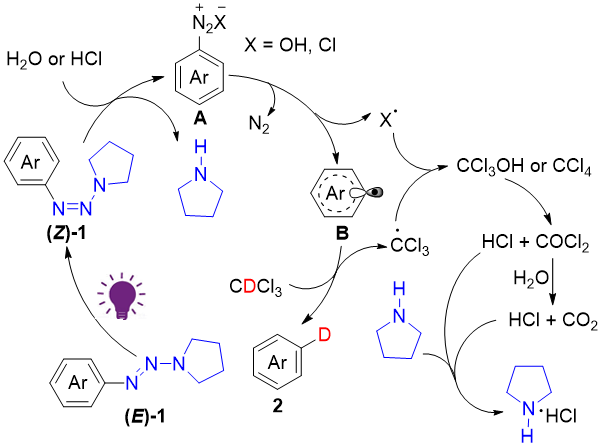
图5. 可能的反应机理(来源:Org. Lett.)
新疆大学王斌高级实验师和硕士研究生邵洋为共同第一作者,张永红教授和刘晨江教授为通讯作者。详见Bin Wang, Yang Shao, Ziren Chen, Yu Xia, Fei Xue, Weiwei Jin, Shaofeng Wu, Yonghong Zhang, and Chenjiang Liu. Photoinduced Catalyst-Free Deuterodefunctionalization of Aryltriazenes with CDCl3. Org. Lett. DOI: 10.1021/acs.orglett.4c01350.
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





