华中师范大学张国柱/郭瑞团队 ACS Catal.:光诱导铜催化环氧乙烷的开环不对称炔基化反应
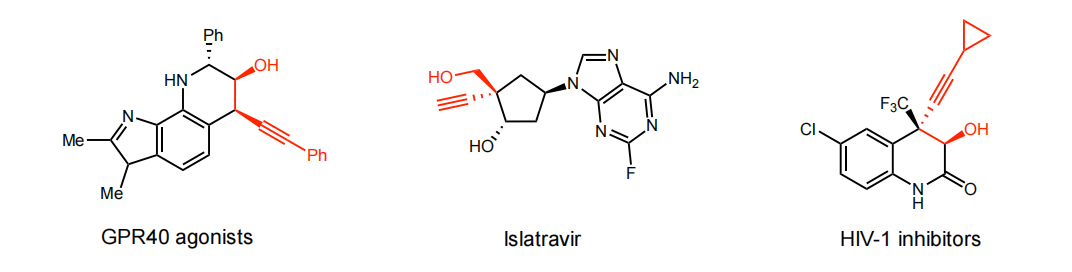
环氧乙烷是一个具有高张力环的优势亲电试剂,是有机合成化学中常用的合成中间体,发展催化不对称的环氧乙烷和各种亲核试剂的开环反应可以制备多样化的手性醇衍生物。高炔丙醇的片段广泛的存在于天然产物和药物分子骨架中,具有重要的生物活性。例如降血糖口服激动剂(GPR40 agonists)、临床上用于艾滋病预防和治疗的依斯拉韦(HIV-1 inhibitors)都包含有高炔丙醇核心骨架。
图片来源:ACS Catal.
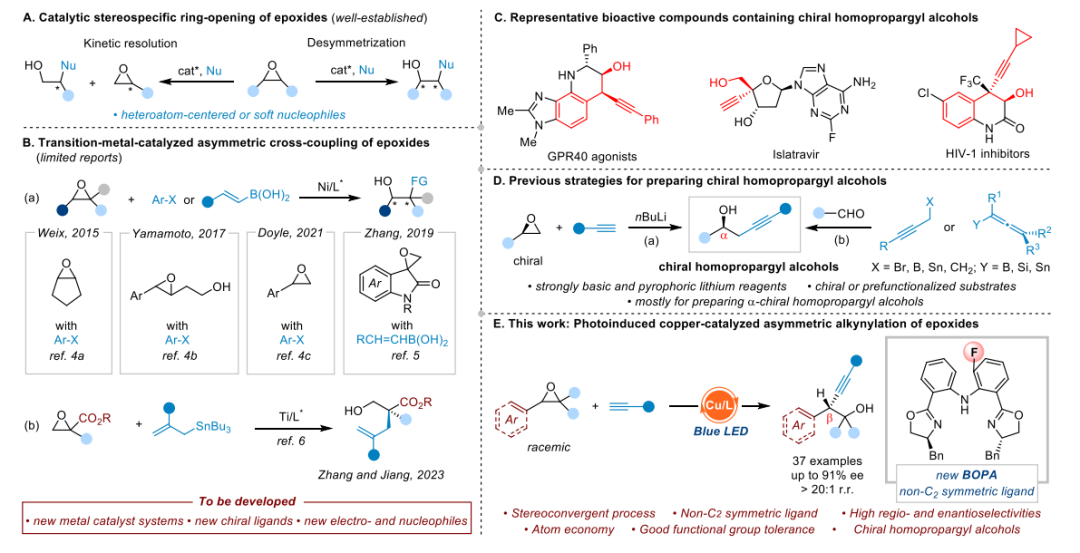
近年来过渡金属催化环氧乙烷的开环不对称转化也得到了很好的发展,比如 2015 年,Weix 课题组通过共催化的模式首次实现了芳基溴代物和内消旋环氧乙烷的不对称转化构建反式芳基烷醇。随后 Yamamoto 课题组报道了 3,4 环氧醇的芳基化反应,羟基作为导向基团可以控制优秀的立体选择性。2021 年,Doyle 课题组报道了一例光诱导 Ni 催化的芳基碘代物和苯基环氧乙烷的不对称还原偶联构建二芳基醇衍生物。2023 年,山东大学张永强课题组报道了 Ti 催化环氧乙烷和三叔丁基锡的不对称烷基化反应构建季碳手性中心。
图片来源:ACS Catal.
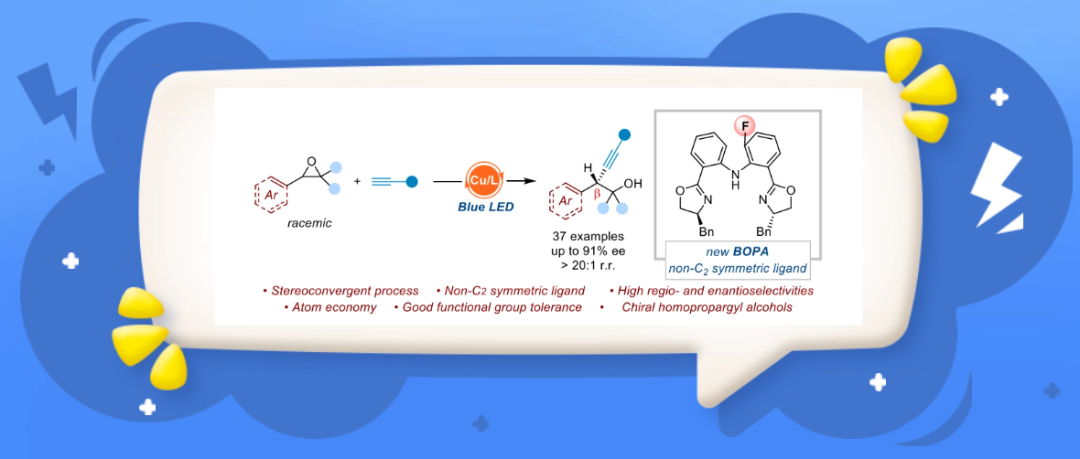
尽管已经有了这些发展,对于环氧乙烷的催化不对称转化依然是较少且具有挑战性的,因此发展新的过渡金属催化的体系、手性配体以及范围更广的亲电和亲核试剂在这个领域具有重要的研究意义。张国柱教授和郭瑞教授团队之前通过阴离子型的 NNN 三齿 pincer 型双恶唑啉配体,实现了炔铜参与的一系列不对称的自由基偶联反应(Angew. Chem. Int. Ed. 2020, 59, 13998-14002; Angew. Chem. 2022, 134, e202208232; Chem. Sci. 2021, 12, 4836-4840;Nat. Commun. 2021, 12, 6404-6411)。在此基础之上作者思考是否可以使用廉价易得的炔烃作为亲核试剂结合环氧乙烷来实现不对称开环炔基化反应,构建含有高炔丙醇骨架的分子。
光诱导铜催化环氧乙烷的开环不对称炔基化反应
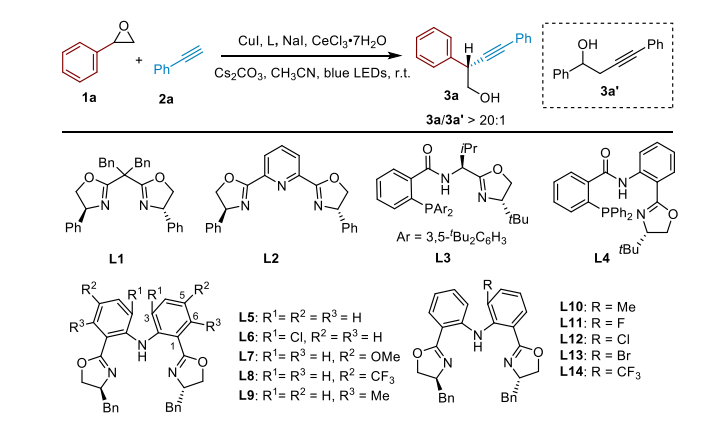
作者将苯基环氧乙烷和苯乙炔作为模板底物,10 mol% 的碘化亚铜作为催化剂,碳酸铯(0.11 mmol)作为碱,添加七水三氯化铈和碘化钠,在蓝色 LED 灯条件下对不同位阻的NNN 三齿 pincer 型双恶唑啉配体,铜源,溶剂以及 Lewis acid 的筛选,最终确定了最优的反应条件:10 mol% 的碘化亚铜作为催化剂,15 mol% BOPA 配体(L11),0.11 mmol 碳酸铯作为碱,添加 0.1 mmol 的碘化钠和 50 mol% 七水三氯化铈,1.0 mL 对二甲苯作为溶剂,在蓝色 LED 灯下反应 24 小时。
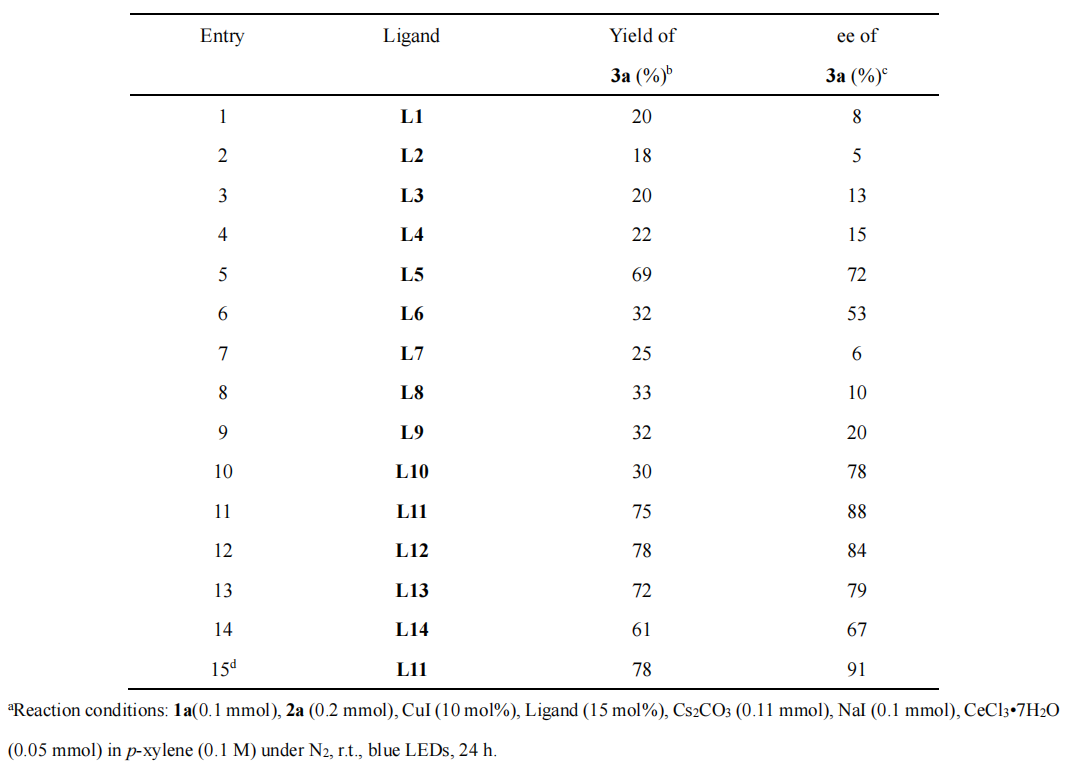
图片来源:ACS Catal.
在得到最优的反应条件之后,作者对苯乙炔的适用性进行了考察。无论是吸电子(如 F、Cl、Br)还是给电子基(Me、OMe)反应都可以以中等到较好的收率和对映选择性实现转化,其中富电子基团有利于该反应的进行,推测这是由于含有给电子基取代的苯乙炔亲核性更强,更有利于反应的发生。取代基的位置无论在苯乙炔的间位对位,反应均可以很好的进行。杂原子炔烃比如吡啶乙炔、噻吩乙炔、咔唑乙炔都可以以中等到较好的收率和对映选择性实现转化,烷基炔烃在该体系当中也能够有 75%的收率和 61%的对映选择性。
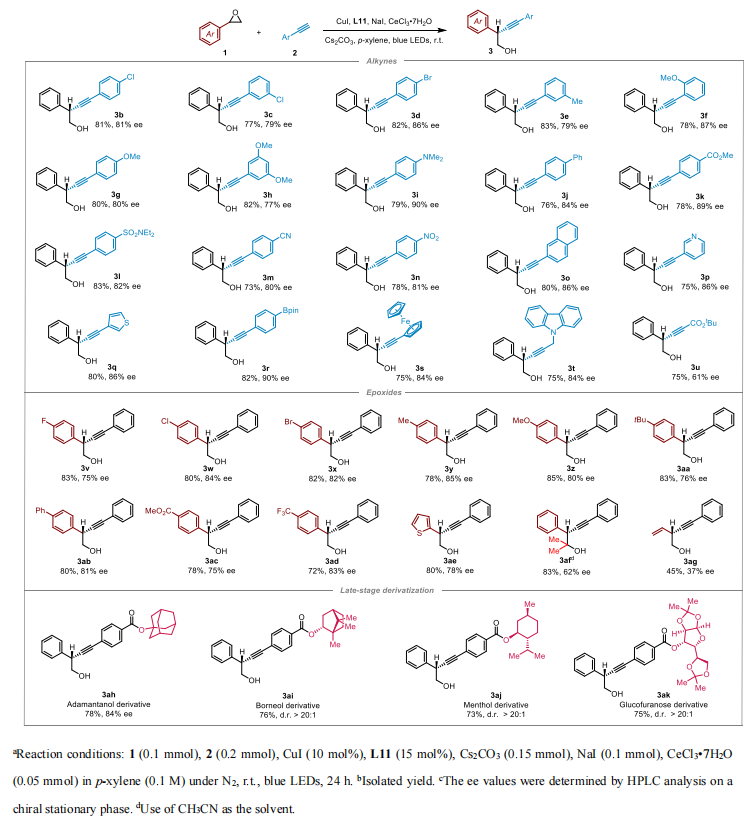
图片来源:ACS Catal.
随后,作者对苯基环氧乙烷的底物普适性进行考察。如表所示,当苯基环氧乙烷上引入 不同的吸电子基团(F、Cl、Br),给电子基(OMe、Ph)等,同样分别能以中等到较好的收 率和对映选择性得到目标产物,杂原子的噻吩环氧乙烷在标准的反应条件之下,也能得到 80% 的收率和 85%的对映选择性。烷基环氧乙烷只能得到 45%的收率和 33%的对映选择性,作 者推测可能是由于惰性碳手性中心的构建增大了反应进行的难度。一些复杂分子,比如金刚烷衍生物能够得到 78%的收率和 84%的对映选择性,莰烷醇衍生物,薄荷醇衍生物以及葡 萄糖衍生物都能以中等收率(73%-76%)和优秀的非对映选择性(d.r >20:1)得到目标产物, 扩展了该方法在含有高炔丙醇的天然产物和药物分子骨架合成方面的潜在研究价值。通过这 种方法得到的产物高炔丙醇也可以通过进一步的衍生化来构建多种多样的分子。
图片来源:ACS Catal.
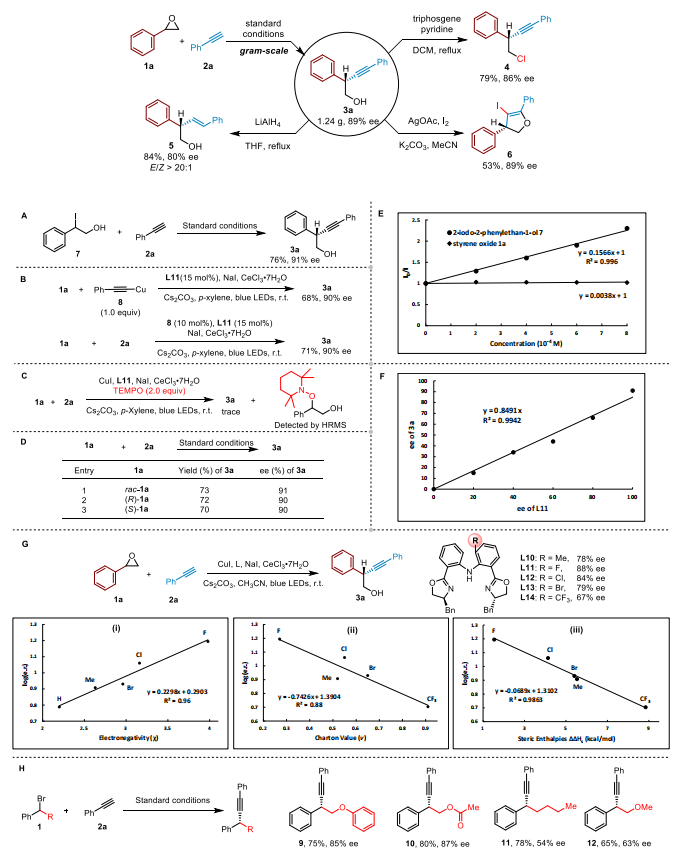
作者也通过一系列的机理实验来证明该反应过程是经过了一个环氧乙烷开环生成碘代物的一个中间体;炔铜作为体系中的双功能催化剂;自由基捕获实验表明该反应经历自由基过程;Stern-Volmer 实验和非线性实验结果表明铜盐与手性配体的 1:1 配合物可能是控制该反应立体选择性的关键;同时作者也探讨了计算的空间焓和对映选择性之间的关系。这些发现表明,吸电子和最小空间位阻的邻位取代基有利于立体化学控制,作者推测氟原子引起的两个苯环二面角的改变对于实现高对映选择性至关重要;最后作者通过溴化苄底物烷基取代基的空间效应对于控制反应的对映选择性至关重要。通过开环产生的羟基在决定对映选择性方面起着至关重要的作用,手性配体和羟基的独特特征共同有助于提高该反应的对映选择性,这与之前的烷基卤化物的不对称炔基化反应不同,特别是在立体选择性控制模式方面。
随后我们提出来了可能的催化循环机理,碱性条件下,铜和炔配位生成炔铜中间体,之后在光照条件下,激发态的炔铜还原环氧丙烷在 Lewis 酸条件下生成的烷基碘生成苄基自由基和二价铜物种,之后该二价铜物种捕获烷基自由基,再经过进一步的还原消除得到目标产物。
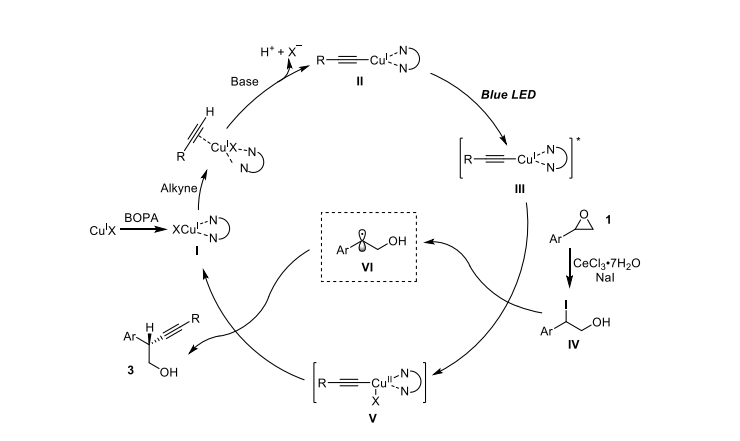
图片来源:ACS Catal.
综上所述,华中师范大学张国柱教授/郭瑞教授团队进一步拓展了炔铜-底物作为双功能催化剂在不对称偶联领域的应用。通过合理地设计底物,优化配体,成功实现了铜催化立体收敛式手性高炔丙醇衍生物的高效构建,进一步拓展了环氧乙烷在连串可见光活化/铜催化反应中的应用。实验结果表明了该不对称炔基化催化体系的特殊性:不同于传统炔铜参与的不对称反应,作者通过使用含氟的小位阻手性配体来实现底物的立体选择性控制,反应体系具有良好的官能团兼容性和底物普适性。产物也可以进行多种衍生化,进一步扩展产物的多样性以及验证不对称高炔丙醇衍生物的合成价值。为了对反应历程进行深入的理解,作者尝试了多种机理实验如非线性实验、紫外光谱检测,线性自由能实验等,来验证该反应可能的中间体以及配体对立体选择性控制的影响。
该研究得到国家自然科学基金的大力支持,相关研究成果发表在 ACS Catal. 上。华中师范大学李建烨和李思佳博士为该论文的一作者,张国柱教授和郭瑞教授为本文通讯作者。
论文信息
Photoinduced Copper-Catalyzed Regio- and Enantioselective Alkynylation of Epoxides
Jianye Li, Sijia Li, Guo-Hao Cui, Kaiyao Yuan, Chenwei Wang, Chen Yang, Guozhu Zhang*, and Rui Guo*
ACS Catal. 2024, DOI: 10.1021/acscatal.4c00818
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




