西班牙加泰罗尼亚化学研究所Suero课题组:光催化氧化自由基极性交叉实现烯烃的烷氧基重氮甲基化
期刊名:《Journal of the American Chemical Society》
DOI:10.1021/jacs.4c00867
偶氮化合物是一类存在于天然产物中的中性偶极分子,在合成有机化学、化学生物学和酶的定向进化中有着广泛而有用的应用(图1A)。尽管科学家们已经开发了有效的合成路线,但是还没有科学家使用苯乙烯或1,3-二烯等烯烃起始原料的催化合成偶氮化合物,然而,在催化过程中保持高度灵敏的重氮官能团可能是一个有待克服的主要挑战。

2018年,科学家报道了一种基于芳基C−H键与环状和伪环状重氮甲基取代高价碘试剂的重氮甲基化反应,用来合成有价值的重氮乙酸酯(图1B)。这项工作的关键是光催化生成亲电的重氮甲基自由基[N2=C(·)=CO2R],这是双线卡宾的反应性等价物。后来,其他小组报道了这类自由基,由高价碘试剂或硫类似物以及末端重氮化合物产生,容易与肼、酰基、炔、喹恶酮或苯乙烯发生[3+2]环化反应,提供了五元杂环以及吲哚的扩环。在后一种情况下,重氮官能团没有保留下来,而是参与了环化反应,甚至在这个过程中消除了二氮。
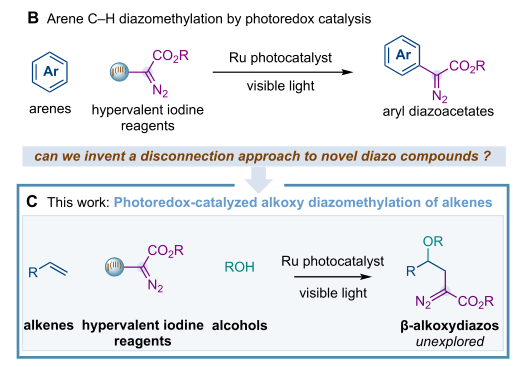
为了发明一种使用简单的烯烃如苯乙烯或1,3二烯来催化重氮化合物的新路线,科学家们设想通过光氧化还原催化的氧化自由基−极性交叉进行的烷氧基重氮甲基化反应是否可以实现上述过程(图1C)。这一想法的成功发展将代表一种使用这种不饱和底物作为起始原料的新的断开方法,并将允许获得β-烷氧基重氮基,这类化合物由于缺乏合成方法而尚未被探索。据调查文献可知,只有一种合成方案可以从铜催化的乙烯基重氮化合物的重排反应中获得相关的β,β-二烷氧基重氮类似物。然而,这种方法的范围有限,在那项工作或后来的工作中没有展示任何综合应用。
在这里,来自加泰罗尼亚化学研究所的Suero课题组报告了第一个光氧化还原催化的烷氧基重氮甲基化烯烃的发现和发展(图1C)。这种基于重氮甲基自由基生成的多组分和断链的新方法导致了β-烷氧基重氮化合物的形成,这被证明在构建复杂分子方面是有用的。
最初,作者设想合适的Ru(II)光催化剂,在可见光照射下,将产生激发态Ru(II)*,能够与重氮甲基取代的高价碘试剂进行单电子还原,并提供重氮甲基自由基int-I(图2)。后者物种攻击相应的烯烃并生成int-II。Ru(III)物种是一种合适的氧化剂,可以与Int-II发生单电子转移并生成苄基正离子int-III。这个氧化步骤将防止int-II通过环化而不希望发生的演化,如先前报道的那样,通过自由基对重氮部分的末端氮的攻击。最后,醇的亲核加成将在质子消除时生成β-烷氧基重氮化合物3。
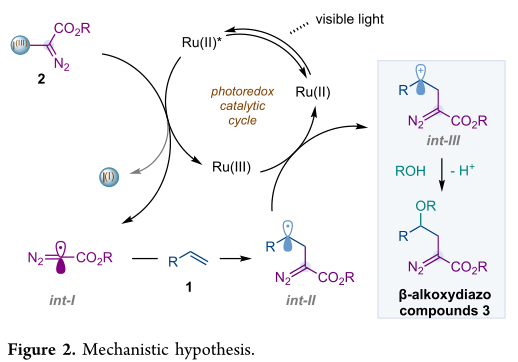
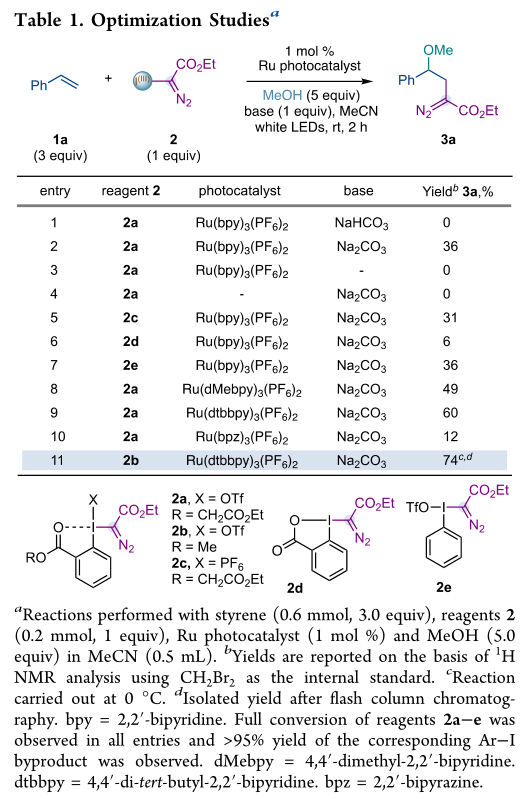
作者对碱,催化剂,碘化物的种类进行筛选,作者推测这种产率的提高(条目8和9)可能是由于这些光催化剂在激发态比Ru(bpy)3(PF6)2具有更好的还原能力,从而提高了自由基的生成效率。最后,作者观察到在0℃和试剂2b下进行的反应提供了更好的效率。2b是通过2a与甲醇的选择性酯化合成的,在范围评估期间使用替代醇时证明对酯化反应是稳定的。用Ru(dtbbpy)3(PF6)2和试剂2b或苯乙烯或3a进行的Stern−Volmer研究支持Ru(II)与2b的氧化猝灭(图2)。
在得到了最佳的反应条件后,作者接下来通过检测广泛的苯乙烯来评估光催化烷氧基重氮甲基化反应(表2A)。芳环上的邻位、间位和对位取代从一系列有用的官能团可以很好的兼容,包括卤化物(3b−e,j),乙酰氧基(3g)、甲氧基(3h)和三氟甲基(3i)。萘基(3k)、2-苯并呋喃(3l)和2-苯并硫代苯基(3m)等替代芳环效果良好。此外,作者还观察到具有伯烷基和仲烷基链的α-取代的苯乙烯(3n−q,3t−w)或芳环(3r)以较好的产率提供了所需的重氮化合物。
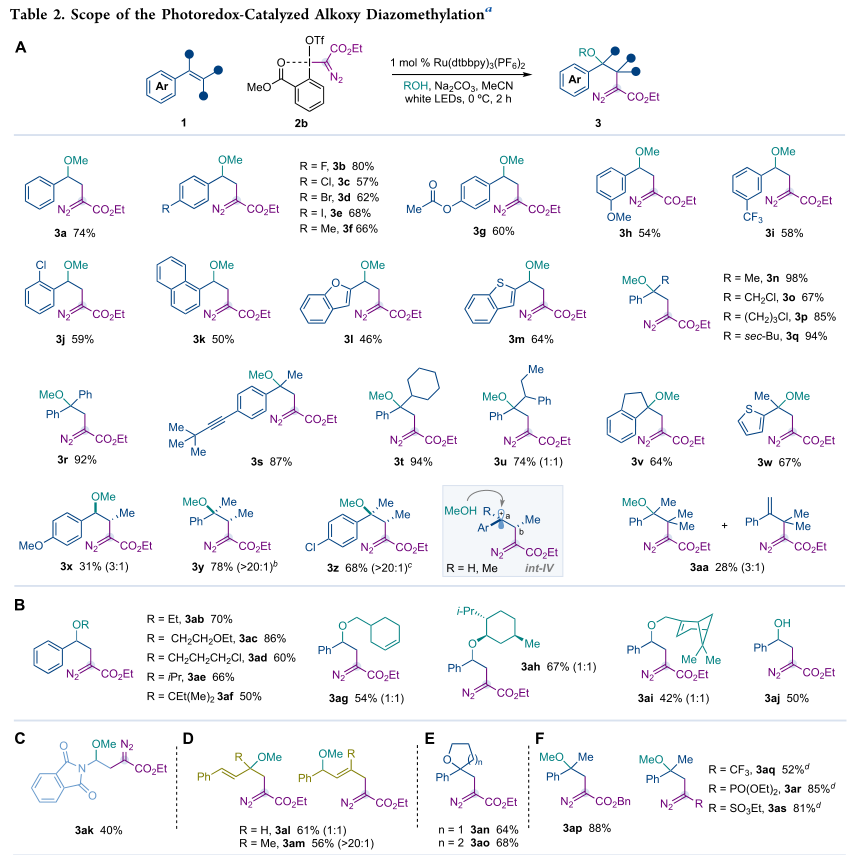
β-取代的苯乙烯,如(E)-茴香脑,以低效率和非对映异构体的混合形式提供了所需的化合物(3x,31%的产率,3:1)。相反,α,β-二取代苯乙烯的E/Z-混合物导致了β-烷氧基重氮化合物3y,z的高产率和良好的非对映收敛。通过化合物8和9的GOESY实验,确定了化合物3x和3y,z的主要异构体的相对构型。观察到的非对地收敛现象表明顺式构型中既有甲基的正碳阳离子int-IV(R=Me)的生成,也有反式构型的int-IV*的生成。这两个碳正离子可能通过Ca−CB键的转动处于平衡状态,结果支持甲醇的进攻在int-IV中发生得更快。α,β,β-三取代的苯乙烯导致了所需的β烷氧基重氮和通过质子消除生成的β-烯基重氮的混合物(3aa)。虽然效率很低,但证明了该方法能够形成以四元中心取代的重氮化合物。
在此之后,作者将注意力转向评估醇的底物范围(表2B)。伯醇、仲醇和叔醇为化合物3ab−ai提供了高效率。当苯乙烯(3u)或醇都含有立体产生中心(3ag−ai)时,没有观察到非对映控制。用水代替乙醇作为亲核剂,以适中的产率合成了β-羟基重氮化合物3aj。
对不饱和底物的进一步探索表明,烯亚胺也起作用,导致了β-甲氧基-β邻苯二甲酰亚胺重氮3ak(表2C)。将烷氧基重氮甲基化反应应用于1,3-二烯,如(E)-1-苯基-1,3-丁二烯和(E)-3-甲基-1-苯基-1,3-丁二烯,得到了一类新的重氮化合物3al−am(表2D)。令人高兴的是,在这两种1,3-二烯中,重氮甲基自由基的攻击选择性地发生在末端位置,在单电子氧化时,为(E)-1-苯基-1,3-丁二烯提供了非选择性的烯丙基阳离子,为(E)-3-甲基-1-苯基-1,3-丁二烯提供了良好的选择性。尽管已知α-酯C自由基能与未活化的末端烯烃很好地反应,但不能用重氮甲基自由基和该类型的烯烃如3-苯基-1-丙烯来鉴定所需的重氮化合物。
另一方面,烷氧基重氮甲基化反应是通过将4-苯基-4-烯-1-醇或5-苯基十六烷-5-烯-1-醇分别转化为四氢呋喃和四氢-2氢吡喃环β-取代的重氮化合物来实现的(表2E,3an−ao)。最后,作者成功地完成了一个高价碘试剂范围,用苄酯(3af)取代的衍生物,以及替代的电子吸引基团,如三氟甲基(3aq)、膦酸(3ar)或磺酸盐(3as)(表2F)。
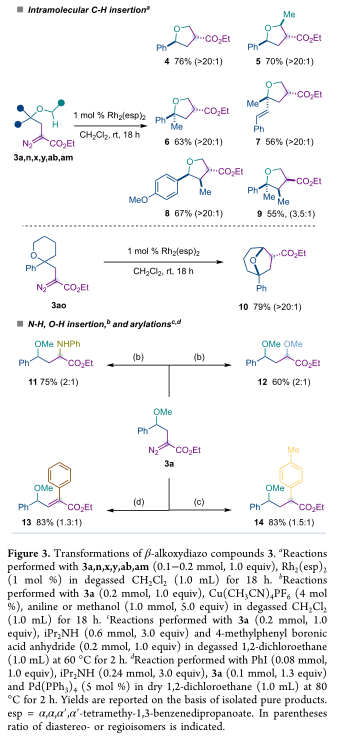
新的β-烷氧基重氮化合物的合成潜力后来被探索使用Du Bois催化剂Rh2(esp)2通过分子内卡宾1,5 C−H键插入来构建与药物相关的富含sp3的四氢呋喃(4−9)和8-氧双环[3.2.1]辛烷(10)的合成潜力(图3)。值得强调的是,作者通常没有检测到来自众所周知的烷基取代的Rh-卡宾通过β-氢化物迁移的演化的烯烃亚产物。另一方面,作者证明了β烷氧基重氮3a可以参与重氮化合物的经典转化,如N−H和O−H与铜(I)卡宾物种的插入(11,12),与4-甲苯基硼酸酐的氢芳基化(14)或与苯基-钯(II)-卡宾物种的芳基化(13)。
总之,作者已经报道了一种新的多组分断开重氮化合物的方法,该方法使用有机合成中一些最容易获得的构件(苯乙烯、烯亚胺、1,3-二烯和醇)与重氮甲基取代的高价碘试剂相结合。该化合物的合成是通过光催化的自由基-极性交叉反应,通过选择性烷氧基重氮甲基化生成β-烷氧基重氮化合物。此外,这种新的重氮合成在经典的合成路线中是独一无二的,这些合成方法包括使用磺酰氮化物作为重氮转移试剂到1,3-二羰基化合物、肼的氧化、胺的重氮化或末端重氮化合物的官能化等。最后,这项新工作代表了一个利用高价碘试剂的双重自由基卡宾反应性作为一价碳前体的形式卡宾转移的新例子。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。




