Nature:Al-salen光催化环丙基酮的去消旋化
最近,德国明斯特大学(University of Münster)Ryan Gilmour课题组和Johannes Neugebauer课题组合作报道了一种手性Al-salen光催化剂催化的环丙基酮去消旋化反应,可以实现e.r.值高达98:2的去消旋化作用。该反应中,紫外光(λ=400 nm)的照射可以增强所用商业催化剂的反应活性,实现反应性和对映体选择性的同时调节,避免使用定制催化剂。相关研究成果发表在近期的《自然》杂志上(Nature 2023, DOI: 10.1038/s41586-023-06407-8)。
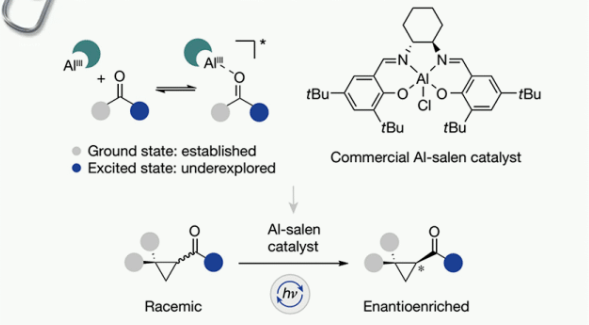
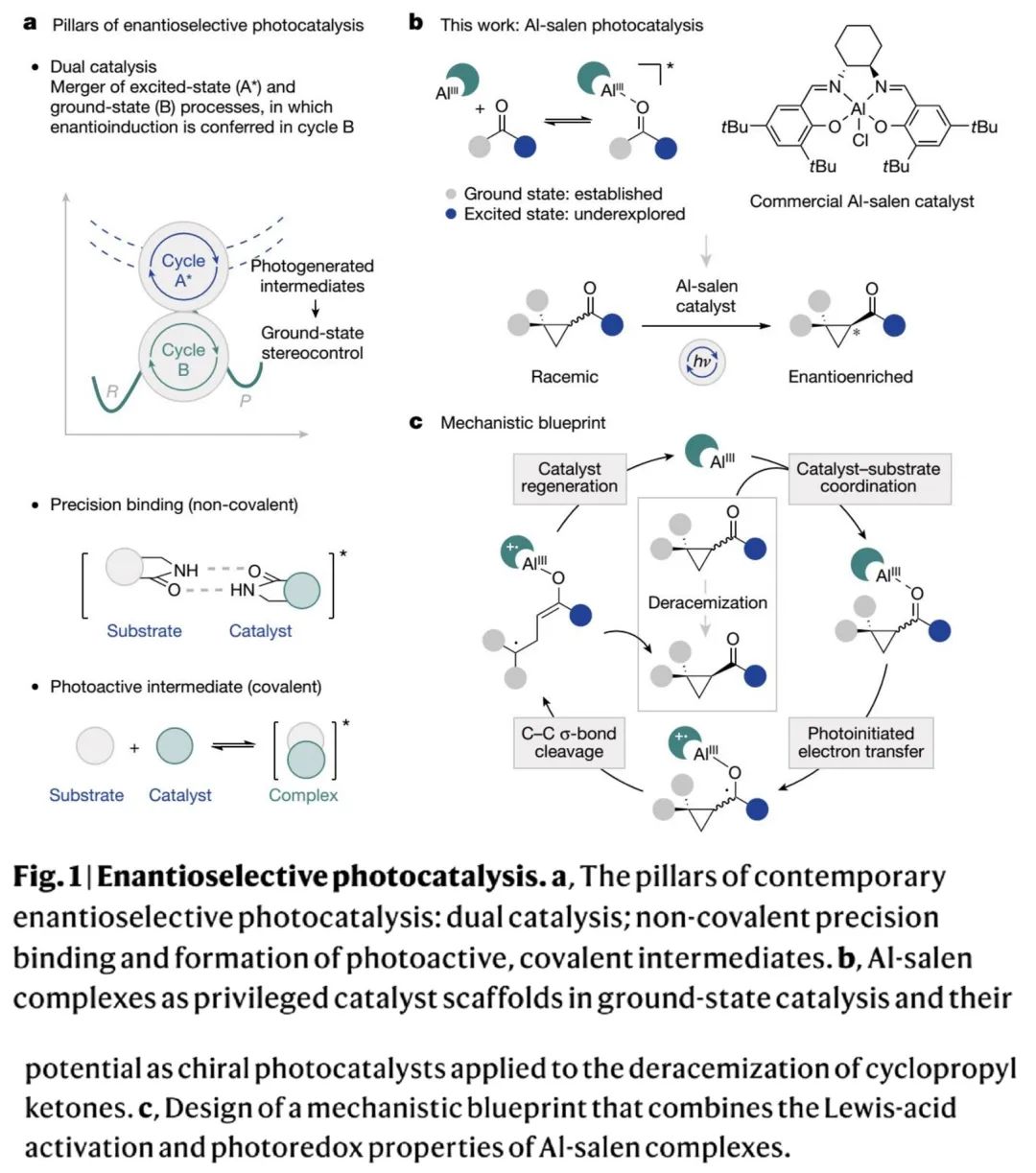
背景介绍(Fig. 1):
策略性地利用光辐射作为外部刺激源,来克服基态反应边界是当代催化学研究核心。催化剂设计的进步和精简化的操作平台已经达到了通过不可逆激活模式获得电子激发态的多种方法。这些策略降低了微观可逆性,减少了对化学计量试剂和危险操作条件的依赖,从而允许在温和条件下生成反应性物质。同时,光催化剂在生物偶联和细胞图谱方面的应用,进一步反映了这一研究在整个科学领域享有的广泛影响力。虽然这些成功突出了光催化在形成新键方面的有效性,但激活的非共价性质,加上所产生中间体的高反应活性,使得对映体控制难度较大(Fig. 1a)。激发态光催化剂和基态手性催化剂结合而成的双催化剂体系,是一种应用广泛的解决方案。相比之下,使用手性光催化剂直接控制对映选择性的研究明显缺乏代表性,这突出了识别和开发出“优秀手性光催化剂”的难度。Bach、Meggers、Yoon等课题组做出的开创性研究表明:在互补(氢键)识别官能团存在下,可以通过单一手性光催化剂的催化作用实现高水平对映体诱导。若能将这一模型拓展到含通用官能团的底物中,将非常具有吸引力,并最终得出更通用的手性光催化剂。
为此,德国明斯特大学Ryan Gilmour课题组和Johannes Neugebauer课题组认为:结合了路易斯酸活性、优越手性配体球面和良好光学性质这些特征的手性Al-salen光催化剂,是一种有前景的候选通用光催化剂。为了验证这一判断,作者尝试了环丙基酮的光促去消旋化反应(Fig. 1b)。其机理蓝图如Fig. 1c所示:环丙基酮消旋体和手性Al-salen光催化剂络合,在光辐射下发生电子转移,生成瞬时羰基自由基中间体;羰基自由基中间体易发生C-C键裂解,开环生成非手性自由基中间体;所得开环产物在手性环境控制下,对映选择性生成手性环丙基酮并再生催化剂,完成整个循环。
(Fig. 1,来源:Nature)
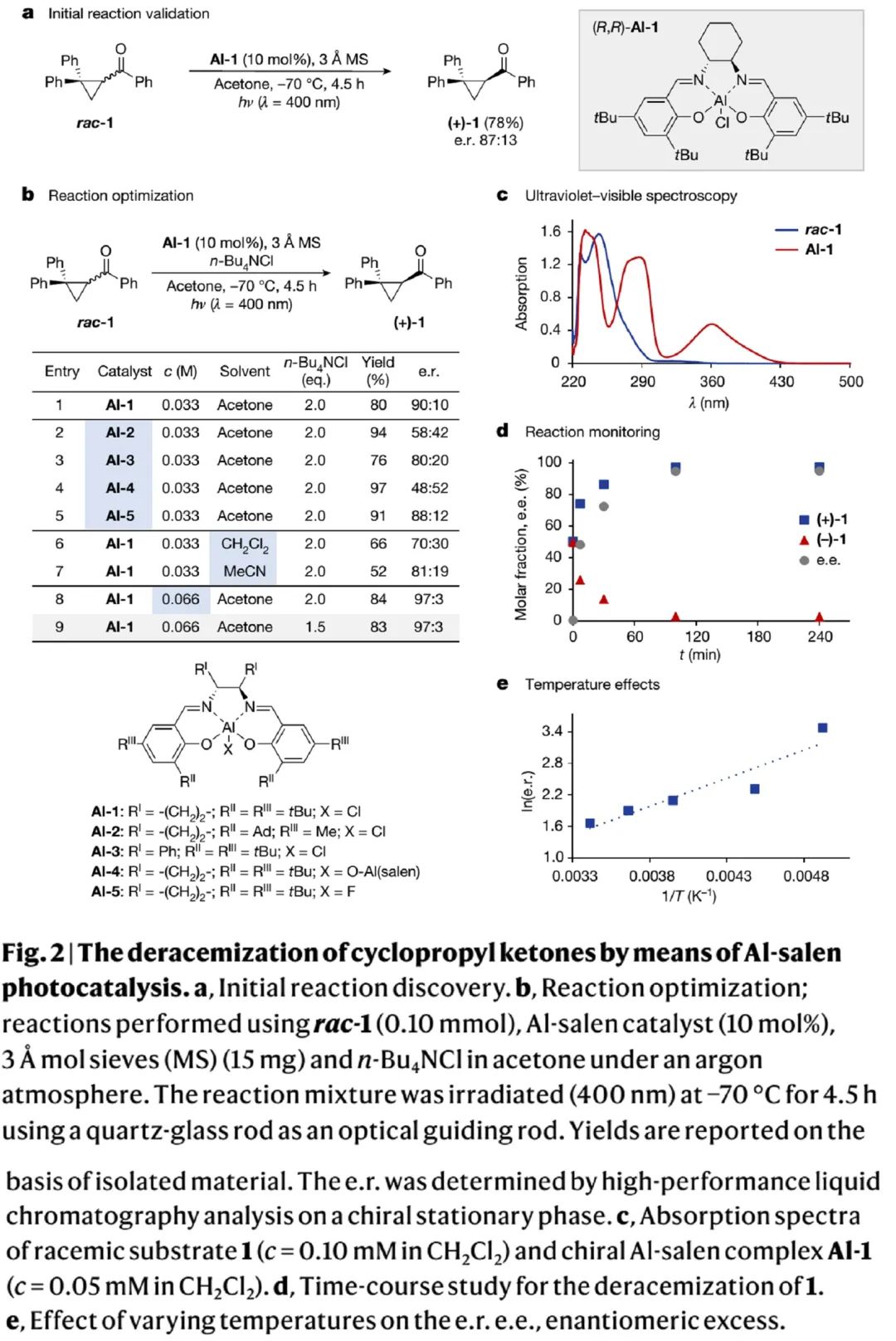
反应可行性研究(Fig. 2):
作者以环丙基酮消旋体rac-1为模板底物开展反应可行性研究。通过分析光催化剂和底物的紫外可见光吸收谱数据(Fig. 2c),作者选用了400 nm光源,可以选择性激发光催化剂。如Fig. 2a所示,在商业Al-salen催化剂Al-1催化作用下,经400 nm光照,rac-1能以87:13的e.r.值得到对映体纯的环丙基酮产物(+)-1。受此激励,作者进一步开展了反应条件优化。如Fig. 2b所示,通过对添加剂、Al-salen催化剂、溶剂和浓度等参数进行细致优化,得出如entry 9所示最优反应条件,反应能以83%的产率和97:3的e.r.值得到(+)-1。优化关键点包括:1)加入四正丁基氯化铵TBAC能提高反应产率和对映体选择性(entry 1);2)浓度对反应选择性影响较大(entry 1 vs entry 8);3)反应体系需要严格除氧和除水。详细条件筛选见Table S2-S5 in SI。同时,反应监测显示,反应100分钟后,即可实现rac-1的去消旋化和(-)-1的消耗(Fig. 2d)。
(Fig. 2,来源:Nature)
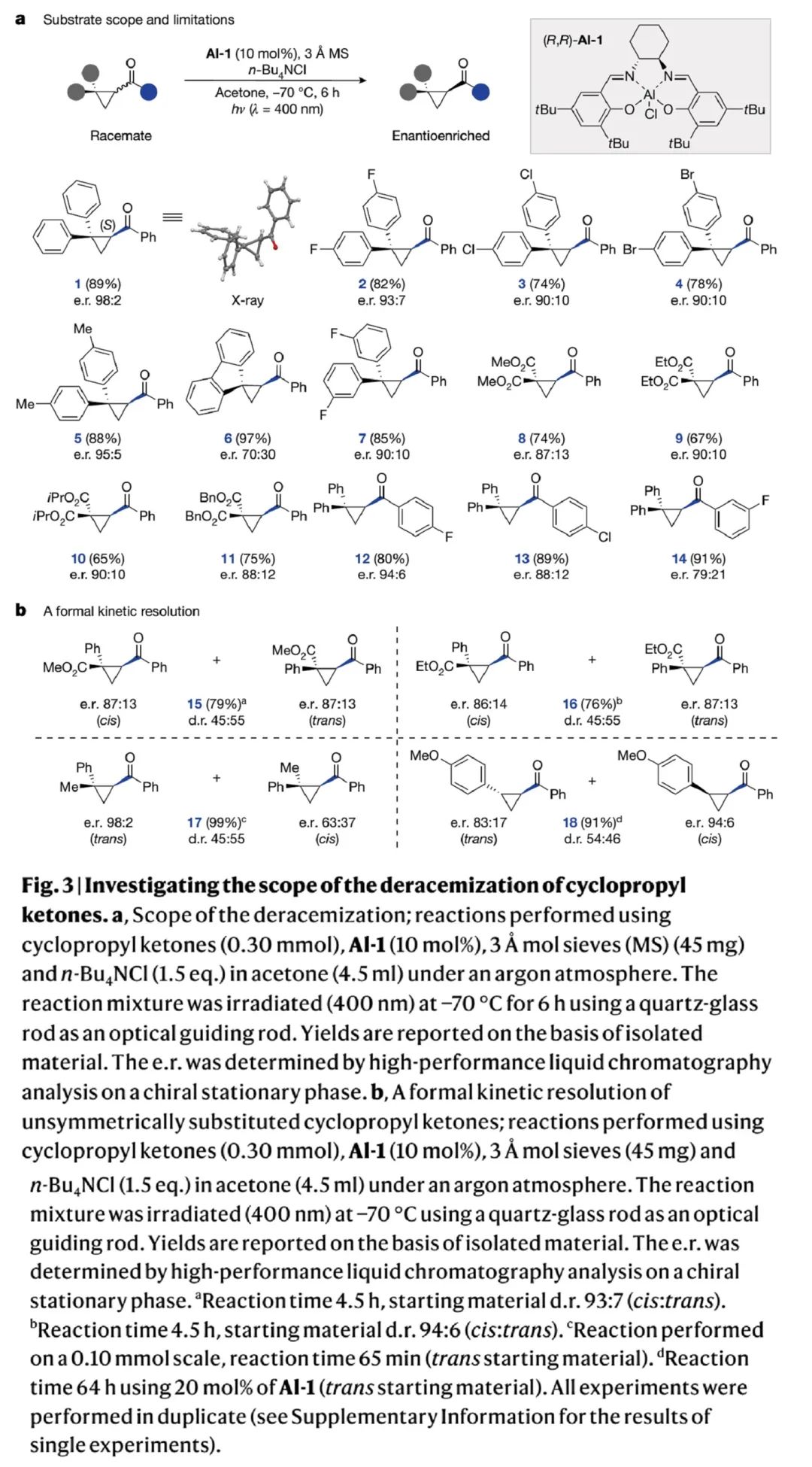
底物拓展研究(Fig. 3):
基于Fig. 2优化出的最优反应条件,作者接着开展底物拓展研究。如Fig. 3a所示,多种环丙基酮底物都能通过光促去消旋化反应,实现对映选择性转化。所涉及的底物包括:1)偕二苯基取代的环丙基酮,包括苯环对位或间位带取代基的化合物,能以优秀的产率和可观的对映选择性得到对应产物1-5、7、12,产物13、14选择性相对较差;2)带芴基的环丙基酮底物,所得产物6选择性相对较差;3)偕二酯基取代的环丙基酮,包括甲酯、乙酯、异丙酯、苄酯,能以优秀的产率和可观的对映选择性得到对应产物8-11。作者进一步尝试了不对称的偕二取代环丙基酮,并认为反应会通过形式动力学拆分,得到对映体纯的非对映异构体混合物。实验结果与作者设想一致(Fig. 3b),并可以通过延长反应时间和催化剂当量实现两个非对映异构体的高对映选择性(17 vs 18)。
(Fig. 3,来源:Nature)
机理研究和应用研究(Fig. 4、5):
为了理清反应历程并验证Fig. 1提出的去消旋化机理,作者开展了机理研究。Fig. 4a的控制实验显示,缺乏光照或催化剂会严重降低反应的对映选择性(50:50 e.r.);体系含水量则会部分影响反应的对映选择性(72:28 e.r.)。Fig. 4b中利用循环伏安法测得三种环丙基底物的氧化还原电势。对比研究显示,偕二乙基(19)或甲酯(20)取代的环丙基酮,虽和1的电势相差不大,但也足以阻碍去消旋化作用。可能原因是19和20反应中C-C裂解生成的自由基中间体稳定性更差,从而降低裂解步的反应速率。这证明催化剂的初始光化学电子转移不具有可行性。
为了进一步补充机理实验,作者开展了计算化学研究。Fig. 4c的计算化学研究显示,不同单线态激发态间的能量差(S1/S2),三线态自由基间的自由能垒(3INT1/3TS1),烯醇双自由基((Z)-3INT2/(E)-3INT2等四个)间的能量差和转化能垒,差距都很小,因此这些中间体的热力学稳定性和能量差不会决定产物构型。双自由基(E/Z)-3INT2间的快速构象转化(相比系间跨越更快),才是导致单线态关环过程中能够积累产物(S)-1的关键。
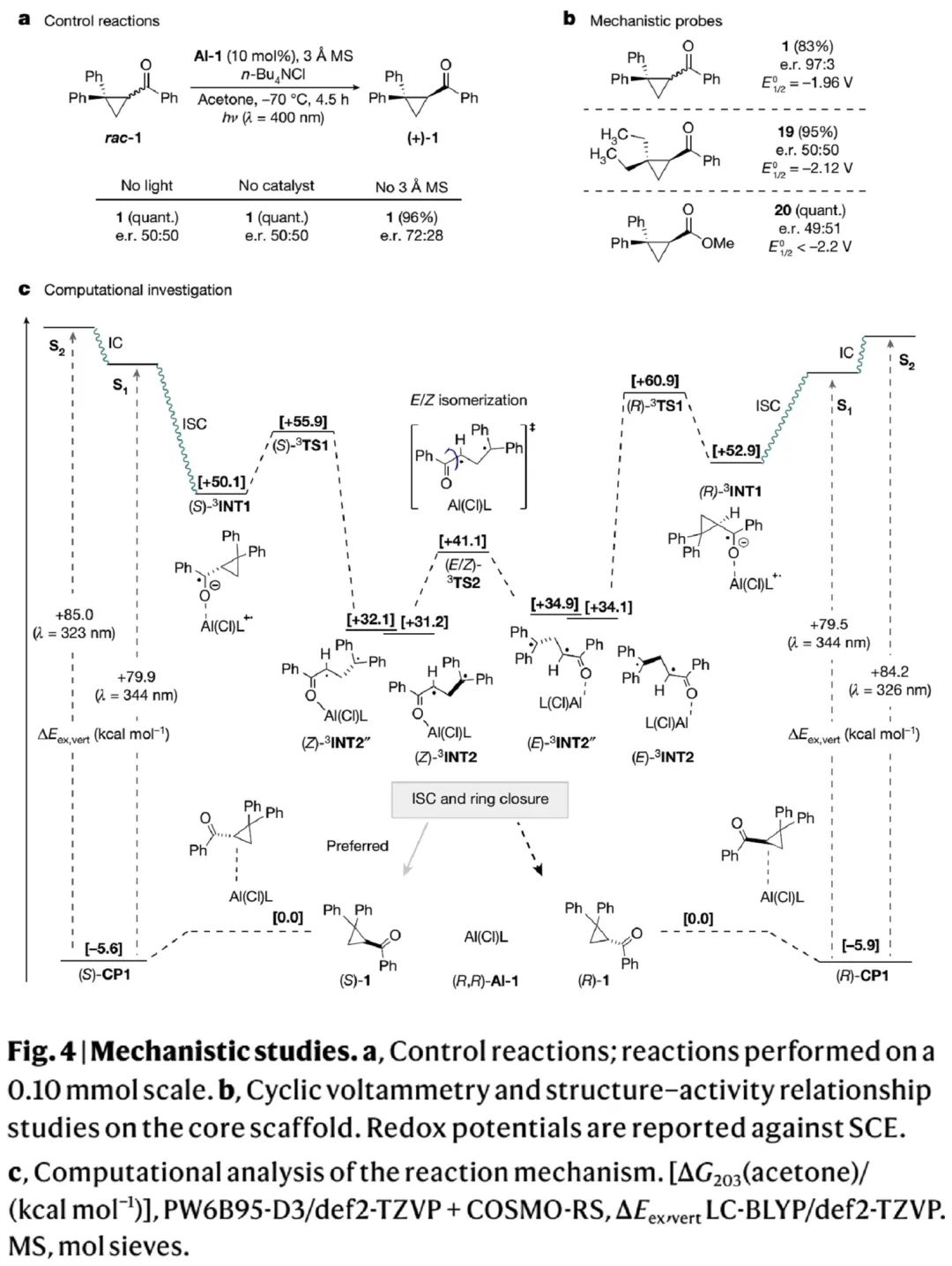
(Fig. 4,来源:Nature)
最后,作者开展了应用研究。如Fig. 5所示,偕二苯基和偕二酯基取代的环丙酮产物(+)-1、(+)-8、(+)-10,可以分别经Beckmann重排(a)、Johnson–Corey–Chaykovsky环氧化(b)、还原(c、f)、Baeyer–Villiger氧化(d)、还原/环化(e)反应转化成(+)-21-(+)-26六个化合物,并保持对映选择性。
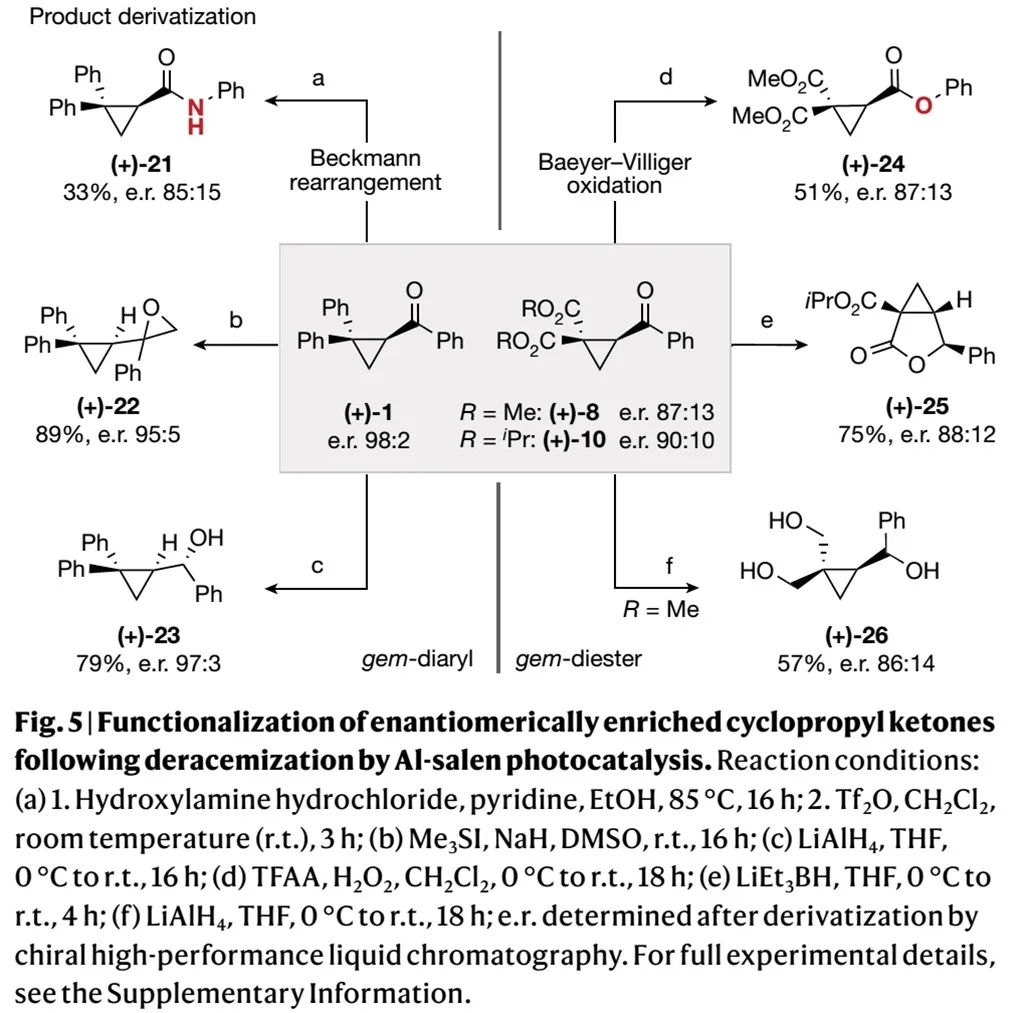
(Fig. 5,来源:Nature)
总之,Ryan Gilmour课题组和Johannes Neugebauer课题组合作报道了一种温和的手性Al-salen催化环丙基酮去消旋化光化学反应,该方法可以将多种偕二取代环丙基酮去消旋化。该研究成果具有开创性,但也存在底物普适性较差的局限。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





