苏黎世联邦理工学院Erick M. Carreira课题组:光催化和钴催化非活性烯烃环异构化合成杂环
饱和杂环是有价值的基石,存在于具有生物活性的天然产品以及药物和农用化学品中。过渡金属催化已被证明是快速获取这些结构的有效策略。Drago和Mukaiyama关于未活性烯烃水化的开创性成果为其他方法奠定了基础。尽管是等质的,他们的方法规定使用化学计量氧化剂和还原剂。后来,随着光催化的出现,光介导的烯烃功能化与侧链亲核试剂已被报道为快速得到杂环。光化学与Mukaiyama钴氢化物化学的结合为杂环的新合成方法提供了机会。在此,作者报道了第一个光催化和钴催化的非活性烯烃环异构化,以获得广泛的饱和杂环(图1)。在所有试剂都以催化量使用的情况下,这种转化构成了对化学方法的原子经济补充。产品包括吡咯烷、哌啶、四氢异喹啉、环氧化物、四氢呋喃、四氢吡喃、内酯、环亚胺酯、恶唑烷酮、铬酮和异铬酮。环异构化是一种等位转化,仅使用苯并噻嗪喹草酸光催化剂、Co-salen和三氟甲磺酸盐进行,不需要化学计量还原剂和氧化剂。

自Drago和Mukaiyama开创性发表以来,过渡金属催化氢原子转移反应一直是研究的焦点。使用Fe-、Mn-和Co-配合物结合化学计量的氢化物供体(如氢硅烷或i-PrOH),使未活性烯烃的功能化具有马尔科夫尼科夫选择性。最近,Shigehisa报道了烯烃与亲核试剂反应得到杂环如环醚和保护吡咯烷等。该转化是在N-氟吡啶盐氧化剂([F+ ])和硅烷还原剂的超化学计量量的存在下,用Co-salen催化剂进行的(图2,顶部)。后来,Zhu报道了类似的转变,其中[F+ ]被分子氧或电化学氧化取代,但过量的硅烷作为还原剂仍然是必要的。然而,在开发新的转化过程中,最小化化学计量试剂的数量是可取的。作者开始开发一种通用的催化溶液,用于未活化烯烃的可选择性环异构化,这种方法不需要化学计量试剂。

作者的Co-HAT项目和最近对通过光化学方法使烯烃功能化的兴趣促使作者研究了合成杂环的新方法。传统上,对[CoIII]-H的获取是通过添加化学计量硅烷来影响的(图2,底部)。1965年,在一项关于钴胺素的研究中,Schrauzer报道说,通过[CoIII]-Cl还原产生的[CoI ]−也可以通过相应的[CoIII]-H复合物的可逆去质子化来获得。在后来的通过Heck偶联形成碳环的研究中,作者发现i-Pr2NEt可以用于去质子化[CoIII]-H来解锁[CoI ]−的反应性。钴催化Heck型偶联成功的关键是[CoIII]-H中间体的脱质子可以用于关闭催化循环。仔细考虑涉及[CoIII]-HD[CoI ]−的酸碱平衡表明,一个[CoI ]−物种的质子化消除了[CoIII]-H化学中对化学计量还原剂的需要。2022年,Ohmiya和Nagao报道光和钴催化烯烃使用三氟甲磺酸盐碰撞质子化[CoI ]−和[CoIII]-H。根据这个背景,作者感兴趣的平衡涉及[CoIII]-HD[CoI ]−也可以利用开发杂环合成的一般方法。
之前,作者报道了PC在烯烃环丙烷化和碳-异功能化反应中的应用。试图研究在胺的环异构化中的效用。在初始实验中(5 mol% PC,1 mol% Co-1,10 mol% Col-HOTf,CH2Cl2,24 h,blue LEDs),5-氨基戊烯未能环化。作者假设碱性伯胺可以使酸性的三甲基吡啶三氟甲烷磺酸酯碰撞脱质子化。基于作者之前的研究,假设所得到的共轭酸(R-NH3 +)可能无法质子化[CoI ]−生成[CoIII]-H,这是实现Co-HAT化学的关键一步。因此,作者假设N-保护可以调节胺的碱性,以允许所需的反应性。
将N-tosyl烯烃1a与PC(5 mol%)以及Co-1(1 mol%)和Col-HOTf(10 mol%)放在二氯甲烷的惰性气氛下时,观察到64%的期望产物2a(表1,条目1)。对Fe、Mn和Co配合物的研究表明,二氯甲烷中的Co-1是转化的最佳选择。根据观察和假设作者决定检查一系列质子化胺作为添加剂。2,6-二叔丁基-4-甲基吡啶、吡啶、4-甲氧基吡啶和咪唑的氢三氟盐不产生任何产物,而科利丁和鲁替丁的氢三氟盐则导致产物形成。在优化条件下(1 mol% PC,0.5 mol% Co-1,10 mol% Lut-HOTf反应16 h,blue LEDs,条目2),2a的产率为98%。有趣的是,当Col-HOTf取代Lut-HOTf时,产品的收率只有47%(条目3)。基于这些观察结果,作者假设(三甲基吡啶与二甲基吡啶三氟甲烷磺酸酯)都包含许多关键特征,即适当的酸度、缺乏亲核性和光化学氧化还原稳定性。当反应在相同条件下在空气中进行时,2a的产率为67%(条目4)。在没有共催化剂、光催化剂、三氟甲磺酸盐或光的情况下,该反应没有得到产物,1a被完全回收(条目5-8)。

在优化的条件下,作者开始研究光环异构化反应的范围(图3)。为此,从相应的烯烃中获得了各种优良的保护杂环胺。具有未取代烷基主链的烯烃1a可得到2-甲基吡咯烷2a,产率为95%。该反应也适用于使用1,1-二取代烯烃,如产物2b所示,产率为61%。β-取代基具有耐受性,提供2c-2f,产率为67-94%。丙二酸1g和缩醛1h为有效底物,得到2g和2h分别为68和84%。当该方法扩展到包括六元环的形成时,2i-2m的哌啶的收率为59-92%。较大规模合成2i(3.0 mmol),收率为88%。为了证明不同保护胺作为亲核试剂的能力,将Boc-和Cbz保护胺1n和1o分别在反应条件下,分别以58%和92%的收率转化为相应的杂环2n和2o。值得注意的是,Ts基团用萘钠去除,螺线视素A(2p)dr为1.2:1,两步产率为43%。

磺胺类药物是一个历史上有影响力的治疗方法家族,至今仍在临床使用。因此,作者选择了COX-2抑制剂塞来昔布以及两种抗惊厥药物唑尼沙胺和托吡酯为例,以方便的两步程序展示它们的衍生化。烷基化后,在标准条件下进行环化,得到相应的2-甲基吡咯烷2q和2s产率分别为85和93%,而2-甲基哌啶2r产率为89%。
当Boc保护的烯丙基胺3a在反应条件下,相应的恶唑烷酮4a得到25%和62%的原料(图4)。采用N-取代Boc-烯丙基胺时,收率显著提高,恶唑烷酮4b-4d的收率为74-83%。作者提出这种转化通过具有异丁烯挤压的氧碳苯中间体进行。为了进一步扩大光环异构化反应的范围,作者探索了N-酰基磺酰胺类药物作为底物,因为它们将提供了一类未被充分探索的环状构建块。在反应条件下,3e产生环状酰亚胺4e,产率为98%。1,1-二取代烯烃4-甲基-N-4-烯酰胺(3f)得到相应的亚胺,产率为94%。螺旋体循环4g-4i的收率为94-97%。对于所有情况,通过未纯化反应混合物的1H NMR谱分析,没有观察到内酰胺的形成。酰亚胺4j-4k保持了良好的收率,6元产物4l的收率为91%。
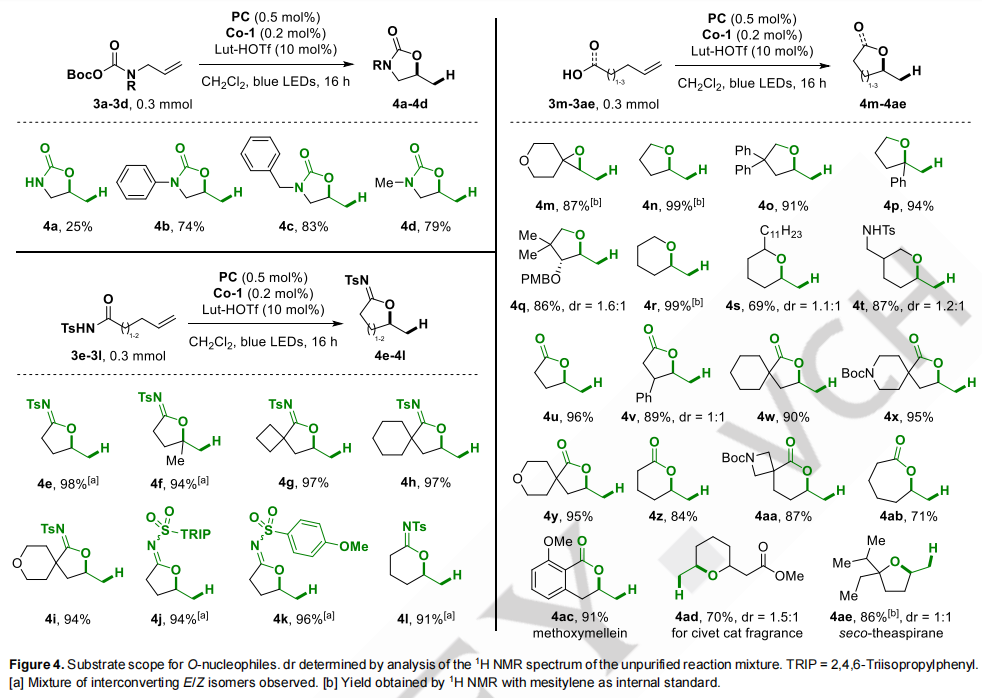
在建立了五种不同的含氮在建立了五种不同的含氮亲核试剂的光环异构化后,作者开始研究氧环的形成。环氧树脂4m的收率为87%,亲核试剂的光环异构化后,我们开始研究氧环的形成。环氧树脂4m的收率为87%,而醇3n-3t提供四氢呋喃和-吡喃4n-4t的产率为69-99%。在标准条件下,由不饱和酸生成内酯也是可行的,4-戊烯酸生成内酯4u的产率为96%。螺旋环己烷4w、螺旋哌啶4x和螺旋环吡喃4y的产率分别为90、95和95%。六烯酸3z和3aa的产物4z和4aa。最后,以6-庚酸合成了未取代的ε-内酯4ab,收率为71%。o,o-二取代苯甲酸3ac环异构化,得到天然产物甲氧基青霉素(4ac),收率为91%。四氢吡喃4ad通过光环异构化获得了70%的产率,随后纯化的顺式非对映体水解得到了从果子狸中分离出的气味原理。该香水4ae的产率为86%。
在建立了杂原子亲核试剂的范围后,作者感兴趣的是条件是否可应用于环化C-亲核试剂以获得六元苯并环化合物。在方案1所示的实验中,作者将茴香醚衍生物置于标准条件下,以获得6a-6c,产率为67-88%。

为了了解涉及[CoIII]-HD[CoI ]−的酸碱平衡的重要性,作者设计了一个光环异构化的机制结构(图5)。一开始,[CoII]-盐酚催化剂Co-1被激发态光催化剂PC*还原。这导致形成阴离子[CoI]-配合物,通过可逆质子化产生其共轭酸[CoIII]-H。后者随后将H原子添加到未活化的烯烃中,以提供更稳定的二级[CoIII]-烷基物种。该中间体被PC˙+氧化形成一个[CoIV]-烷基物种,这被认为与自由碳正离子处于平衡状态。碱基介导的[Co]复合物被亲核试剂取代导致产物形成,而[CoII]催化剂再生,关闭催化循环。

总之,作者开发了一种非活性烯烃环异构化的一般转化方法,利用N-、O-和C-亲核试剂在温和的条件下制备饱和杂环。该方法允许高效合成哌啶、吡咯烷、四氢呋喃和-吡喃、内酯、亚胺酯和恶唑烷酮等杂环。反应不添加化学计量还原剂或氧化剂,使后期功能化。对[CoIII]-HD[CoI ]−平衡的进一步研究为设计新的催化循环提供了额外的途径。更广泛地说,有机光氧化还原和过渡金属催化的合并肯定会为方法的发展开辟新的视野。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





